食品中伤寒沙门氏菌TaqMan探针实时PCR检测方法
曹冬梅 袁慕云 史媛媛 刘 洋 许龙岩 曹际娟*
(1.辽宁出入境检验检疫局 辽宁大连 116001;2.广东出入境检验检疫局)
1 前言
沙门氏菌(Salmonella)是人类重要的肠道致病菌,也可在动物肠道中繁殖或引起疾病。目前已知的沙门氏菌有2500多个血清型,在中国发现了200多个血清型。沙门氏菌所致疾病中最常见的一类是急性胃肠炎,可由不同菌型引起,以鼠伤寒沙门氏菌(Salmonella Typhimurium)、肠炎沙门氏菌(Salmonella Enteritidis)、汤卜逊沙门氏菌(Salmonalla thompson)等最为常见;另一类重要疾病是伤寒和副伤寒(统称肠热症),它们是一种独特的急性全身性发热性单核细胞内感染,由伤寒沙门氏菌(Salmonella Typhi)及甲型、乙型和丙型副伤寒沙门氏菌(Salmonella paratyphi)等引起,其中伤寒沙门菌是最常见的引发伤寒疾病的血清型,与食物中毒有直接关系;此外,还有败血症,由猪霍乱沙门氏菌(Salmonella Choleraesuis)等引起。
本研究小组已经建立了针对鼠伤寒沙门氏菌[1,2]、肠炎沙门氏菌[3]、副伤寒沙门氏菌[4]、猪霍乱沙门氏菌[4]、鸡伤寒沙门氏菌[5]等基于TaqMan探针实时PCR和焦磷酸测序技术的快速检测方法,可以实现快速鉴定。鉴于目前伤寒沙门氏菌鉴定主要是依靠传统培养的方法,即选择性增菌培养、生化鉴定、血清分型,通常要5-6天才能得出检测结果,不利于及时诊断、查找病源,控制病情的蔓延。因此,本研究针对伤寒沙门氏菌设计特异性检测的引物和TaqMan探针,并以鸡肉、鱼肉、猪肉为模拟样品,开展实时PCR检测方法的研究,以期快速、准确鉴定伤寒沙门氏菌。
2 材料与方法
2.1 材料
2.1.1 试验菌株
不同血清型的沙门氏菌共60株,其中1株伤寒沙门氏菌标准菌株,30株伤寒沙门氏菌分离株,27株其他血清型沙门氏菌,7株大肠埃希氏菌等非沙门氏菌标准菌株(具体菌株信息见表1)。上述菌株均采用API 20E 试剂条和血清学试验进行确证。
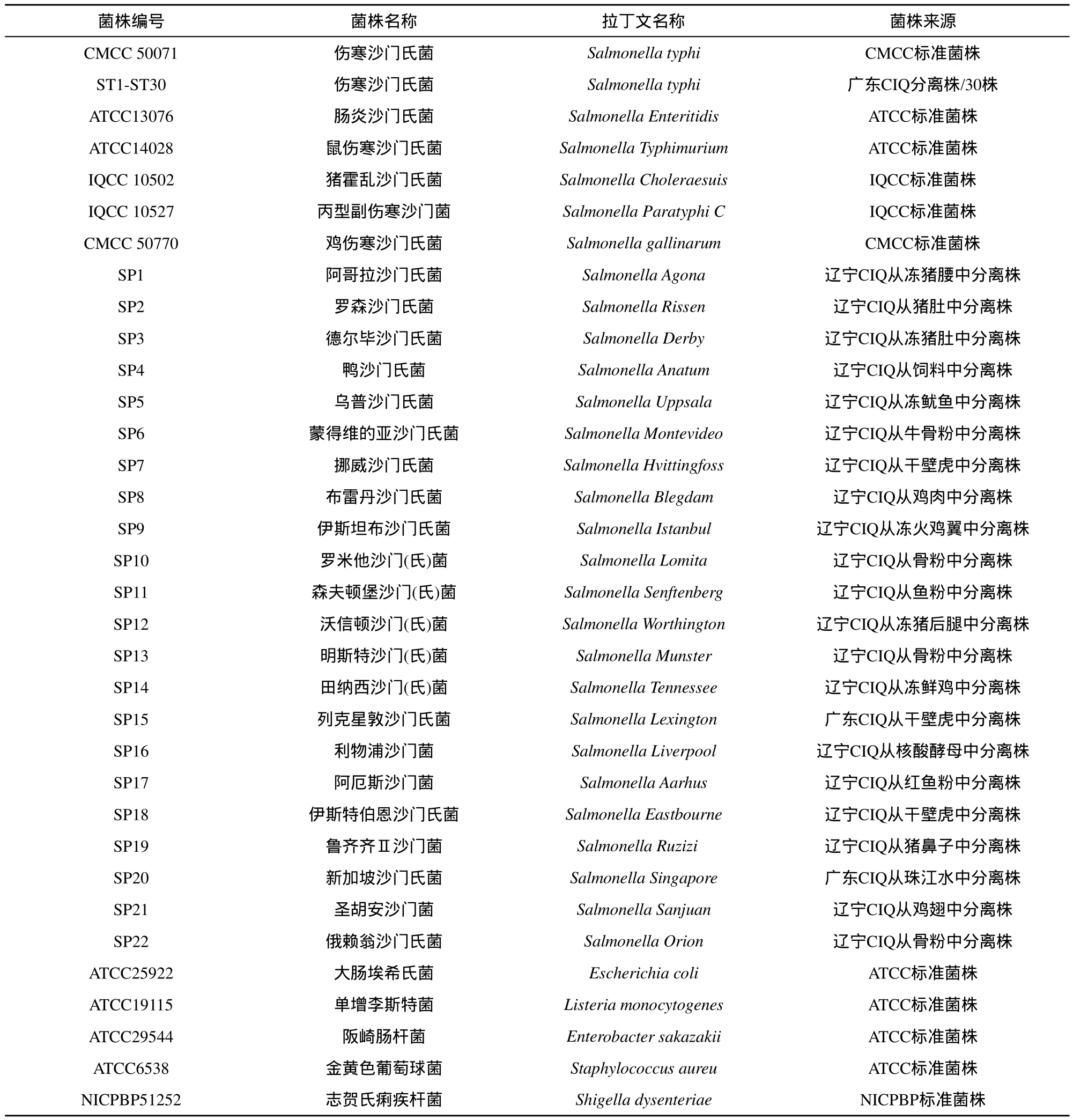
表1 菌株信息表

(续表)
2.1.2 主要试剂
TTB增菌液、BP缓冲蛋白胨水:北京陆桥技术有限公司;PCR用缓冲液、Taq DNA聚合酶、ROX、dNTP:宝生物工程(大连)有限公司。
2.1.3 主要仪器
实时荧光PCR:ABI 7500,美国;核酸提取仪:E7001,日本PPS公司。
2.2 方法
2.2.1 引物探针的设计与合成
根据GenBank公布的伤寒沙门氏菌基因序列,采用Oligo6.0软件设计引物和Taqman探针,特异性扩增伤寒沙门氏菌。引物和探针由宝生物工程(大连)有限公司合成,序列见表2。

表2 引物和探针信息表
2.2.2 DNA提取和特异性试验
所有沙门氏菌菌株采用BP缓冲蛋白胨水37℃培养10h,取10mL接种于TTB增菌液,44.5℃培养18h,取1mL菌悬液移入离心管,12000 r/min离心5min去上清,用1mL去离子水漂浮沉淀,12000 r/min离心3min去上清,重复两次,最后加200μL去离子水在核酸提取仪上提取DNA,用于实时荧光PCR扩增。非沙门氏菌阴性对照菌株用相应的培养基过夜培养,取1mL菌悬液移入离心管,按上述步骤提取DNA用于实时荧光PCR扩增。所有菌株的DNA用于伤寒沙门氏菌的特异性实验。
2.2.3 实时荧光PCR反应体系和参数
实时荧光PCR反应体系为30μL,其中模板DNA1μL、10 ×TaqMan缓冲液4μL、5mmol/LMgCl22μL、2.5mmol/L dNTPs 3μL、TaqMan探针20μmol/l1μL、正向和反向引物20μmol/l各1μL(共2μL)、UNG酶(0.55U)0.2μL、Taq聚合酶(2.5U/μL)3μL、去离子水13.8μL。实时荧光PCR反应参数为95℃30s,95℃5s,60℃34s,40个循环。
实时荧光PCR扩增曲线指数期明显、Ct<37为阳性判定原则。其中以Ct<35 且扩增曲线指数期明显可直接判定为阳性;Ct值在35-37之间判断为可疑,需要加大模板量进行重复实验,如出现指数期明显的扩增曲线方可判定为阳性,否则为阴性。
2.2.4 模拟样品检测和灵敏度试验
取鸡肉、鱼肉、猪肉样品,采用《食品安全国家标准 食品微生物学检验 沙门氏菌检验》GB4789.4-2010进行培养鉴定,确认无沙门氏菌污染。然后分别秤取25g 鸡肉、鱼肉、猪肉,每份样品中分别添加不同浓度的伤寒沙门氏菌菌悬液(以未添加菌液的样品作为阴性对照),制成12份模拟样品。在每份样品中加入225mL缓冲蛋白胨水,用拍打器拍打2min,37℃ 培养10h,取10mL移入90mL TTB增菌液,44.5℃培养18h,然后取增菌液提取DNA用于实时荧光PCR扩增。同时,不同浓度的模拟污染样品也用于实时PCR方法的检测灵敏性试验。所有模拟样品按照GB4789.4-2010与实时荧光PCR方法同步进行培养鉴定。
3 结果
3.1 特异性试验结果
取表1中所列的1株伤寒沙门氏菌标准菌株、30株伤寒沙门氏菌分离株、27株其他血清型沙门氏菌以及7株大肠埃希氏菌等非沙门氏菌标准菌株的DNA,采用表2中的检测引物和探针进行实时荧光PCR检测,结果见图1。

图1 伤寒沙门氏菌特异性试验的实时荧光PCR扩增图谱
图1显示,31株伤寒沙门氏菌的DNA样本经过实时荧光PCR扩增,均检出阳性增幅曲线;27株其他血清型沙门氏菌、7株非沙门氏菌的DNA样本的检测结果均为阴性。结果表明所设计的伤寒沙门氏菌检测引物和探针具有很好的特异性。
以伤寒沙门氏菌(CMCC 50071)菌株的系列稀释DNA为模板进行实时荧光PCR扩增,结果(见表3)显示,伤寒沙门氏菌菌株的模板浓度与Ct值之间呈现良好的线性关系,线性系数(R2)为0.994,扩增效率为94.5%。

表3 实时荧光PCR扩增效率
3.2 模拟样品检测和灵敏度试验结果
12份按不同浓度添加的模拟污染样品,经实时荧光PCR检测,均扩增出与预期相符的伤寒沙门氏菌阳性增幅曲线,检测结果的Ct值见表4。同时,按照GB4789.4-2010 检测模拟污染样品,均分离鉴定出伤寒沙门氏菌,检测结果与实时荧光PCR结果相同。

表4 模拟污染伤寒沙门氏菌样品的实时荧光PCR检测结果
从表4不同添加菌液浓度的灵敏度试验结果可见,伤寒沙门氏菌模拟污染样品的实时PCR检测灵敏度可以达到4cfu/mL的添加浓度。
4 讨论
沙门氏菌的传统方法鉴定需要经过病原的初步分离、生化鉴定并结合血清学分型,因此存在一定比例的假阳性等问题[6-8]。随着分子生物学技术的发展,已有针对invA、16s rRNA、SpvC、invB、fimA、agfA、SEFl4、sefA、sdf、ssaQ、fimY[9-18]等为目标基因,用普通PCR或实时荧光PCR检测沙门氏菌的报道,但以上述方法只能检测沙门氏菌的毒力基因,不能确定血清型。杜邦公司的Bax系统利用荧光PCR技术从种的水平上检测沙门氏菌,具有较高的特异性,但同样不能确定血清型。Camila等[19]针对ompC、SdfI、ViaB、Spy为目的基因设计引物,建立了多重PCR检测沙门氏菌及其主要血清型(肠炎沙门氏菌、伤寒沙门氏菌、鼠伤寒沙门氏菌)的方法,应用于鸡肉中的沙门氏菌检测;KIM[20]等也根据鼠伤寒沙门氏菌和丙型副伤寒沙门氏菌的特异序列设计多对引物,建立了多重PCR检测方法,均得到较好的效果。但上述方法需通过凝胶电泳判定结果,操作较为繁琐。Edel等[21]用flic、sefA、sdf、acek基因设计引物探针,用多重荧光PCR方法检测肠炎沙门氏菌、鸡伤寒沙门氏菌、鼠伤寒沙门氏菌等;David[22]等用普通PCR和荧光PCR检测猪霍乱沙门氏菌和丙型副伤寒沙门氏菌。从上述可见,有关开展分子生物学快速检测伤寒沙门氏菌的报道很少。
5 结论
本研究建立的TaqMan探针实时PCR检测食品中伤寒沙门氏菌的方法具有很好的特异性、快捷性,模板浓度与Ct值有良好的线性关系,荧光PCR扩增效率高,线性系数(R2)为0.994,检测灵敏度均可达到4cfu/mL的添加浓度;经模拟样品验证,所建立的实时PCR方法与传统方法的检测结果相一致。本方法具有检测周期短,操作简便的优势,可以快速鉴定伤寒沙门氏菌,在快速诊断病原、控制病情等方面具有很好的应用前景。
[1]曹冬梅,徐杨,袁慕云,等.焦磷酸测序检测食品中鼠伤寒沙门氏菌[J].微生物学杂志,2013,33(6):101-105.
[2]荣策,赵彤彤,刘宇,等.实时荧光PCR检测鼠伤寒沙门氏菌[J].食品安全质量检测学报,2012,3(8):300-305.
[3]荣策,孙铭英,那晗,等.建立Taqman探针实时荧光PCR检测食品中肠炎沙门氏菌的方法[J].中国卫生产业,2012,9:7-11.
[4]郑秋月,赵彤彤,袁慕云,等.实时荧光PCR检测食品中丙型副伤寒沙门氏菌和猪霍乱沙门氏菌[J].食品科技,2014,39(2):297-301.
[5]刘冉,赵玉琢,孙铭英,等.建立实时荧光PCR快速鉴定鸡制品中鸡伤寒沙门氏菌的方法[J].辽宁师范大学学报,2014,37(2):252-257.
[6]ZAMORA B M,HARTUNG M,HILDEBRANDT G,et a1.Detection of antibodies to S.enteritidis in broilers by means of indirect ELISA and Chemiluminescent Immunoassay(CLlA)[J].Zentralbl Veterinarmed B,1999,46(1):9-23.
[7]HOSlE B D,GRANT D A.Salmonella enteritidis infection in pheasant chicks and poults[J].Vet Rec,1990,126(2):39-40.
[8]COOPER G L,NICHOLAS R A,BRACEWELLC D.Serological and bacteriological investigations of chickens from flocks naturally infected with SalmoneUa enteritidis[J].Vet Rec,1989,125(23):567-572.
[9][9]Rahn K,S A De Grandis,R C Clarke,et al.Amplification of an invA gene sequence of salmonella typhimurium by polymerase chain reaction as a specific method of detection of salmonella[J].Mol Cell Probes,1992,6:271-279.
[10]Kwang J,Littledike E T,Keen J E.Use of the polymerase chain reaction for Salmonella detection[J].Lett Appl Microbiol,1996,22:46-51.
[11]Chiu C H,Jonathan T.Rapid identification of Salmonella Serovars in Feces by specific detection of virulence genes,invA and spvC,by an enrichment broth culture multiplex PCR combination assay[J].Journal of Clinical Microbiology,1996,34( 10) :2619-2622.
[12]Thomson N R,Clayton D J,Windhorst D,et al.Comparative genome analysis of Salmonella Enteritidis PT4 and Salmonella Gallinarum 287/91 provides insights into evolutionary and host adaptation pathways[J].Genome Res,2008,18( 10) :1624-1637.
[13]Doran J L,Collinson S K,Burian J,et a1.DNA-based diagnostic tests for Salmonella species targeting agfA the structural gene for thin,aggregative fimbriae[J].J Clin Microbial,1993,31:2263-2273.
[14]Turcotte C,Woodward M J.Cloning,DNA nucleotide sequence and distribution of the gene encoding the SEFl4 fimbrial antigen of Salmonella enteritidis[J].J Geg Microbiol,1993,139:1477-1485.
[15]Deng S,Cheng A,Wang M.Salmonella enteritidis strain-specific PCR and rapid detection of infected ducks[J].Chin J Veter Sci,2009,29(2),153-157.
[16]Dan X,Liu B,Li X,et al.The establishment and evaluation of fluorescence quantitative PCR detection system for Salmonella with added internal standard[J].Acta Microbiol Sin,2011,51:1119-1127.
[17]Wang Z,Ji S,Yang Y,et al.The establishment of dual fluorescence quantitative PCR detection method for Salmonella and Listeria monocytogenes[J].Chin J Food Hyg,2011,23:289-292.
[18]Xuan Guo,Jinru Chen,Larry R,et al.PCR Dectection of salmonella enterica serotype Montevideo in and on Raw Tomatoes Using Primes Derived from hilA[J].Appl Environ Microbiol,2000,66(12):5248-5252.
[19]Camila Guimarães de Freitas,Ângela Patrícia Santana,Patrícia Helena Caldeira da Silva,et al.PCR multiplex for detection of Salmonella Enteritidis,Typhi and Typhimurium and occurrence in poultry meat[J].Int J Food Microbiol,2010,139:15-22.
[20]Kim S,Frye J G,Hu J,et al.Multiplex PCR-based method for identification of common clinical serotypes of Salmonella enteric subsp.enterica[J].J Clin Microbiol,2006,44(10) :3608-3615.
[21]Edel O’Regan,Evonne McCabe,Catherine Burgess,et all.Development of a real-time multiplex PCR assay for the detection of multiple Salmonella serotypes in chicken samples[J].BMC Microbiology,2008,8:1471-2108.
[22]David F Woods,F Jerry Reen,Deirdre Gilroy,et al.Rapid Multiplex PCR and Real-Time TaqMan PCR Assays for Detection of Salmonella enterica and the Highly Virulent Serovars Choleraesuis and Paratyphi C[J].Journal Of Clinical Microbiology,2008,46(12):4018-4022.

