原子力显微镜观察新布尼亚病毒HB29株结果的初步分析
张丽萍 王玉春,2 赵 勇,3 马雪征 甄 维 胡孔新
(1.中国检验检疫科学研究院 北京 100123;2.河南师范大学;3.吉林大学)
1 前言
原子力显微镜(Atomic force microscopy,AFM)是一种适合于观察非导电物质的生物力学工具,具有很高的分辨率,横向和纵向分辨率分别可达2-3nm和0.5nm。其突出特点是制样简单,不需要染色、固定以及其他复杂的制样过程,并可以在液相实现观测。因此AFM非常适合进行病毒形态结构分析,成为近年来病毒形态学研究热点之一。
新布尼亚病毒(SFTSV)属于布尼亚病毒科白蛉病毒属,是一种有包膜分阶段的负链RNA病毒。病毒基因组包括L、M、S三个片段,分别编码RNA依赖的RNA聚合酶和包膜糖蛋白G1、G2以及核蛋白。
中国疾控中心病毒病所通过大量的调查研究,明确SFTSV致病的临床表现和流行病学特征。该病主要发生在丘陵、山区,患者以成年农民为主,部分患者有被蜱叮咬史。流行期为4-10月,高峰为5-7月,这也是蜱虫活跃的时间段。同时经过实验室检测,在200多位患者的血清标本中,发现70%左右有感染史。这些患者来自湖北、河南、山东、江苏、安徽和辽宁,分布很广,这也提示SFTSV的传播范围可能广泛。
目前,SFTSV形态结构的研究主要依赖于透射电子显微镜(transmission electron microscopy,TEM),利用AFM对SFTSV形态学方面的研究尚未见文献报道。本研究采用AFM和TEM两种方法对SFTSV HB29株进行成像分析,获得TEM图像的同时获得了该病毒的原子力显微镜形貌图和三维图、相位图以及各项表征指标,以期探讨AFM在SFTSV形态结构研究中的应用。
2 材料与方法
2.1 材料
2.1.1 病毒
SFTSV HB29株为中国疾控中心病毒病预防控制所提供。
2.1.2 仪器
TECNAI12TEM:美国FEI公司;Nano2Scope (R) Ⅲa和catalystAFM:美国Buruker公司。
2.1.3 试剂
左旋多聚赖氨酸:美国sigma公司。
2.2 方法
2.2.1 TEM的制样和观测
采用负染制片技术处理病毒培养液及鼠源单抗37℃孵育30min处理的病毒培养液,用PBS缓冲液(pH7.2)适当稀释,将载有碳膜的铜网翻扣插入稀释液中,用滤纸从边缘吸去多余的液体,1%的磷钨酸(pH6.8)染色1min,空气中自然干燥后通过TEM观察拍照,加速电压为80kv。该部分工作在中国疾病预防控制中心病毒病所完成。
2.2.2 AFM样品制备
1%左旋多聚赖氨酸浸泡直径15mm的盖玻片5min后,取出置暗处晾干,取5μL病毒浓缩液,均匀涂于处理好的盖玻片限定区域,静置5min,滤纸吸去样本表面多余液体,去离子水洗涤3次,3min/次,氮气吹干,然后将盖玻片固定于铁片上进行扫描观察;5μL病毒浓缩液,均匀涂于处理好的盖玻片限定区域,静置5min,滤纸吸去样本表面多余液体,加5μL鼠源单抗均匀涂于样片限定区域,37℃湿盒孵育30min,滤纸吸去样本表面多余液体,去离子水洗涤3次,3min/次,氮气吹干,然后将盖玻片固定于铁片上进行扫描观察。
2.2.3 AFM成像
SFTSV HB29株的AFM图像通过Nano2Scope(R) Ⅲa 和catalystAFM控制器,在室温大气条件下以Tapping模式采集图像,图像采用高度、振幅与相位3种信号输出,并经Nanoscope Image Analysis分析处理软件进行病毒形貌的截面和粗糙度等参数的测量和分析。
3 结果
3.1 TEM观察结果
从图1可以看出,本次试验使用的SFTSV HB29株在电子显微镜下可以看到病毒粒子的负染形态结构:完整粒子呈球形,粒子在PTA负染液衬托下呈白色外观,颗粒周围可见包膜。鼠源单抗处理的病毒颗粒球形(图2所示),病毒颗粒周围可见负染状态下暗色的包膜,电镜状态病毒与抗体处理的病毒形貌未见明显差异。

图1 SFTSV HB29株TEM的负染状态

图2 SFTSV HB29株抗体处理后TEM的负染状态
3.2 AFM观察结果
3.2.1 AFM观察到的SFTSV形貌图
用E型扫描器,所用探针为由硅制成的RTESP探针,其微悬臂的长度为115-135μm,弹性常数K为20-80N/nm,共振频率为200-400kHz,针尖曲率半径为5-10nm,扫描速度为1Hz和2.8Hz;选取不同扫描范围的SFTSV HB29株病毒AFM图片,展示病毒形态和相关特性。在367nm×367nm和190nm×190nm范围扫描的图片中通过形貌图、振幅图和相位图(图3)可见SFTSV球形颗粒,边界清晰,形状规则,大小80-100nm。鼠源单抗处理后的SFTSV348nm×348nm和172nm×172nm扫描范围图片(图4)中可见,病毒颗粒形状不规则,未见规则球形病毒颗粒,大小100nm左右,可见边界不平滑锐利边缘。
3.2.2 AFM观察到的SFTSV的三维立体分析图
利用AFM对所获得的结果进行一系列分析,获得图中SFTSV的长度约100nm,阶高约30nm,表面平均粗糙度和表面均方粗糙度值分别约为0.420nm和0.342nm。图5为600nm×600nm AFM结果三维分析图,显示病毒的三维相貌,可见病毒球形,边界清晰,表面不平,可见起伏。截面分析图获得颗粒两端的表面距离为95.33nm,截面水平距离110.45nm,同时还获得病毒颗粒的垂直距离等相关信息。

图3 不同扫描范围下的SFTSV形貌图

图4 不同扫描范围下的抗体处理后的SFTSV形貌图
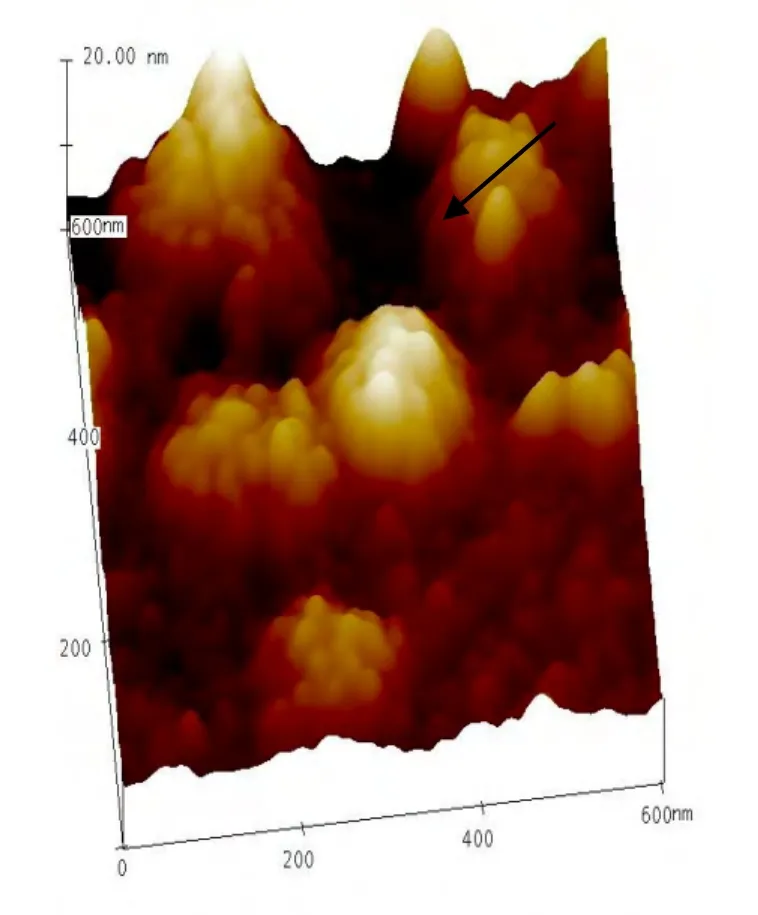
图5 600nm×600nm视野下SFTSV的三维立体分析图
4 讨论
SFTSV属于布尼亚病毒科,白蛉病毒属,病毒颗粒呈球形,直径80-100nm,外有脂质包膜,表面有棘突,其基因组为单股负链RNA,包含L、M、S3个片段[1-3]。SFTSV作为一种新发现的病毒,其宿主和传播途径尚无定论。中国CDC病毒病所李德新等曾经在蜱中检测到SFTSV核酸[1],江苏CDC鲍昌俊等在牛、羊、狗血清中检测到SFTSV抗体[4],因此SFTSV为人兽共患病。
1986年,Gbinning等在扫描隧道显微镜基础上发明了一种力学显微镜-AFM,是SPM 家族的主要成员[5]。AFM的分辨率很高,其横向分辨率为2nm-3nm,纵向分辨率为0.5nm,可直接用来观察物质的分子或原子,是人类探索微观世界的理想工具。AFM的工作原理是将探针装在弹性微悬臂的一端,另一端固定,当探针在样品表面扫描时,探针与样品表面原子间的排斥力会使得微悬臂轻微变形,这样,微悬臂的轻微变形就可以作为探针和样品间排斥力的直接量度。一束激光经微悬臂的背面反射到光电检测器,可以精确测量微悬臂的微小变形,这样就实现了通过检测样品与探针之间的原子排斥力来反映样品表面形貌和其他表面结构。
本研究对制备获得的SFTSV及经抗体处理的SFTSV首先进行TEM进行观察,获得成功后再利用AFM对SFTSV病毒进行观察,并和TEM获得的病毒形态进行比较。TEM电镜结果显示虽然本研究所用的SFTSV标本颗粒分散,但可见到完整的球形病毒粒子,且与抗体处理后的病毒颗粒相比,电镜下未见明显差异。用AFM观察SFTSV获得了比较理想的相位图,相位图比高度图更清晰的展示了病毒表面的精细结构,通过190nm×190nm视野下相位图可见球形病毒粒子,表面粗糙,但未见病毒表面的刺突结构;通过172nm×172nm视野下的相位图可见经抗体处理后的SFTSV表面不规则起伏,边界不平滑。对于AFM结果中未见病毒粒子的典型刺突,推测主要原因可能在于探针针尖有一定的宽度,无法获得小于针尖宽度的病毒表面颗粒,但是粗糙度等量化指标以及相位图展示的病毒表面结构三维图从另一个角度描述了病毒形态。
5 结论
本研究利用TEM和AFM相结合的方法首次成功展示了SFTSVHB29株的三维图并获得病毒形貌参数,为SFTSV的形态研究提供依据。作为一种新的病毒形态学研究工具,AFM在病毒研究中的应用还需要进一步完善,相信随着研究的不断深入,它将会在病毒形态学以及相关研究中发挥重要作用。
[1]Yu X J,Liang M F,Zhang S F,et al.Fever with Thrombocytopenia Associated with a Novel Bunyavirus in China[J].The new England journal of medicine,2011,364:1523-1532.
[2]李德新.发热伴血小板减少综合征布尼亚病毒概述[J].中华实验和临床病毒学杂志,2011,25(2):81-84.
[3]张永振,周敦金,熊衍文,等.中国淮阳山地区新蜱传布尼亚病毒引起的出血热[J].中华流行病学杂志,2011,32(3):209-220.
[4]Bao C J,Qi X,Wang H.A novel bunyavirus in China[J].N Engl J Med,2011,365(9):862-863.
[5]Nettikadan S R,Johnson J C,Mosher C,et al.Virus particle detection by solid phase immunocapture and atomic force microscopy[J].Biochem Biophys Res Commun,2003,311(2):540-545.

