玉米新选细胞质雄性不育系小孢子发育的细胞学观察及DNA甲基化分析
张艳花,易洪杨,房明,荣廷昭,曹墨菊
四川农业大学玉米研究所,教育部作物基因资源与遗传改良重点实验室,农业部西南玉米生物学及遗传育种重点实验室,成都 611130
玉米新选细胞质雄性不育系小孢子发育的细胞学观察及DNA甲基化分析
张艳花,易洪杨,房明,荣廷昭,曹墨菊
四川农业大学玉米研究所,教育部作物基因资源与遗传改良重点实验室,农业部西南玉米生物学及遗传育种重点实验室,成都 611130
细胞质雄性不育在高等植物中普遍存在,是杂种优势利用的重要工具,为推动植物杂种优势的利用发挥了重要作用。文章以本课题组前期新选的玉米细胞质雄性不育系A1、A2及保持系18(红)为材料,利用石蜡切片技术对不育材料小孢子发育过程进行细胞学观察,采用高效液相色谱法(HPLC)对不同发育时期的叶片及不同发育时期的雄穗DNA进行甲基化分析,从细胞学和表观遗传学角度了解不育系A1、A2的败育机制。结果表明:不育材料A1、A2小孢子发生败育的主要时期为四分体时期至单核小孢子中期。在不育系A2中还存在另一种败育方式,即在花粉母细胞时期表现出败育特征。甲基化分析结果表明,保持系18(红)的叶片DNA甲基化水平从苗期到拔节期迅速上升,而不育系A1、A2叶片DNA甲基化水平基本保持不变;保持系雄穗DNA甲基化水平表现为从花粉母细胞时期到双核期逐渐升高,而不育材料A1、A2从花粉母细胞时期到双核期的雄穗DNA甲基化水平表现为先上升后下降的趋势,达到最高峰的时期均出现在小孢子发育的四分体时期。从小孢子发育的细胞学观察结果可以发现,小孢子败育的主要时期往往具有较高的甲基化水平,推测DNA甲基化水平变化可能与不育材料A1、A2的花粉败育有关。
玉米;细胞质雄性不育;细胞学观察;DNA甲基化
DNA甲基化(DNA methylation)是表观遗传学修饰方式之一[1],是在DNA甲基化转移酶的作用下将S-腺苷甲硫氨酸的甲基添加到 DNA分子中特定的碱基上的过程[2]。大量研究表明,DNA甲基化在调控基因的时空表达和维持基因组的相对稳定方面发挥重要的作用[3,4]。
植物细胞质雄性不育(Cytoplasmic male sterility, CMS)在高等植物中普遍存在,是植物杂种优势利用的主要工具。李娜等[2]研究结果表明,DNA 甲基化表达模式的改变可能会影响植物的育性;卢艳丽等[5]对玉米 CMS-C的研究也表明,CMS可能与雄穗DNA甲基化水平的变化有关。在植物调控基因表达的过程中,DNA甲基化水平的变化对其生长发育有着至关重要的作用。目前常用的 DNA 甲基化检测方法有:高效液相色谱法(High performance liquid chromatography, HPLC)、甲基化敏感扩增多态性法(Methylation sensitive amplification polymorphism, MSAP)、SssI甲基转移酶法、免疫共沉淀测序技术(Methylated DNA immunoprecipitation sequencing, Me-DIP-seq)、结合重亚硫酸盐的限制性内切酶法(Combined bisulfite restriction analysis, COBRA)、测序法等[6~9]。其中 MSAP法已被广泛应用于玉米(Zea mays)[10]、水稻(Oryza sativa)[11]、棉花(Gossypium spp)[12]和拟南芥(Arabidopsis thaliana)[13]等植物基因组的胞嘧啶甲基化分析。但是,MSAP技术是利用同裂酶在全基因组范围内检测CCGG位点胞嘧啶甲基化水平,不能检测非CCGG位点的甲基化,在一定程度上低估了基因组胞嘧啶甲基化水平,具有一定的局限性。相比而言,HPLC法能在宏观上对全基因组的甲基化水平进行大规模的分析测定,由Kuo等[14]首次报道,被誉为基因组 DNA甲基化检测中较为标准的方法[15~18]。目前,HPLC法已广泛应用于动物和微生物DNA甲基化的研究,但在植物中的应用研究相对较少[19,20],而在玉米上利用HPLC技术检测DNA甲基化水平的相关研究未见报道。
四川农业大学玉米研究所在玉米转基因后代中,发现了两个雄性不育株。经初步观察发现,其败育彻底,且不育性表现稳定,命名为A1、A2。徐小逊等[21]、荣凤军等[22]通过育性恢复专效性分类方法并结合特异性引物检测分析,初步将不育材料A1、A2划分为玉米细胞质雄性不育的C组群。本文将对不育系 A1、A2及保持系 18(红)的小孢子发育过程进行细胞学观察,并利用高效液相色谱法对供试材料的DNA甲基化进行检测,旨在了解不育材料A1、A2的败育过程,探讨DNA甲基化水平的变化与育性表现的关系。
1 材料和方法
1.1 材料
将不育系A1、A2以及相应的保持系18(红)播种于四川农业大学温江试验基地,常规田间管理。
1.2 方法
1.2.1 石蜡切片的制备
选取A1、A2、18(红) 3个材料的花粉母细胞时期、二分体时期、四分体时期、单核期、双核期的花药,用卡诺氏液固定,苏木精染色,酒精脱水,二甲苯透明,石蜡包埋切片,树胶封片,脱蜡,显微镜观察并照相。
1.2.2 玉米基因组DNA的提取
用CTAB法提取A1、A2、18(红)的苗期和拔节期叶片基因组DNA以及花粉母细胞时期、四分体时期、单核期、双核期的雄穗基因组DNA。
1.2.3 HPLC法检测DNA甲基化
首先将DNA样品水解成碱基,水解体系为:1 μg DNA 加入50 μL水解混合液(250 UBenzonase、300 mU 磷酸二酯酶 I、200 U 碱性磷酸酶、5 mL pH为7.9的Tris-HCl buffer、100 mmol NaCl、20 mmol MgCl2)。然后以标准品为对照,当水解产物经色谱柱时用紫外光测定其吸收峰值,并利用公式:DNA总甲基化水平=5-mC /(C+5-mC)×100%,从而计算出基因组甲基化的整体水平。本实验所用色谱仪为岛津 20A 型高效液相色谱仪;对照胞嘧啶(C)和 5-甲基胞嘧啶(5-mC)标准品,均购自Sigma公司。
2 结果与分析
2.1 细胞学观察
2.1.1 保持系18(红)
通过石蜡切片观察,保持系 18(红)小孢子发育过程如图 1所示,在花粉母细胞进入第一次减数分裂前期 I时,花粉母细胞正常分裂,体积较大且细胞质较浓。药壁组织完全分化为绒毡层、中层、药壁内层以及表皮层,其中最内侧的绒毡层发育正常,细胞体积大且排列紧密;之后花粉母细胞分裂形成2个子细胞,进入二分体时期。在二分体时期药囊体积逐渐扩大,绒毡层细胞厚度明显增加且排列整齐;经第二次减数分裂形成四分体,其外周为胼胝质,绒毡层细胞一直处于浓缩状态且染色较深;从四分体中游离出来的小孢子通过两次有丝分裂形成1个营养细胞和 2个生殖细胞,同时内含物逐渐积累,最终形成花粉粒;减数分裂完成后绒毡层开始逐步解体,为花粉形成和发育提供营养。
2.1.2 不育材料A1
通过观察不育材料A1小孢子发育过程发现,从小孢子母细胞时期至二分体时期不育材料 A1与保持系 18(红)的细胞学特征没有明显的差别,即花粉母细胞体积较大且细胞质较浓,绒毡层细胞排列整齐。但二分体形成以后花药小孢子囊开始出现异常,此时绒毡层细胞出现明显的液泡化,细胞体积变大并轻微的径向膨胀,同时绒毡层细胞开始脱离花药壁向内萎缩,而此时小孢子细胞在药囊中央相互粘连成环状,并被向内萎缩逐渐膨大的绒毡层细胞挤压崩溃。药囊中小孢子细胞和绒毡层细胞全部解体,表现为无花粉粒的败育类型(图2)。
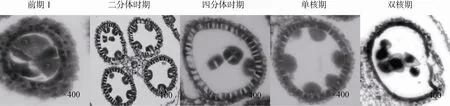
图1 保持系18(红)小孢子发育的细胞学观察
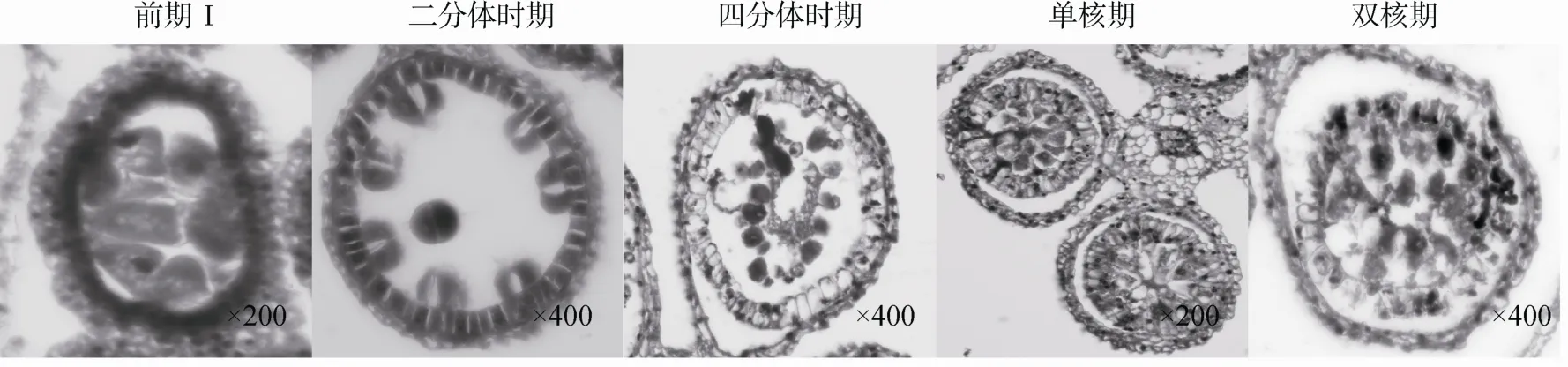
图2 不育材料A1小孢子发育的细胞学观察
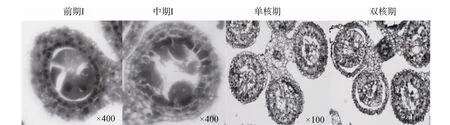
图3 不育材料A2小孢子发育的细胞学观察
2.1.3 不育材料A2
在不育材料 A2中观察到两种不同的败育类型(图3)。第一种与不育材料A1败育类型相似,即在四分体时期绒毡层细胞体积变大,出现了明显的液泡化,并逐渐脱离药壁向内萎缩挤压药囊中的小孢子细胞,最终导致小孢子细胞和绒毡层细胞全部解体,表现为无花粉粒的败育类型,是主要的败育方式。第二种类型小孢子败育发生较早,在减数分裂前小孢子母细胞即出现浓缩解体迹象,而绒毡层细胞发育基本正常。但随后绒毡层细胞出现明显的液泡化,径向厚度也明显增加,药室几乎全部被增大的绒毡层细胞占据,表现为无花粉粒的败育类型。
2.2 DNA甲基化水平检测
2.2.1 DNA甲基化的检测及分析
利用 HLPC法对不育材料 A1、A2及保持系18(红)的苗期和拔节期叶片基因组DNA以及花粉母细胞时期、四分体时期、单核期和双核期的雄穗基因组DNA进行甲基化分析。HLPC分析采用的是本实验优化的色谱条件:C18填料色谱柱(5 μm,250 mm× 4.6 mm);柱温箱温度:35℃,洗脱液:10%甲醇、5 mmol/L的戊烷磺酸钠、0.2%的三乙胺混合液(pH调至3.5),流速:0.8 mL/min,检测波长:273 nm,进样量:20 μL。根据甲基化水平的计算公式得出供试材料的DNA甲基化水平,结果见表1。
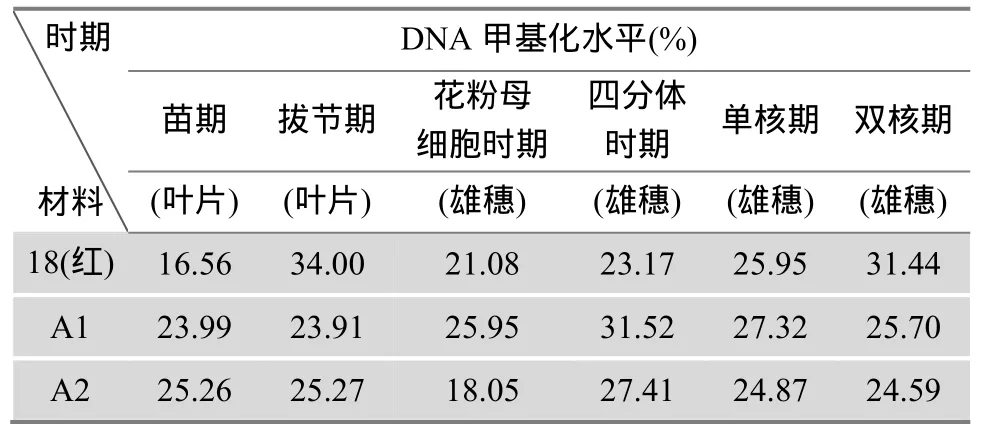
表1 不同时期玉米基因组DNA甲基化水平
从表1中可以看出,玉米基因组中DNA甲基化水平是一个动态变化的过程,即在不同组织以及相同组织的不同发育时期,甲基化水平是不同的。
对不同发育时期叶片 DNA甲基化水平分析结果如图4。保持系18(红)苗期叶片的DNA甲基化水平明显低于不育系A1、A2;而保持系拔节期叶片的DNA甲基化水平迅速升高,明显高于不育材料,但不育系 A1、A2的甲基化水平从苗期到拔节期却没有发生明显的变化。
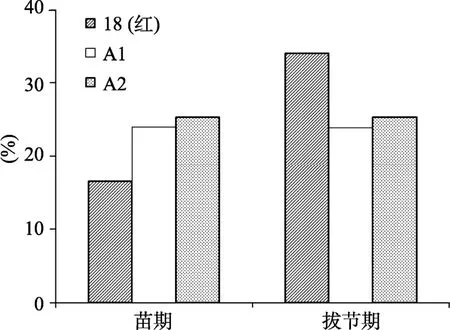
图4 不同发育时期叶片DNA甲基化分析
对供试材料不同发育时期雄穗 DNA进行甲基化分析,结果见图5。不育材料A1、A2雄穗DNA甲基化水平呈现出相似的变化趋势,即由花粉母细胞时期到双核期 DNA甲基化水平表现为先上升后下降,其最高峰时期为四分体时期。而保持系18(红)雄穗 DNA甲基化水平表现为从花粉母细胞时期到双核期逐渐升高;花粉母细胞时期是DNA复制、蛋白质合成以及能量代谢的重要时期,很多基因处于活化状态,因此甲基化水平总体较低;随着小孢子的发育,很多基因由活化状态逐渐转变为沉默。故甲基化总体水平升高,这与小孢子发育规律相吻合。不育材料A1、A2,其四分体时期雄穗DNA甲基化水平明显高于18(红),且四分体时期是其雄穗DNA甲基化水平达到最高峰的时期,这可能是由于某些小孢子正常发育所需的基因被抑制表达,致使不育材料在四分体时期甲基化水平较高。
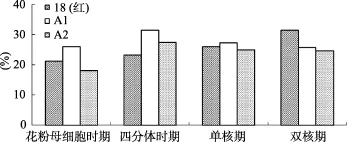
图5 不同发育时期雄穗DNA甲基化分析
结合细胞学观察结果,可以发现不育材料发生败育的主要时期即四分体时期,其甲基化水平相对较高,推测可能与一些小孢子正常发育所需的基因被抑制表达有关,某些关键基因的沉默导致代谢紊乱,致使花粉发育异常。从图5中也可以看出,不同材料(A1、A2)的花药,在相同发育时期其 DNA甲基化水平存在一定差异,这与细胞学观察结果相吻合,即A1、A2的败育方式存在差别。
3 讨 论
本文通过对小孢子发育的细胞学观察,发现A1、A2的败育时期主要发生在四分体至单核小孢子中期。这与陈伟程等[23]报道过的C型细胞质雄性不育系的败育特征基本一致;也与徐小逊[21]、荣凤军[22]等把A1、A2划分为C型细胞质雄性不育的研究结果相印证,但在不育材料A2中还观察到另外一种败育方式,即在花粉母细胞时期表现出败育现象。罗红兵等[24]在 GDS型细胞质雄性不育材料中也报道过类似的败育过程,说明A1、A2之间存在一定差异。
本研究观察到不育材料绒毡层发育异常,在四分体时期绒毡层细胞出现明显的液泡化,径向厚度增加,并脱离药壁向内萎缩,挤压破坏小孢子细胞,最终导致花粉败育。由此可见,不育材料 A1、A2花药的败育与绒毡层的发育异常有关,这与前人的研究结果类似[25,26]。绒毡层位于花药壁最内侧,其主要功能是为小孢子的形成和发育提供营养物质,对花粉的形成至关重要。绒毡层细胞正常与否将会直接影响花粉的发育。
对不同时期的叶片DNA甲基化分析表明,从苗期到拔节期,保持系叶片DNA甲基化水平迅速上升,表现出成倍的增长,而不育系叶片DNA甲基化水平则保持基本不变。这一差异暗示着不育系和保持系从营养生长向生殖生长转变过程中基因表达模式可能存在不同。DNA甲基化调节植物基因的表达,为了维持植物正常的生长发育,一些基因持续表达并处于活化状态,其DNA甲基化水平较低;而另外一些基因表达受到抑制,则其甲基化水平较高。因此植物基因组 DNA甲基化水平的改变一定程度上反映出基因时空表达模式的变化。
本研究发现A1、A2的雄穗DNA甲基化水平均在小孢子发育的四分体时期达到最高峰,结合前文对小孢子发育过程的细胞学观察结果以及前人报道的C型细胞质雄性不育发生败育的时期,可以发现小孢子败育的主要时期往往具有较高的 DNA甲基化水平。这可能是与不育系在花粉形成过程中的某些关键酶或基因的异常表达有关。由此推测,DNA甲基化水平的变化与雄花败育可能具有某种内在联系。本研究为从表观遗传学角度探索玉米细胞质雄性不育的发生机理提供了重要线索。
[1] 夏晗, 刘美芹, 尹伟伦, 卢存福, 夏新莉. 植物 DNA甲基化调控因子研究进展. 遗传, 2008, 30(4): 426-432.
[2] 谭建新, 孙玉洁. 表观基因组学研究方法进展与评价.遗传, 2009, 31(1): 3-12.
[3] 李娜, 张旸, 解莉楠, 李玉花. 植物DNA甲基化研究进展. 植物生理学报, 2012, 48(11): 1027-1036.
[4] Bird A. DNA methylation patterns and epigenetic memory. Genes Dev, 2002, 16(1): 6-21.
[5] Lu YL, Liu YX, Wang J, Cao MJ, Rong TZ. Variation and patterns of DNA methylation in maize C-type CMS lines and their maintainers. J Plant Biochem Biot, 2010, 19(1): 43-50.
[6] Xiong ZG, Laird PW. COBRA: a sensitive and quantitative DNA methylation assay. Nucleic Acids Res, 1997, 25(12): 2532-2534.
[7] Portis E, Acquadro A, ComiIlo C, Lanteri S. Analysis of DNA methylation during germination of pepper (Capsicum annuum L.) seeds using methylation-sensitive amplification polymorphism (MSAP). Plant Science, 2004, 166(1): 169-178.
[8] Taiwo O, Wilson GA, Morris T, Seisenberger S, Reik W,Pearce D, Beck S, Butcher LM. Methylome analysis using MeDIP-seq with low DNA concentrations. Nat Protoc, 2012, 7(4): 617-636.
[9] Beck S, Rakyan VK. The methylome: approaches for global DNA methylation profiling. Trends Genet, 2008, 24(5): 231-237.
[10] Lu YL, Rong TZ, Cao MJ. Analysis of DNA methylation in different maize tissues. J Genet Genomics, 2008, 35(1): 41-48.
[11] Ashikawa I. Surveying CpG methylation at 5’-CCGG in the genomes of rice cultivars. Plant Mol Biol, 2001,45(1): 31-39.
[12] Liu B, Brubaker CL, Mergeai G, Cronn RC, Wendel JF. Polyploid formation in cotton is not accompanied by rapid genomic changes. Genome, 2001, 44(3): 321-330.
[13] Cervera MT, Ruiz-García L, Martínez-Zapater J. Analysis of DNA methylation in Arabidopsis thaliana based on methylation- sensitive AFLP markers. Mol Genet Geno mics, 2002, 268(4): 543-552.
[14] Kuo KC, McCune RA, Gehrke CW, Midgett R, Ehrlich M. Quantitative reversed-phase high performance liquid chromatographic determination of major and modified deoxyribonucleosides in DNA. Nucleic Acids Res, 1980, 8(20): 4763- 4776.
[15] Wagner I, Capesius I. Determination of 5-methylcytosine from plant DNA by high-performance liquid chromatography. Biochim Biophys Acta, 1981, 654(1): 52-56.
[16] 南楠, 曾凡锁, 詹亚光. 植物DNA甲基化及其研究策略.植物学通报, 2008, 25(1): 102-111.
[17] Fraga MF, Esteller M. DNA methylation: a profile of methods and applications. Biotechniques, 2002, 33(3): 632-649.
[18] Johnston JW, Harding K, Bremner DH, Souch G, Green J, Lynch PT, Grout B, Benson EE. HPLC analysis of plant DNA methylation: a study of critical methodological factors. Plant Physiol Biochem, 2005, 43(9): 844-853.
[19] Ramsahoye BH. Measurement of genome wide DNA methylation by reversed-phase high-performance liquid chromatography. Methods, 2002, 27(2): 156-161.
[20] Chen Q, Tao S, Bi X, Xu X, Wang L, Li X. Research of total levels on DNA methylation in plant based on HPLC analysis. J Mol Biol, 2013, 3(2): 98-101.
[21] 徐小逊, 荣廷昭, 曹墨菊. 一个新的玉米雄性不育材料的发现及其初步遗传分析. 玉米科学, 2006, 14(1): 55-58.
[22] 荣凤军, 曹墨菊, 唐祈林, 潘光堂, 荣廷昭. 转 Bt基因后代玉米新不育胞质A的遗传分析. 四川农业大学学报, 2007, 25(1): 29-33.
[23] 陈伟程, 段韶芬. 玉米 C 型胞质雄性不育系花药发育的细胞学观察. 作物学报, 1988, 14(3): 177-181.
[24] 罗红兵. 玉米(Zea mays L.)GDS细胞质雄性不育系生物学研究[学位论文]. 长沙: 湖南农业大学, 2002.
[25] Balk J, Leaver CJ. The PET1-CMS mitochondrial mutation in sunflower is associated with premature programmed cell death and cytochrome c release. Plant Cell, 2001, 13(8): 1803-1818.
[26] Luo D, Xu H, Liu Z, Guo J, Li H, Chen L, Fang C, Zhang Q, Bai M, Yao N, Wu H, Wu H, Ji C, Zheng H, Chen Y, Ye S, Li X, Zhao X, Li R, Liu YG. A detrimental mitochondrial-nuclear interaction causes cytoplasmic male sterility in rice. Nat Genet, 2013, 45(5): 573-577.
(责任编委: 赖锦盛)
Cytological observation and DNA methylation analysis of two new cytoplasmic male sterile lines of maize during microsporogenesis
Yanhua Zhang, Hongyang Yi, Ming Fang, Tingzhao Rong, Moju Cao
Key Laboratory of Crop Genetic Resource and Improvement of Ministry of Education, Key Laboratory of Biology and Genetic Improvement of Maize in Southwest Region of Ministry of Agriculture, Maize Research Institute, Sichuan Agricultural University, Chengdu 611130, China
Cytoplasmic male sterility (CMS) is a widespread phenomenon in higher plants and has been applied in the commercial production of hybrid seeds. Two CMS lines A1 and A2 of maize were obtained previously by a transgenic experiment. In this study, we conducted cytological observation of developmental microspores with CMS lineA1, A2 and their maintainer line (18 red) using paraffin section technology. We also analyzed DNA methylation levels at different developmental stages using high performance liquid chromatography (HPLC). Our results showed that the pollen abortion of A1 and A2 mainly happened from the tetrad stage to the middle of mononuclear stage. Another abortive phenomenon found in CMS line A2 occurred at the pollen mother cell stage. The DNA methylation level of leaf increased rapidly from the seedling stage to the shooting stage in 18 red, while it remained constant in A1 and A2. For the tassel, the DNA methylation levels in 18 red increased gradually during the anther development, while a peak of DNA methylation level occurred in A1 and A2 at the tetrad stage, corresponding to the abortion period of microspore. This result suggested that the level of DNA methylation in the tassels is associated with the pollen abortion characteristics in CMS lines. In summary, our results implied a connection between pollen abortion and epigenetic regulation in maize CMS.
maize; cytoplasmic male sterility; cytological observation; DNA methylation
2014-01-17;
2014-05-28
国家自然科学基金项目(编号:30971794)资助
张艳花,硕士研究生,专业方向:玉米细胞质雄性不育。E-mail: 1020452562@qq.com
易洪杨,硕士研究生,专业方向:玉米生物技术育种,E-mail: 1182550843@qq.com
张艳花和易洪杨同为第一作者。
曹墨菊,教授,研究方向:玉米雄性不育。E-mail: caomj@sicau.edu.cn
10.3724/SP.J.1005.2014.1021
时间: 2014-9-24 10:36:30
URL: http://www.cnki.net/kcms/detail/11.1913.R.20140924.1036.004.html