新疆裂腹鱼类的系统发生关系及物种分化时间
海萨·艾也力汗,郭焱,孟玮,杨天燕,马燕武
新疆水产科学研究所,乌鲁木齐 830000
新疆裂腹鱼类的系统发生关系及物种分化时间
海萨·艾也力汗,郭焱,孟玮,杨天燕,马燕武
新疆水产科学研究所,乌鲁木齐 830000
文章采用线粒体COI、ND4、16S rRNA基因联合数据分析了新疆分布的裂腹鱼类4属10个种或亚种的分子系统发育,并通过鲤亚科的分化时间、黄河上游和青海湖隔离的地质时间来校正分子钟,进而探讨了裂腹鱼类分化时间与塔里木盆地周边地区主要地质事件和气候变化的关系。结果发现,扁吻鱼属未能形成独立的分支,与塔里木裂腹鱼、厚唇裂腹鱼聚在一起。进一步基于COI基因序列,利用Kimura双参数模型计算遗传距离,发现扁吻鱼属和裂腹鱼属间的遗传距离未达到属间区别,扁吻鱼可能是裂腹鱼属内特化的物种;聚类分析结果不同于裂腹鱼属的形态学分类方法,不支持裂腹鱼属鱼类的亚属划分;原始等级裂腹鱼类(包括裂腹鱼属和扁吻鱼属)两个族群的分化时间(8.18 Ma)与新疆裸重唇鱼和斑重唇鱼的分化时间(7.67 Ma)均发生于晚中新世,这可能与 8Ma左右青藏高原北缘和北天山抬升、塔里木盆地气候干旱化等重大地质事件和气候转型导致青藏高原北缘(昆仑山)和北天山水系间出现分离相关。而塔里木盆地裂腹鱼属鱼类现今的分布格局可能与第四纪喜马拉雅运动使盆地形成西高东低的地势、罗布泊成为塔里木盆地周边高山发源河流的汇水中心相关。
裂腹鱼亚科;系统发育;分化时间;线粒体DNA
裂腹鱼亚科(Schizothoracinae)隶属鲤科(Cyprinidae),包括12属90种(亚种)[1,2]。根据触须数目、下咽齿行数及体鳞把裂腹鱼亚科鱼类分为原始等级、特化等级及高度特化等级 3个类群。新疆有原始等级和特化等级两个类群。其中,特化等级的裸重唇鱼属(Gymnodiptychus)和重唇鱼属(Diptychus)均为一属一种,分别是新疆裸重唇鱼(G. dybowskii)、斑重唇鱼(D. maculatus)。原始等级包括裂腹鱼属(Schizothorax)和扁吻鱼属(Aspiorhynchus)。裂腹鱼属种类较多,包括塔里木裂腹鱼(S. (Racoma) biddulphi)、重唇裂腹鱼(S. (Racoma) barbatus)、宽口裂腹鱼(S. (Schizothorax) eurystomus)、扁嘴裂腹鱼(S. (Racoma) esocinus)、厚唇裂腹鱼(S. (Racoma) irregularis),银色裂腹鱼(S. (Racoma) argentatus)、伊犁裂腹鱼(S. (Racoma) pseudaksaiensis)。扁吻鱼属仅为扁吻鱼(A. laticeps)一种。因特殊的生态环境和长期的地理隔离使新疆的裂腹鱼种类与我国其他地区的种类有所不同,部分种类在世界范围内仅分布于新疆。例如国家一级保护动物扁吻鱼、自治区二级保护动物塔里木裂腹鱼均为新疆特有物种。
裂腹鱼类呈现以青藏高原为中心、辐射周边高原地区的分布格局,其中原始等级裂腹鱼类的分布广泛,几乎遍布于整个亚科分布的水系中。新疆的裂腹鱼属鱼类在伊犁河谷-巴尔喀什盆地、塔里木盆地及帕米尔-南天山发源的境外河流均有分布。但不同水系中分布的种类有所不同。银色裂腹鱼分布于伊犁河-巴尔喀什湖水系、额敏河-阿拉湖水系[3]。伊犁裂腹鱼在伊犁河-巴尔喀什湖水系、楚河、伊赛克湖均有分布[3,4]。其余5个种在塔里木盆地诸多河流中均有分布,包括阿克苏河、喀什噶尔河、叶尔羌河、和田河、塔里木河干流及开都河等河流[5]。同时,扁嘴裂腹鱼在赫尔曼德河及喀布尔河[6],厚唇裂腹鱼在锡尔河、赫尔曼德河及阿姆河[6],宽口裂腹鱼在伊犁河流域[7]、阿姆河和锡尔河[8]也有分布。特化等级的斑重唇鱼分布于昆仑山和南天山发源的诸多河流上有直流、伊赛克湖及伊犁河雅马渡以上的主要直流[3~5]。新疆裸重唇鱼在北天山北麓诸多河流、额敏河、开都河及伊犁河均有分布[4~6]。而扁吻鱼的分布仅限于塔里木盆地诸多河流[5]。
根据陈毅峰等[1]分类方法,裂腹鱼属包括裂腹鱼亚属(Schizothorax)和裂尻鱼亚属(Racoma)。但He等[9]不支持裂腹鱼属的亚属划分,认为裂腹鱼属物种间的系统发育关系同其水系分布密切相关,来自同一个水系的物种往往属于同一个进化谱系,并把新疆分布的裂腹鱼属鱼类分为2个谱系,即中亚区域和伊犁河流域。但该研究中仅包含新疆裂腹属的4个种。从形态特征来看,同域分布的新疆裂腹鱼属鱼类种间形态特征相似,特别是在低年龄阶段这种现象更为显著。例如,由于形态特征的相似性,Баимбетов等[7]及Митрофанов等[3]认为伊犁裂腹鱼和银色裂腹鱼是同一物种的两个亚种,而我国鱼类分类学家则认为伊犁裂腹鱼和银色裂腹鱼是独立的物种[1,5]。从分布格局来看,伊犁河谷-巴尔喀什盆地分布的裂腹鱼属物种与帕米尔-南天山境外河流分布的物种不同,但塔里木盆地分布的部分裂腹鱼属物种在帕米尔-南天山境外河流中有分布。
不计外来鱼类,塔里木河水系仅存裂腹鱼亚科和鳅科鱼类,伊犁河水系这两个类群占鱼类总种数的 83%。裂腹鱼类作为塔里木盆地及周边山区最为重要的类群之一,其起源演化与昆仑山、南天山及北天山隆起和塔里木盆地地质和气候变化事件具有密切的关系。因此,通过裂腹鱼类的系统发育和生物地理学研究探讨塔里木盆地和周边高山的地质变迁和水系演化事件具有重要意义。
本研究收集新疆分布的裂腹鱼亚科鱼类,基于线粒体DNA 3个基因联合数据,采用贝叶斯(Bayes information criterion, BIC)和最大似然法(Maximum likelihood, ML)重建新疆裂腹鱼亚科鱼类的系统发育,并利用 Multidivtime估计分化时间。分析原始等级裂腹鱼类属间的亲缘关系,结合塔里木盆地及周边地区的主要地质事件和气候变化研究结果,探讨裂腹鱼属鱼类系统发育及其分布格局。
1 材料和方法
1.1 材料
本研究样品包括裂腹鱼属的6个种,扁吻鱼属1个种,裸重唇鱼属1个种,重唇鱼属1个种,分别采自塔里木河流域和伊犁河流域。齐口裂腹鱼(S.(Schizothorax) prenanti)样本采自拜城县鱼市,为人工养殖个体。未能采集到重唇裂腹鱼和扁嘴裂腹鱼样本。活体样品剪取尾鳍末端浸泡于 95%乙醇,保存于-20℃。(表1)。
1.2 方法
1.2.1 DNA提取、PCR扩增及测序
标准酚-氯仿法提取 DNA,本研究相关引物分别来自Miya 等、Palumbi及 Ward等的文献[11~13]。PCR扩增体系为50 μL,包括10×Buffer 5 μL, dNTP (2.25 mmol/L) 4 μL,上下引物个(10 mmol/L) 1 μL,基因组DNA(20 ng/μL) 1 μL,Taq DNA聚合酶(2.5 U/μL) 0.5 μL,灭菌ddH2O补齐。PCR扩增程序:94℃预变性3 min;94℃变性40 s,复性40 s,72℃延伸45 s,35个循环;最后再72℃延伸8 min,4℃保温。扩增反应在MastercyclerRgradient 梯度 PCR仪上完成。PCR产物取5 μL经琼脂糖凝胶电泳检测后送公司进行测序。相关引物序列及复性温度见表 2。本研究中3个线粒体DNA基因序列均属于每个物种同一个体。扁嘴裂腹鱼、澜沧裂腹鱼(S. (Schizothorax) lantsangensis)及青藏高原分布的 5个裂腹鱼亚科鱼类以及外类群鲃亚科3个种和鳅科的1个种作为外类群基因序列均来自GenBank(表1)。
1.2.2 数据分析
采用Clustal X软件对序列进行排序并辅以手工校正,利用DnaSP4.10软件分析序列的变异位点和简约性信息位点。Mega3.0软件Kimuar双参数模型计算基于 COI基因序列的遗传距离。McGuire[14],王绪祯等[15]的研究结果显示,分区策略与拓扑结构和枝长估算关系不大,所有数据联合是贝叶斯分析中的最佳策略。因此,本研究采用所有数据联合策略进行了贝叶斯和ML分析。构建系统发育树之前,用jModelTest2.1.3对联合数据进行模型筛选。
用 PAUP*4.0b10软件构建 ML树时,根据由jModelTest估算结果,模型选择为GTR+G,并设置相关参数,树二等分再连接(Tree-bisection reconnection, TBR)进行构树,并采用100次重复自展重抽样分析(Bootstraps analysis)检验分枝的置信度。
MrBayes v3.1.1软件采用贝叶斯法构建贝叶斯树时,根据jModeltest软件分析结果以GTR+I+G为最优模型,设置代替模型为6(nst=6)、位点间变异模型为invgamma(rates=invgamma),进行1 000 000代蒙特卡罗模拟(Markov chain Monte Crlo; MCMC)、4条链同时运行3条热链1条冷链(ngen=4),节点的可信性以后验概率(Posterior probability,PP)来表示。
分子钟估计时,以贝叶斯树作为进行分子钟标准树,首先采用PAML v3.14软件包中的Baceml程序估算F84进化代替模型中的相关参数。第二步用Multidivtime软件包中的 Estbranches程序估算系统树的支长及支长的方差-协方差矩阵。第三步排除外类群,对根节年龄、根节速率以及分支自主相关速率的平均值及标准误差等参数进行预设:根据已发现的化石推测,亚洲和欧洲鲤科鱼类起源于早始新世的50Ma(Million anniversary,Ma)[16],因此50Ma (SD=5.0)作为根节到顶端分化时间的期望值;硬骨鱼类mtDNA编码蛋白基因,通过化石或其他可靠的校正,序列进化速率一般被认为是在0.5%~1.3%/Ma之间[17],裂腹鱼类起源时间交完,Cyt b基因序列分子进化速率为 0.91%[18],因此我们把每位点每百万年0.0091的替换速率(SD=0.0091)作为tree rood节点的进化速率。此外,本研究采用两个校正点:(1) 现有化石资料表明,中新世鲤亚科、鲴亚科和雅罗鱼
亚科鱼类已出现[19,20,21]。王绪祯等[16]认为,鲤亚科的分化时间为 18.46±1.04。结合化石的地质年代和系统发育估算的分歧时间,我们把节点C1的分歧时间设置为18.0~19.0Ma,作为上限;(2) 黄河上游和青海湖隔离的地质时间0.15Ma[22],作为下限C2。Multidivtime程序估算分化事件的时间及标准误差(Standard deviations, SD),并通过马尔科夫链的蒙特卡罗方法(Markov chain Monte Carlo, MCMC)来计算95%置信区间。

表1 本研究中21个样本的核苷酸序列来源

表2 PCR及测序相关引物序列
2 结果与分析
2.1 序列分析及最适代替模型估计
COI基因序列为602 bp,变异位点200个,简约性信息位点155个;ND4基因序列为1604 bp,变异位点494个,简约性信息位点326个;16S rRNA基因序列为601 bp,变异位点98个,简约性信息位点56个。jModelTest 2.1.3分析结果显示,BIC为标准选择的最适模型为 TrN+I+G,似然值(-lnL)为12319.4597,BIC值为 24948.5188,由于 MrBayes中没有TrN+I+G模型,因此本文用GTR+I+G模型代替。AIC为标准选择的最适模型为GTR+G,估计参数为base=(0.3181 0.2796 0.1392 )、nst=6、rmat= (1.5599 35.5446 1.7718 1.1451 16.9301)、rates=gamma、 shape=0.1560、ncat=4、pinvar=0。
2.2 系统发育分析
ML及贝叶斯树中,内群15个节点大部获得了高的支持率。贝叶斯树中 12个节点 PP≥0.9,ML树中10个节点支持率≥87%。新疆裸重唇鱼和斑重唇鱼的节点在ML树中支持率82%,但在贝叶斯树中PP=0.95。贝叶斯树中齐口裂腹鱼和(扁吻鱼、(厚唇裂腹鱼+塔里木裂腹鱼)的节点支持率只有 0.62,但在ML树中为82%。
两种系统发育分析得到的系统发育树的拓扑结构基本一致,原始等级裂腹鱼类处于系统发育树基部,其次为特化等级裂腹鱼类,高度特化等级裂腹鱼类置于系统发育树顶部,与赵新全等[23]的研究结果一致。原始等级裂腹鱼类分两个族群,族群Ⅰ包括塔里木裂腹鱼,厚唇裂腹鱼、扁吻鱼、齐口裂腹鱼、澜沧裂腹鱼、扁嘴裂腹鱼,其中扁嘴裂腹鱼裂腹鱼处于该族群的基部。族群Ⅱ包括宽口裂腹鱼、伊犁裂腹鱼及银色裂腹鱼,其银色裂腹鱼处于该族群的基部。扁吻鱼属未能形成独立的分支,与裂腹鱼属鱼类聚在一起,并塔里木裂腹鱼和厚唇裂腹鱼的亲缘关系较近(图1)。
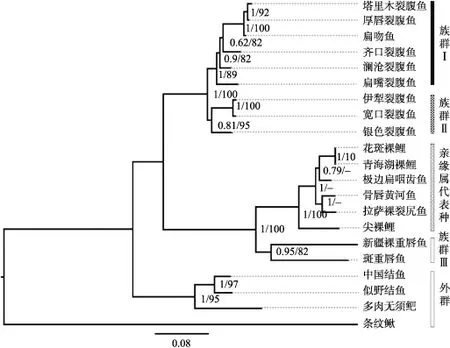
图1 基于不分区贝叶斯分析得到的裂腹鱼类50%多数一致树节点处斜杠左侧的数据为贝叶斯分析的后验概率,斜杠右侧数据为最大似然法分析100次重复的支持率。

图2 利用Multidivtime得到的时序图枝长表示时间,C1、C2为标定点。节点处数据为分化时间,括号内为95%置信区间。
2.3 分化时间分析
原始等级裂腹鱼类与特化等级裂腹鱼间的分化时间约16.93Ma前,特化等级裂腹鱼类裂腹鱼类的分化发生在8.67Ma,原始等级裂腹鱼类(包括裂腹鱼属和扁吻鱼属)分化发生在8.18Ma前,而新疆裸重唇鱼和斑重唇鱼的分化时间大约7.67Ma前。新疆分布的裂腹鱼属鱼类的种化主要发生在1Ma后(图2)。
3 讨 论
根据形态学,扁吻鱼具有须一对,口亚上位,副蝶骨弯曲向下等征状,成为自在离征而成为裂尻鱼属和裂腹鱼属的姐妹群[8,23]。但本研究中扁吻鱼属未能形成独立的分支,与裂腹鱼属族群Ⅰ聚在了一起。从COI基因序列的遗传距离来看,裂腹鱼属和扁吻鱼的Kimuar双参数模型计算的遗传距离在0.06-0.03范围内。Kartavtsev等[24,25]认为同属不同种间 COI基因遗传距离应在0.0894~0.1032之间。据此,扁吻鱼属和裂腹鱼属间的遗传距离未达到属间区别。扁吻鱼与澜沧裂腹鱼、厚唇裂腹鱼、扁嘴裂腹鱼及银色裂腹鱼的遗传距离在0.03~0.04间,小于澜沧裂腹鱼和塔里木裂腹鱼、扁嘴裂腹鱼和伊犁裂腹鱼、齐口裂腹鱼和伊犁裂腹鱼、宽口裂腹鱼和扁嘴裂腹鱼的遗传距离(0.05~0.06)。从形态分类角度来看,目前裂腹鱼属鱼类的分类普遍采用陈毅峰等的方法[1],把裂腹鱼亚科中具2对须、下咽齿3行或4行、体被细鳞等形状组合的种类全部归入裂腹鱼属。扁吻鱼咽齿为3行、体被细鳞,主要差别在于裂腹鱼属具须2对,而扁吻鱼为1对。因此,我们初步认为扁吻鱼属与裂腹鱼属有很近的亲缘关系,扁吻鱼可能是裂腹鱼属内特化的物种,扁吻鱼的分类地位待进一步的研究。
裂腹鱼类是晚第三纪分布于青藏地区的原始鲃亚科鱼类,随着高原的逐步隆起和气候变化,通过进化而产生的一个极适应于高原特殊环境的自然类群[11]。本研究结果显示,裂腹鱼属两个族群的分化时间(8.18Ma)与裸重唇鱼和斑重唇鱼间的分化时间(7.67Ma)均发生在晚中新世,很有可能与塔里木盆地和周边地区发生的地质事件或气候变化所导致的地理隔离相关。对此我们有以下可能的解释:12Ma后外特提斯海萎缩,塔里木盆地结束了海洋环境[26]。8Ma已隆升到一定高度的青藏高原北缘阻挡了来自印度洋夏季风的北上,加之西伯利亚冬季风的加强作用,加快了盆地气候的干旱化[27,28]。干旱的气候环境导致塔里木盆底的海迹湖盐度升高,塔里木盆地及周边地区分布的裂腹鱼类开始适应随西昆仑山(10~8Ma)[29]和北天山(10Ma)[30]抬升而发育的河流、湖泊。7Ma塔克拉玛干沙漠腹地出现风沙环境[27,28],盆地内的海迹湖已盐化或干枯,北天山和西昆仑山分布的裂腹鱼类间产生了隔离区。西昆仑山可能是族群Ⅰ和斑重唇鱼的起源中心,北天山则可能是族群Ⅱ和新疆裸重唇鱼的起源中心。而塔里木盆地裂腹鱼属鱼类现今的分布与第四纪裂腹鱼属鱼类在塔里木盆地的扩散事件相关。进入第四纪,由于喜玛拉雅运动的影响,塔里木盆地西部抬升,而东部相对沉降,形成西高东低的地势[31],盆地最低处的罗布泊就成了塔里木盆地的汇水中心。北天山南麓(开都河)、昆仑山(车尔臣河、和田河、叶尔羌河、喀什噶尔河等)及南天山(阿克苏河等)发源的诸多河流在罗布泊交汇。北天山南麓东段和西昆仑间的地质隔离消除,裂腹鱼属鱼类相互扩散,导致族群Ⅰ和族群Ⅱ的部分物种交叉分布。而8~6Ma开始隆起的南天山[32]阻挡了伊犁河谷分布的裂腹属鱼类向塔里木盆地扩散的途径。从裂腹鱼属和扁吻鱼属的海拔分布特征来看,裂腹鱼属和扁吻鱼属在海拔500~1000 m处有分布[5],塔里木盆地最低出的罗布泊海拔为768 m,罗布泊及塔里木河干流的海拔适合裂腹鱼属和扁吻鱼属的栖息。而斑重唇鱼和新疆裸重唇鱼的分布海拔区域在1000~1500 m以上,塔里木河干流沙漠区段海拔为 800~900 m,可能特化等级的裂腹鱼类在第四纪前适应了较高的海拔,昆仑山和北天山南麓东段各大河流的交汇未能消除斑重唇鱼和新疆裸重唇鱼间的地理隔离。因此,开都河水系没有斑重唇鱼的分布,反之昆仑山发源的河流中没有新疆裸重唇鱼的分布。而现今在伊犁河雅马渡上游支流、南天山发源的楚河及锡尔河上游支流出现这两种特化等级裂腹鱼类的分布重叠水域。这可能是8~6Ma开始隆起的南天山[32]几乎连接了北天山和西昆仑山,适应于高海拔环境的斑重唇鱼和新疆裸重唇鱼沿着南天山发源的高山河流、湖泊扩散的结果。
陈毅峰等[1]将裂腹鱼属中下颌具锐利角质前缘、以着生藻类为主食的种类划分为裂腹鱼亚属,没有锐利角质前缘、以水生无脊椎动物为食的种类划分为裂尻鱼亚属。赵新全等[22]则认为,下颌具有锐利角质前缘这一性状在裂腹鱼亚科鱼类中是多次发生的,多数下颌具有锐利角质前缘的物种之间并不存在系统发育上的联系,而且有些种在下颌有无角质前缘性状上存在间性-下颌内附角质膜,说明这种性状是为适应高原特殊生态环境趋同进化而产生的。本研究中,裂腹鱼属鱼类构成两个族群,虽然族群Ⅱ为裂尻鱼亚属3个种,但族群Ⅰ包括裂腹鱼亚属(齐口裂腹鱼)、扁吻鱼属和裂尻鱼亚属(塔里木裂腹鱼、厚唇裂腹鱼、扁嘴裂腹鱼、澜沧裂腹鱼),并不完全支持裂腹鱼属鱼类的亚属划分。
[1] 陈毅峰, 曹文宣. 裂腹鱼亚科. //乐佩琦. 中国动物志: 硬骨鱼纲鲤形目(下卷). 北京: 科学出版社, 2000: 273-390.
[2] 代应贵, 肖海. 裂腹鱼类种质多样性研究综述. 中国农学通报, 2011, 27(32): 38-46.
[3] Митрофанов ВП. Рыбый Казакстана. Алма-Ата: Издательсства o.《Наука》 Казахской CCCR, 1988, Том3: 50-105.
[4] Alpiev M, Sarieva M, Siriwardena SN, Valbo-Jørgensen J, Woynárovich A . Fish species introductions in the Kyrgyz Republic. FAO Fisheries and Aquaculture Technical Paper No. 584, Rome, 2013: 88-96.
[5] 郭焱, 张人铭, 蔡林钢. 新疆鱼类志. 乌鲁木齐: 新疆科学技术出版社, 2012: 106-130.
[6] Froese R, Pauly D. FishBase. 2014. World Wide Web electronic publication. www.fishbase.org.
[7] Баимбетов АА. Морфолого- экологическая изменчивость маринок водоемов бассейна Балхаша. Алма-Ата: Наука, 1973: 173.
[8] 武云飞, 吴翠珍. 青藏高原鱼类. 成都: 四川科学技术出版社, 1992: 351.
[9] He DK, Chen YF. Biogeography and molecular phylogeny of the genus Schizothorax (Teleostei: Cyprinidae) in China inferred from cytochrome b sequences. J Biogeogr, 2006, 33(8): 1448-1460.
[10] 中国科学院青藏高原综合科学考察队编. 青藏高原隆起的时代、幅度和形式问题. 北京: 科学出版社, 1981: 118-130.
[11] Miya M, Saitoh K, Wood R, Nishida M, Mayden RL. New primers for amplifying and sequencing the mitochondrial ND4/ND5 gene region of the Cypriniformes (Actinopterygii: Ostariophysi). Ichthy Res, 2006, 53(1): 75-81.
[12] Hills DM, Moritz C, Mable BK. Molecular Systematics. Sunderland: Sinauer Associates, Inc., 1996: 205-247.
[13] Ward RD, Zemlak TS, Innes BH, Last PR, Hebert PD. DNA barcoding Australia’s fish species. Philos Trans R Soc Lond B Biol Sci, 2005, 360(1462): 1847-1857.
[14] McGuire JA, Witt CC, Altshuler DL, Remsen JV Jr. Phylogenetic systematics and biogeography of hummingbirds: bayesian and maximum likelihood analyses of partitioned data and selection of an appropriate partitioning strategy. Syst Biol, 2007, 56(5): 837-856.
[15] 王绪祯, 甘小妮, 李俊兵, Mayden RL, 何舜平. 基于分区贝叶斯法和最大似然法的鲤科鱼类系统发育分析及其系统学意义. 中国科学: 生命科学, 2012, 42(8): 648-661.
[16] Liu J, Chang MM. A new Eocene catostomid (Teleostei: Cypriniformes) from northeastern China and early divergence of Catostomidae. Sci China Ser D: Earth Sci, 2009, 52(2): 189-202.
[17] Perdices A, Doadrio I. The molecular systematics and biogeography of the European cobitids based on mitochondrial DNA sequences. Mol Phylogenet Evol, 2001, 19(3): 468-478.
[18] 何德奎, 陈毅峰, 陈宜瑜, 陈自明. 特化等级裂腹鱼类的分子系统发育与青藏高原隆起. 科学通报, 2003, 48(22): 2354-2362.
[19] 周伟. 鲤亚科鱼类的系统发育. 动物分类学报, 1989, 14(2): 247-256.
[20] 张弥曼, 陈宜瑜, 张江永, 陈平富. 鱼化石与沧桑巨变.中国科学院院刊, 2001, (1): 39-43.
[21] 周家健. 山东山旺中中新世鲤科化石. 古脊椎动物学报, 1990, 28(2): 95-127.
[22] 李吉均, 方小敏, 潘保田, 赵志军, 宋友桂. 新生代晚期青藏高原强烈隆起及其对周边环境的影响. 第四纪研究, 2001, 21(5): 381-391.
[23] 赵新全, 祁得林, 杨洁. 青藏高原代表性土著动物分子进化与适应研究. 北京: 科学出版社, 2008: 14-69.
[24] 董丽娜, 黄梓荣, 艾红, 卢伟华, 李希国, 李娜娜, 李夏,李永振. 北部湾3种金线鱼属鱼类COI基因序列的比较分析. 中国水产科学, 2011, 18(3): 508-514.
[25] Kartavtsev YP, Lee JS. Analysis of nucleotide diversity at the cytochrome b and cytochrome oxidase 1 genes at the population, species, and genus levels. Genetika, 2006, 42(4): 437-461.
[26] 王颖. 沙漠·古海洋-追溯塔克拉玛干沙漠砂源. 海洋地质与第四纪地质, 2011, 31(4): 11-20.
[27] 叶荷, 张克信, 陈奋宁, 陈锐明, 徐亚东, 季军良. 新疆叶城柯克亚 8~3. 85Ma 沉积地层中常量和微量元素分布对气候演化的影响. 地质科技情报, 2010, 29(4): 43-50.
[28] Sun JM, Zhang ZQ, Zhang LY. New evidence on the age of the Taklimakan Desert. Geology, 2009, 37(2): 159-162.
[29] Wang E, Wan JM, Liu JQ. Late Cenozoic geological evolution of the foreland basin bordering the west Kunlun range in Pulu Area: constraints on timing of uplift of northern margin of the Tibetan Plateau. J Geophys Res, 2003, 108(B8): 1-15.
[30] 沈传波, 梅廉夫, 张士万, 刘麟, 汤济广, 周锋, 严淑澜,骆吉春. 依连哈比尔尕山和博格达山中新生代隆升的时空分异:裂变径迹热年代学的证据. 矿物岩石, 2008, 28(2): 63-70.
[31] 罗超, 彭子成, 杨东, 刘卫国, 贺剑峰, 刘桂建. 新疆罗布泊地区的环境演化. 自然杂志, 2006, 28(1): 37-41.
[32] 王丽宁, 季建清, 孙东霞, 徐芹芹, 涂继耀, 张志诚, 韩宝福. 西南天山隆起时代的河床砂岩屑磷灰石裂变径迹证据. 地球物理学报, 2010, 53(4): 931-945.
(责任编委: 黄 原)
Phylogeny and divergence time estimation of Schizothoracinae fishes in Xinjiang
Haysa Ayelhan, Yan Guo, Wei Meng, Tianyan Yang, Yanwu Ma
Xinjiang Fisheries Research Institute, Urumqi 830000, China
Based on combined data of mitochondrial COI, ND4 and 16S RNA genes, molecular phylogeny of 4 genera, 10 species or subspecies of Schizothoracinae fishes distributed in Xinjiang were analyzed. The molecular clock was calibrated by divergence time of Cyprininae and geological segregation event between the upper Yellow River and Qinghai Lake. Divergence time of Schizothoracinae fishes was calculated, and its relationship with the major geological events and the climate changes in surrounding areas of Tarim Basin was discussed. The results showed that genus Aspiorhynchus did not form an independent clade, but clustered with Schizothorax biddulphi and S. irregularis. Kimura 2-parameter model was used to calculate the genetic distance of COI gene, the genetic dis-tance between genus Aspiorhynchus and Schizothorax did not reach genus level, and Aspiorhynchus laticeps might be a specialized species of genus Schizothorax. Cluster analysis showed a different result with morphological classification method, and it did not support the subgenus division of Schizothorax fishes. Divergence of two groups of primitive Schizothoracinae (8.18Ma) and divergence of Gymnodiptychus dybowskii and Diptychus maculates (7.67Ma) occurred in late Miocene, which might be related with the separation of Kunlun Mountain and north Tianshan Mountain River system that was caused by the uplift of Qinghai-Tibet Plateau and Tianshan Mountain, and the aridification of Tarim Basin. The terrain of Tarim Basin that was affected by Quaternary Himalayan movement was high in west but low in east, as a result, Lop Nor became the center of surrounding mountain rivers in Tarim Basin, which shaped the distribution pattern of genus Schizothorax.
Schizothoracinae; phylogeny; divergence time; mitochondrial DNA
2014-03-12;
2014-08-25
新疆少数民族科技人才特殊培养计划科研项目(编号:201323131)资助
海萨,高级工程师,研究方向:水产动物种质资源。E-mail: hbahjan@126.com
郭焱,研究员,研究方向:渔业生态。E-mail: xjfishery@163.com
致 谢: 本研究中裂腹鱼属鱼类的形态鉴别工作由新疆水产科研所高级工程师阿达克拜克.克尔江和高级工程师谢春刚完成。在此一并感谢!
10.3724/SP.J.1005.2014.1013
时间: 2014-9-10 14:56:16
URL: http://www.cnki.net/kcms/detail/11.1913.R.20140911.1041.001.html