猪场废水生产微生物絮凝剂发酵特性及动力学特征
郭俊元,信 欣,能子礼超,李剑锋 (成都信息工程学院资源环境学院,四川 成都 610225)
微生物絮凝剂,由微生物代谢活动产生的具有絮凝活性的有机物质,以其环境友好和易降解的特点,成为环境治理领域的中坚力量[1-2].将有机物和氮磷含量丰富的废水或废弃物作为原材料生产微生物絮凝剂,一方面可以降低生产成本,另一方面可以实现废水和废弃物的资源化利用.猪场粪污是我国规模化畜禽养殖业的主要污染来源,猪场废水中含有大量的有机物和氮磷,可为微生物的生长和代谢提供丰富的碳源、氮源和磷源[3-4].因此,利用猪场废水生产微生物絮凝剂能够降低生产成本,并实现资源化.邱国良等[5]通过向厌氧处理后的猪场废水附加一定量的碳源和磷酸盐生产微生物絮凝剂,考察了其絮凝性能[5].发酵动力学是研究微生物发酵过程中其生长和代谢之间相互关系的科学,目前多用经验公式描述絮凝菌生长和产絮过程,鲜有建立菌体浓度、代谢产物浓度、pH值、溶解氧等工艺参数的控制方案[6-8].
试验采用猪场废水生产微生物絮凝剂,考察絮凝菌发酵过程中菌体浓度、代谢产物浓度、基质浓度、溶解氧、氨氮、总磷及pH值的变化规律,利用 Logistic和 Luedeking-Piret模型对絮凝菌生长和代谢产物生成的动力学过程进行拟合,以期为菌株发酵过程的优化提供先决条件,为提高经济效益和实现工业化生产提供理论基础.
1 材料与方法
1.1 试验材料
1.1.1 试剂配制 CaCl2(分析纯,天津恒兴化学试剂制造公司),配制 10g/L的溶液.高岭土(分析纯,天津恒兴化学试剂制造公司),配制 4g/L的悬浊液.NaOH和HCl(分析纯,天津大茂化学试剂厂)均配制1mol/L的溶液.
1.1.2 微生物菌株和微生物絮凝剂 试验所用菌株为红平红球菌(Rhodococcus erythropolis),保藏于中国典型微生物保藏中心,保藏号为ACCC.10543.微生物絮凝剂是菌株利用猪场废水发酵制备的,猪场废水中 COD和氨氮含量分别为1350,1283mg/L,废水pH值为7.6.微生物絮凝剂的制备包括种子培养和发酵培养.种子培养基(g/L):蛋白胨 10,酵母粉 5,牛肉膏 2,NaCl 10,pH=7.0.挑取少许菌至 150mL种子培养基中,于发酵温度30℃,摇床速度120r/min下培养得种子液.将种子液以2%(V/V)的接种量接种至121℃灭菌处理 30min的猪场废水中(150mL),于发酵温度 35℃,摇床速度 150r/min下发酵得到发酵液,采用丙酮(含0.07%的β-巯基乙醇)从发酵液中提取絮凝剂.所得絮凝剂为蛋白质类物质,红外光谱图显示,絮凝剂中含有羟基,羧基以及含硫基团,其中 3430cm-1处的峰是—OH,1640cm-1处的峰为COO-的反对称伸缩振动,1544cm-1是COO-的对称伸缩振动,1620cm-1和 1082cm-1处的峰是CO[9-13].
1.2 试验方法
1.2.1 微生物菌株生长量的测定 试验采用比浊法测定菌体细胞密度,试验过程中,以未接种的发酵培养基(采用相同的手段进行灭菌和发酵培养)作为对照组,对不同发酵阶段的发酵液,使用分光光度计测定波长600nm处的OD值,可以反应本文絮凝菌的细胞数量.
1.2.2 絮凝率的测定 1.0L高岭土悬液(4g/L)中加入5mL CaCl2溶液作为助凝剂,再加入2mL离心去菌体后的发酵液,常温条件下,快速搅拌1.0min (180r/min),慢速搅拌 4.0min (80r/min),静置 10min,取上清液,使用分光光度计测定波长550nm处的OD值(OD550),同时以2mL未接种的培养基作对照.计算公式如下:

式中: FR为絮凝率;A为絮凝后高岭土悬液的OD550;B为高岭土原悬浊液的OD550.
1.2.3 发酵动力学 Logistic动力学方程能很好地反应菌株生长过程中因菌体浓度的增加对自身生长的抑制作用,因此常用来表述菌株生长的动力学过程[14-15].Logistic方程如下:
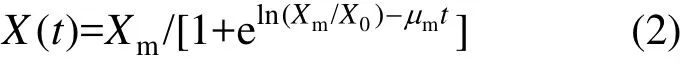
式中:X(t)为菌株浓度,g/L;X0为发酵初始菌株浓度,g/L;Xm为最大菌株浓度,g/L;t为发酵时间,h;μm为最大比生长速率,h-1.
Luedeking-Piret方程描述发酵过程中菌株生长和代谢产物生成之间的3种关系.(1)相关:代谢产物的生成伴随着菌株生长,而且在菌株生长开始就有代谢产物生成,菌株生长进入稳定期后代谢产物的活性和生成量也达到最大,如寄生曲霉菌[16];(2)部分相关:菌株生长阶段并无代谢产物生成,代谢产物是在菌株生长稳定期产生的,如地衣芽孢杆菌和假单胞菌[17];(3)不相关.如式(3)所示,当m1≠0,m2=0时,产物生成和菌株生长之间相关;当m1≠0,m2≠0时,产物生成和菌株生长之间部分相关;当m1=0,m2≠0时,表示产物生成和菌株生长之间不相关.
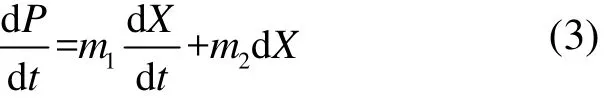
式中:P为絮凝剂产量,g/L;m1和m2分别是与菌株生长和菌株浓度相关的参数.
1.2.4 分析方法 COD浓度采用重铬酸钾法测定;氨氮采用钠氏分光光度法测定;总磷采用钼锑抗分光光度法测定;DO采用溶氧仪(HI2400)检测;pH值采用多功能pH计(DELTA320A)检测.
2 结果与讨论
2.1 生长曲线
由图1可知,菌株接种到猪场废水培养基中,基本不存在滞后期,这是由于试验中选择的菌株菌龄和接种量较合适的原因.0~60h是菌株对数生长期,能充分利用猪场废水中丰富的有机物和氮磷生长,菌体干重、细胞浓度 OD600和菌落数持续增加.12~36h,菌体干重、细胞浓度 OD600和菌落数分别由0.09g/L,0.26和1.3×107cfu迅速增加到0.76g/L,0.58和3.5×107cfu.菌株在60h进入稳定期,菌落数在66h达到最大(5×107cfu).78h菌株生长进入衰退期,菌体干重和细胞浓度 OD600依然有所增加,菌落数则逐渐减少.菌体干重的增加是由于其中不仅包含活菌株,还包含死亡的菌体;OD600的上升趋势则归因于菌死亡后引起的浊度增加;菌落数降低是由于其表述的是发酵过程中的活菌数,因此,菌落数的变化能够反应细菌在发酵过程中的真实生长趋势.
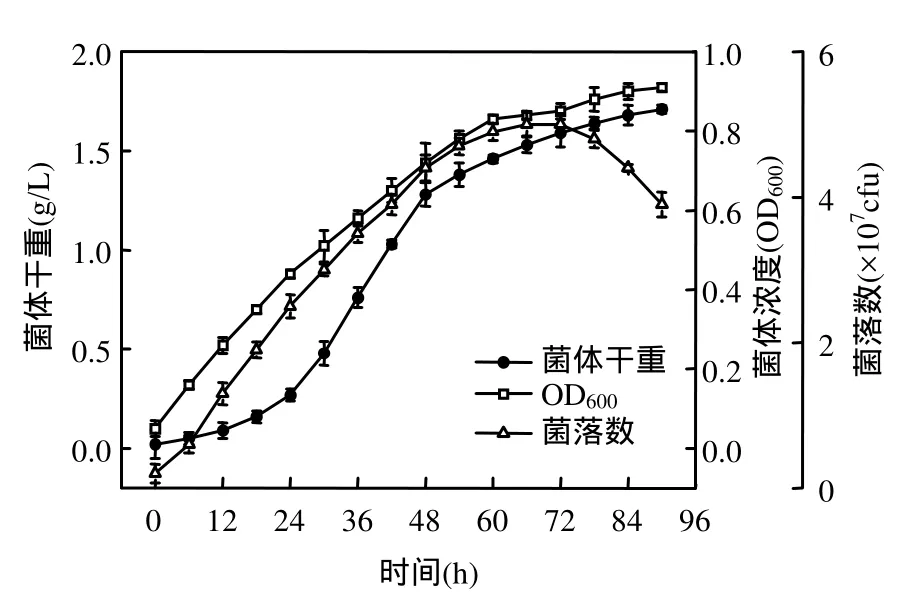
图1 菌株的生长曲线Fig.1 Growth curve of the bacteria
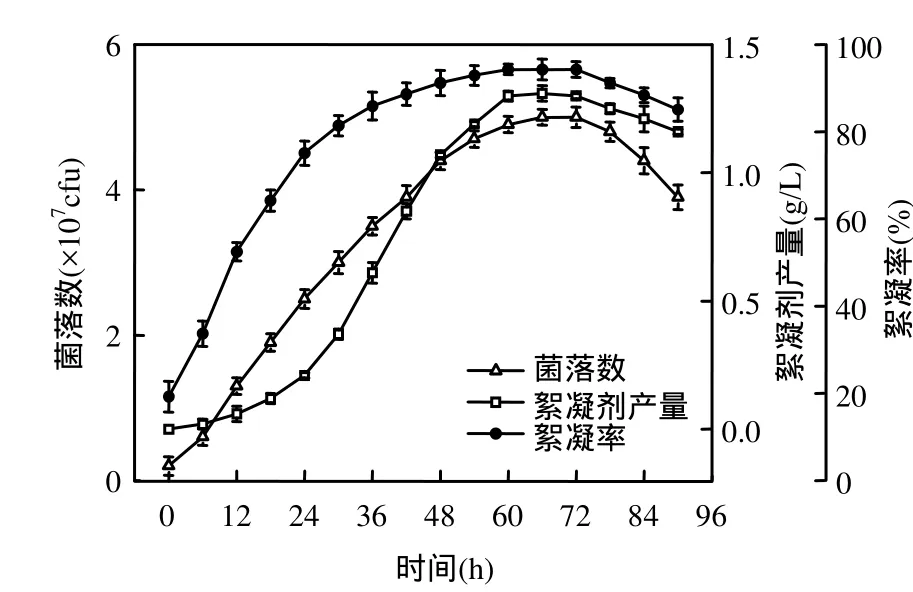
图2 菌株生长与絮凝剂生产的关系Fig.2 Relations between growth and production
依据图 1,计算菌株的繁殖代数n,生长速率常数R和世代时间G得:
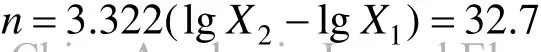

由图 2可知,代谢产物的生成和积累基本上是伴随着菌株的生长过程,当菌株进入稳定期后期时,菌落数达到最大的 5×107cfu,其代谢产物(1.31g/L)对高岭土悬液(4.0g/L)的絮凝率也达到了最大的 94.3%,说明代谢产物的生成和菌株生长之间的关系属于相关型.2.2 发酵过程参数分析
由图 3可知,溶解氧仅在发酵初期维持较高水平,随着絮凝菌的活跃生长和代谢,发酵液中的溶解氧迅速从初始状态(0h)的4.5mg/mL下降至0.38mg/mL (12h),并一直维持在较低水平(0.55~0.75mg/mL),这是由于大量繁殖的细菌消耗了培养基中绝大部分溶解氧.由此可见,在絮凝菌生长过程中,培养初期较大的通气量有利于絮凝剂的合成,同时可以避免菌体凝聚成颗粒,影响颗粒内部菌体对溶解氧的吸收和营养物质的摄入以及代谢产物向细胞外的扩散.
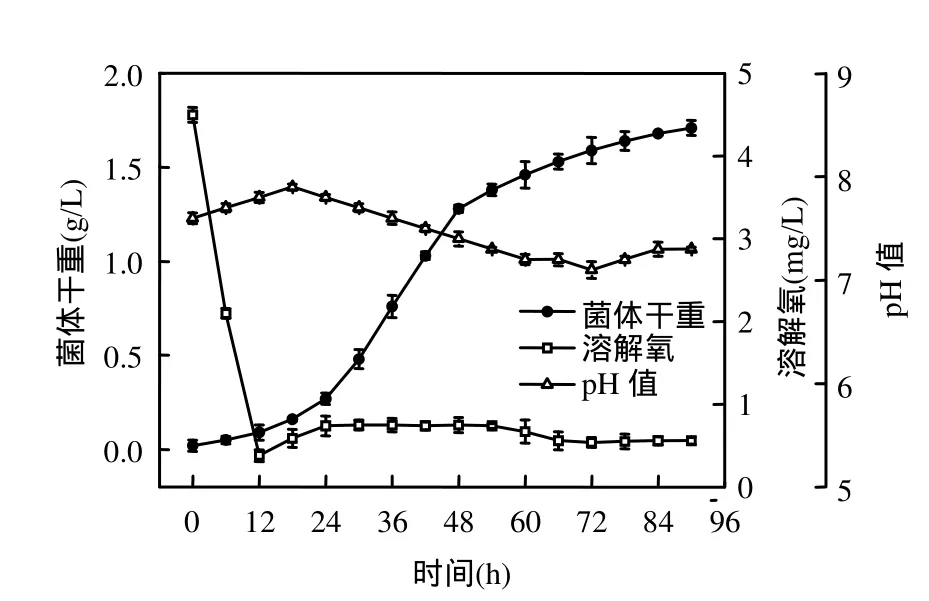
图3 溶解氧、pH值随菌株生长的变化Fig.3 Changes of DO and pH value with cell growth
发酵过程中pH值先上升再下降,pH值的上升是由于絮凝菌生长和代谢过程中消耗了培养基中的酸性多糖类物质,而代谢产物(蛋白质类絮凝剂)本身不含酸性多糖类物质.随着菌体进入稳定期,pH值略有下降,此时溶解氧含量极少,使得其作为最终电子受体的作用减弱,絮凝菌以有机物氧化分解的中间代谢产物为最终电子受体进行发酵,产生有机酸等物质,导致了 pH值的下降.
由图4可知,絮凝菌处于对数生长期时,培养基中 COD和氨氮含量分别迅速从 1350,1283mg/L降低到 273, 241mg/L.稳定期后期(66h),COD和总氮含量缓慢减少,并维持在低水平(220~251mg/L),这是由于在对数生长期,稳定期前期和中期菌体对有机物和氮源的利用速率较快.此外,衰亡期(78~90h)氨氮的含量缓慢回升,是由于菌体细胞大量死亡及菌体自溶致使胞内蛋白释放到培养基中的缘故.
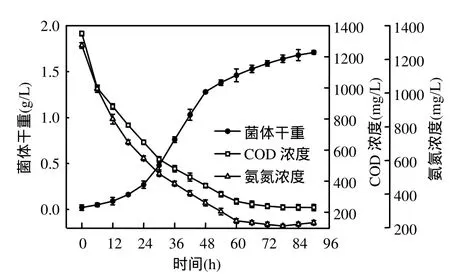
图4 COD、氨氮随菌株生长的变化Fig.4 Changes of COD and ammonium with cell growth

图5 总磷、pH值随菌株生长的变化Fig.5 Changes of TP and pH value with cell growth
由图5可知,絮凝菌处于对数生长期时,总磷的含量迅速减少到 26mg/L.稳定期后期(66h),总磷含量缓慢减少,衰亡期(78~90h)总磷含量继续下降,说明菌体在对数生长期、稳定期前期和中期对磷源的利用速率较快,磷不仅被菌株同化成为细胞组分,而且参与代谢过程中的磷酸化作用,用于贮存能量.此外,磷酸盐作为缓冲剂,调节发酵过程中pH的变化.图3和图5中pH值先上升后下降,但整体变化并不显著,这归因于磷酸盐的调节作用,当培养基中 H+浓度增加时,与弱碱性盐(K2HPO4)结合形成弱酸性化合物,培养基 pH值不会过度降低;相反,pH 值也不会过度升高.总磷含量变化曲线中发现,培养基中的磷源含量充足,在发酵后期仍有残留(11mg/L).
2.3 发酵动力学特征
发酵过程中,初始菌体干重X0=0.02g/L,最大菌体干重Xm=1.71g/L.对式(2)进行非线性拟合(图 6a),得知μm=0.11.从而得到菌株生长动力学方程:
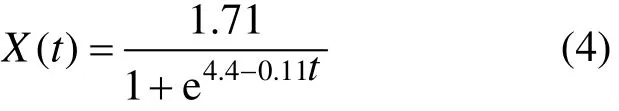
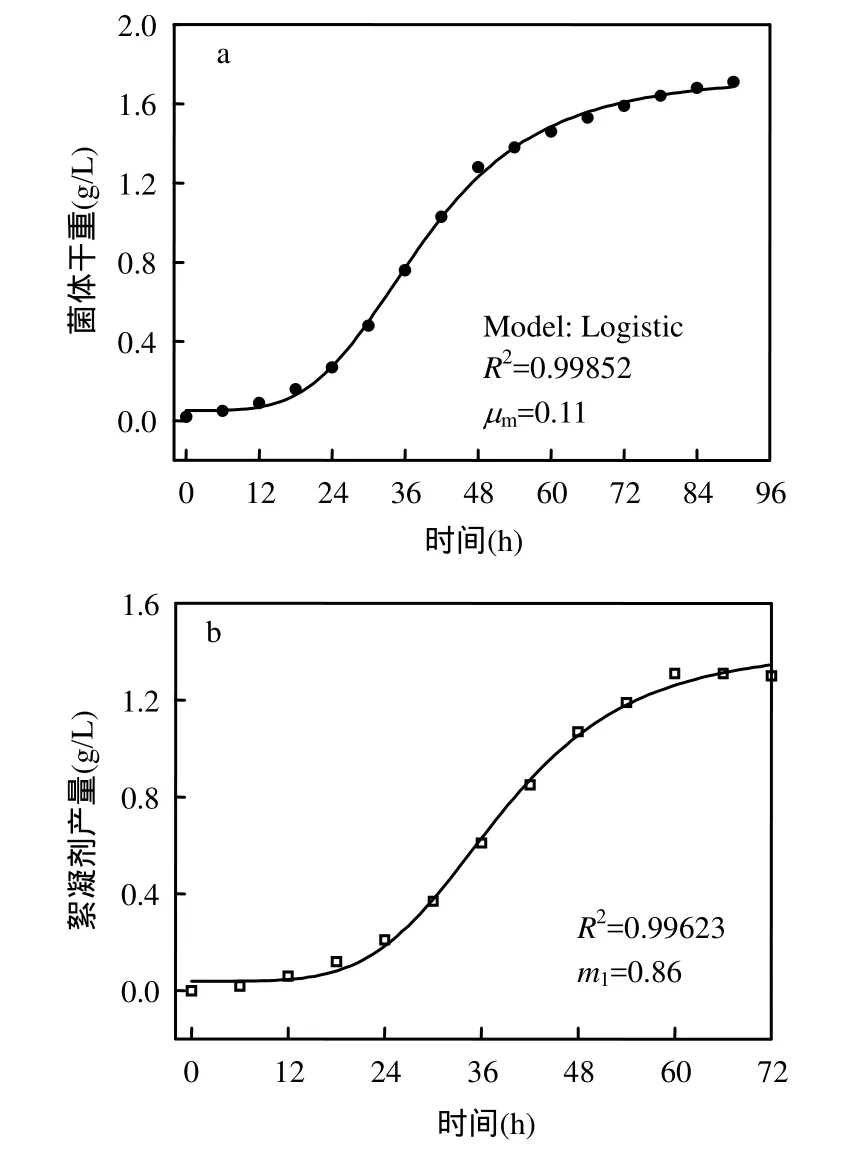
图6 菌株生长和絮凝剂生产动力学模型拟合曲线Fig.6 Fitting curves of growth (a) and producing (b)kinetics model of the bacteria
对式(4)的菌株干重计算值与试验过程中的实测值进行比较,排除发酵起始,平均相对误差为7.8%<10%,计算值和实测值之间的拟合度R2=0.99852,说明该方程能够较好地拟合试验数据,并准确地描述菌株的生长过程.
由于菌株发酵过程中代谢产物的生成和菌株生长之间相关(m2=0),因此,菌株产絮凝剂的动力学研究主要集中在生长期和稳定期.对式(3)两边求导,整理后得出:
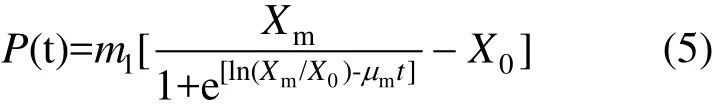
对式(5)进行非线性拟合(图 6b),得知m1=0.86.从而得到絮凝剂生产动力学方程:
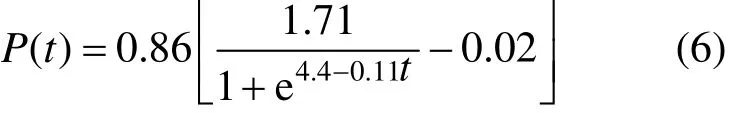
对式(6)的絮凝剂产量计算值与试验过程中的实测值进行比较,在菌株生长期和稳定期内,平均相对误差为 5.9%<10%,计算值和实测值之间的拟合度R2=0.99623,说明该方程能够较好地拟合试验数据,并准确地描述菌株产絮凝剂的动力学过程.
3 结论
3.1 由生长曲线可知,菌株在60h进入细胞增长的稳定期,菌落数达到最大的 5×107cfu,代谢产物(1.31g/L)对 4.0g/L高岭土悬液的絮凝率达到最大的94.3%.
3.2 菌株发酵过程中,COD 和氮源(氨氮)在菌株生长过程中大量消耗;蛋白质作为主要絮凝活性成分,是菌株的主要代谢产物,与菌体生长呈相关型;磷酸盐作为缓冲液,基本维持了菌株发酵过程中pH的恒定.
3.3 试验对发酵过程中菌株生长和代谢产物生成的动力学过程进行了拟合,经计算,Logistic和Luedeking-Piret模型均较准确的模拟了其过程.
[1]Gong W X, Wang S G, Sun X F, et al. Bioflocculant production by culture ofserratia ficariaand its application in wastewater treatment [J]. Bioresource Technology, 2008,99(11):4668-4674.
[2]Yi T, Lee E H, Ahn Y G. Novel biodegradation pathways of cyclohexane byRhodococcussp. EC1[J]. Journal of Hazardous Materials, 2011,191(1-3):393-396.
[3]Tian Y. Behaviour of bacterial extracellular polymeric substances from activated sludge: a review [J]. International Journal of Environmental and Pollution, 2008,32(1):78-89.
[4]Drouin M, Lai C K, Tyagi R D, et al. Bacillus licheniformis proteases as high value added products from fermentation of wastewater sludge: pre-treatment of sludge to increase the performance of the process [J]. Water Science and Technology,2008,57(3):599-605.
[5]邱国良,杨春平,郭俊元,等.厌氧后猪场废水资源化制备微生物絮凝剂 [J]. 环境工程学报, 2013,7(7):2506-2510.
[6]贺 力.假单胞菌M18G产PCA的发酵条件优化与动力学研究[D]. 上海:上海交通大学, 2008:41-56.
[7]邢 洁.絮凝菌F2产生物絮凝剂的发酵动力学及其活性成分分析 [D]. 哈尔滨:哈尔滨工业大学, 2009:44-54.
[8]刘 洁.菌株SHD-1发酵动力学及混合菌产絮凝剂的研究 [D].北京:中国石油大学, 2009:23-26.
[9]郭俊元,杨春平,曾光明,等.生物絮凝剂与改性沸石复配处理猪场废水厌氧消化液的响应面优化 [J]. 中国环境科学, 2012,32(10):1309-1313.
[10]Guo J Y, Yang C P, Zeng G M. Treatment of swine wastewater using chemically modified zeolite and bioflocculant from activated sludge [J]. Bioresource Technology, 2013,143(9):289-297.
[11]Guo J Y, Yang C P, Peng L Y. Preparation and characteristics of bacterial polymer using pre-treated sludge from swine wastewater treatment plant [J]. Bioresource Technology, 2014,152(1):490-498.
[12]Ahmad H, Rajab A, Azni I, et al. Production and characterization of a bioflocculant produced byAspergillus flavus[J]. Bioresource Technology, 2013,127(1):489-493.
[13]Lian B, Chen Y, Zhao J, et al. Microbial flocculation byBacillus mucilaginosus: Applications and mechanisms [J]. Bioresource Technology, 2008,99(11):4825-4831.
[14]周长胜.絮凝剂产生菌GA1发酵动力学及絮凝性能的研究 [D].长沙:湖南大学, 2009:25-37.
[15]Xing J, Yang J X, Ma F, et al. Study on the Optimal Fermentation Time and Kinetics of Bioflocculant Produced byBacterium F2[J].Advanced Materials Research, 2010,113(7):2379-2384.
[16]Deng S B, Yu G, Ting Y P. Production of a bioflocculant byAspergillus parasiticusand its application in dye removal [J].Colloids and Surfaces B: Biointerfaces, 2005,44(4):179-18.
[17]Hideshi S, Hideo M, Yasuhiro S. Flocculation of diatomite by a soy protein-based bioflocculant [J]. Biochemical Engineering Journal, 2010,51(2):14-18.

