紫菜藻胆蛋白的制备及其体外模拟消化研究
姚兴存, 舒留泉, 贾维宝, 刘 雪
(淮海工学院 海洋学院,江苏 连云港 222005)
藻胆蛋白是紫菜等某些藻类特有的重要捕光色蛋白,分为藻红蛋白(PE)、藻蓝蛋白(PC)、藻红蓝蛋白(PEC)和别藻蓝蛋白(APC)4大类,有的藻类中蛋白质的含量可以高达细胞干重的25%~28%[1-2]。藻胆蛋白在食品、化妆品、医药、生物工程等领域有广泛的应用与开发利用价值。
条斑紫菜是江苏沿海主要的养殖海藻,目前其主要的利用途径是制成紫菜干品供直接食用。紫菜不仅具有独特的风味和营养价值,而且在《本草纲目》中记载了其独特的药用价值,现代科学研究还表明紫菜具有降血脂、抗凝血、抗肿瘤、抗辐射等生理活性[3-5]。多年来,对紫菜蛋白质的研究主要集中在藻胆蛋白的提取、纯化与生物活性[6-7],以及蛋白质的酶解技术与酶解物的生物活性等方面[8-9],对紫菜藻胆蛋白在人体中模拟消化情况尚未见研究报道。干紫菜中含有30%~40%的蛋白质,作为食品食用时人体的消化利用情况是决定其营养价值的主要条件。目前,研究食物消化主要有体外法和体内法,体内法复杂、时间长、费用高,体外模拟消化法是根据人体胃肠消化液的主要成分与消化环境,在体外建立模拟胃肠消化体系,利用精制的消化酶在试管内进行的消化实验,可近似反映人体胃肠对食物的消化状况[10-11]。
作者首先确定紫菜中藻胆蛋白的制备方法,再采用人工胃液、人工肠液进行体外消化试验,根据游离氨基酸的生成量、消化产物的生物活性和SDS-PAGE图谱考察紫菜藻胆蛋白的消化情况,以期初步明确紫菜藻胆蛋白的模拟消化特性。
1 材料与方法
1.1 材料与试剂
条斑紫菜:购于本地紫菜加工企业,实验室中将其50℃烘干至质量恒定,高速粉碎机粉碎,100目过筛后超临界CO2流体萃取脱除脂肪,储于广口瓶中干燥保存。
胰蛋白酶(酶活 2.5×105U/g)、胃蛋白酶(酶活力 3×106U/g): 美国 BBI试剂公司产品; 蛋白Marker:TaKaRa生物工程公司产品;二苯代苦味酰基(DPPH):美国 Sigma公司产品;三氯乙酸(TCA)、邻苯二甲醛(OPA)、考马斯亮蓝、赖氨酸:均为国产分析纯。
1.2 仪器
T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司产品;Primo R多用途台式高速冷冻离心机:美国热电公司产品;全自动酶标仪:美国Bio-Tek公司产品;E200生物显微镜:日本Nikon公司产品;JSM-639OLA电子扫描显微镜:日本电子株式会社产品;DYY-241电泳仪:北京六一电泳仪厂产品;KS-300超声波细胞粉碎机:宁波科生仪器厂产品。
1.3 方法
1.3.1 紫菜藻胆蛋白制备 准确称取一定量干紫菜于烧杯中,以1 g∶50 mL的比例加入蒸馏水,充分混匀后,使用适当方法进行处理,使紫菜细胞受到一定程度的破坏,从而释放其中蛋白质。以4 000 r/min离心20 min,取上层清液,将残渣加少量水重复溶解后重复离心1次,合并上清液并定容。将紫菜藻胆蛋白溶液加入(NH3)2SO4粉末,使其饱和度达到60%,混匀后静置盐析30 min,8 000 r/min离心15 min,倾去上清液,加入适量磷酸缓冲液溶解沉淀蛋白,定容后保存于冰箱中备用。
1.3.2 紫菜藻胆蛋白提取率计算 藻胆蛋白提取率以提取液中蛋白质质量占样品原料总质量来表示,按下式计算:
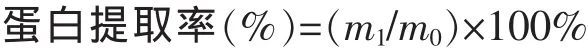
式中:m1为提取液中蛋白质质量(mg);m0为样品原料质量(mg)。
1.3.3 显微镜观察与电镜扫描 光学显微镜观察:将蛋白质提取并离心后的残渣加入20倍的蒸馏水,混匀后取少量制作成玻片,置于显微镜下观察,放大倍数为10×100,拍照。
电子扫描显微镜观察:将处理后的紫菜叶片切取约0.5 cm×0.5 cm,0.1 mol/L磷酸缓冲液清洗 3次,体积分数50%、70%、80%、90%、95%梯度丙酮各1次,各15 min,100%丙酮加无水硫酸钠2次,体积分数各 10 min,丙酮与乙酸异戊酯 2∶1、1∶1、1∶2 混合液脱水处理,各10 min,纯乙酸异戊酯一次30 min[12]。在离子溅射仪上喷金后,将样品置于扫描电镜下1000×扫描观察并拍照。
1.3.4 紫菜藻胆蛋白的体外消化过程 人工胃液配制[13]:准确称取 0.4 g NaCl,0.64 g 胃蛋白酶,吸取1.4 mL的浓盐酸,待充分溶解后定容至100 mL。人工肠液配制[13]:准确称取1.36 g的KH2PO4加入25 mL双蒸水,待充分溶解后加入19 mL 0.2 mol/L NaOH和40 mL的双蒸水,混匀后加入2 g胰蛋白酶,充分溶解后用1 mol/L的NaOH调节 pH至 7.5±0.1,最后用双蒸水定容至100 mL。
体外消化过程模拟:吸取10 mL人工胃液或人工肠液装入三角瓶中,放置37℃恒温水浴锅中预热10 min。将待消化的藻胆蛋白溶液10 mL加入锥形瓶,开始计时,按照设定的时间梯度取出一定量的消化液,立即终止反应。胃液水解反应的终止用0.168 mol/L的NaCO3调节pH至7~8,肠液水解反应的终止则在95℃下加热5 min。
1.3.5 藻胆蛋白质质量分数测定 水溶液中藻胆蛋白质质量分数测定采用Lowry法,牛血清白蛋白作标准品[14]。
1.3.6 游离氨基酸质量浓度测定 将不同的消化液加入等体积的体积分数10%TCA,4 000 r/min离心20 min,调节pH至中性,采用邻苯二甲醛法测定游离氨基酸质量浓度[15],赖氨酸作标准品,以赖氨酸质量(0~80 μg)为横坐标(x),A340nm为纵坐标(y),得到标准曲线方程程为 y=0.012 4x-0.043 5,R2=0.984 2。
1.3.7 消化产物的抗氧化作用 消化产物的抗氧化活性用消化产物对二苯代苦味酰基(DPPH)自由基清除率表示,DPPH清除率的测定采用体外试验法[16-17]。
1.3.8 消化产物SDS-PAGE分析 将10 μL紫菜藻胆蛋白消化液与10 μL样品溶解液混合后,与蛋白Marker同时置入沸水浴中加热5 min,冷却到室温,12 000 r/min离心5 min,取上清液点样。凝胶电泳采用12 g/dL的分离胶,10 g/dL的浓缩胶不连续体系。电泳时,电压恒定100 V,电泳3.5 h,考马斯亮蓝R250染色液染色3 h,脱色后扫描成像。
1.3.9 数据统计与分析 采用SPSS13.0软件对数据进行统计分析,所有数据均用平均值±标准差表示,n=3。
2 结果与分析
2.1 制备方法对藻胆蛋白提取率的影响
表1为不同提取方法的藻胆蛋白提取率。
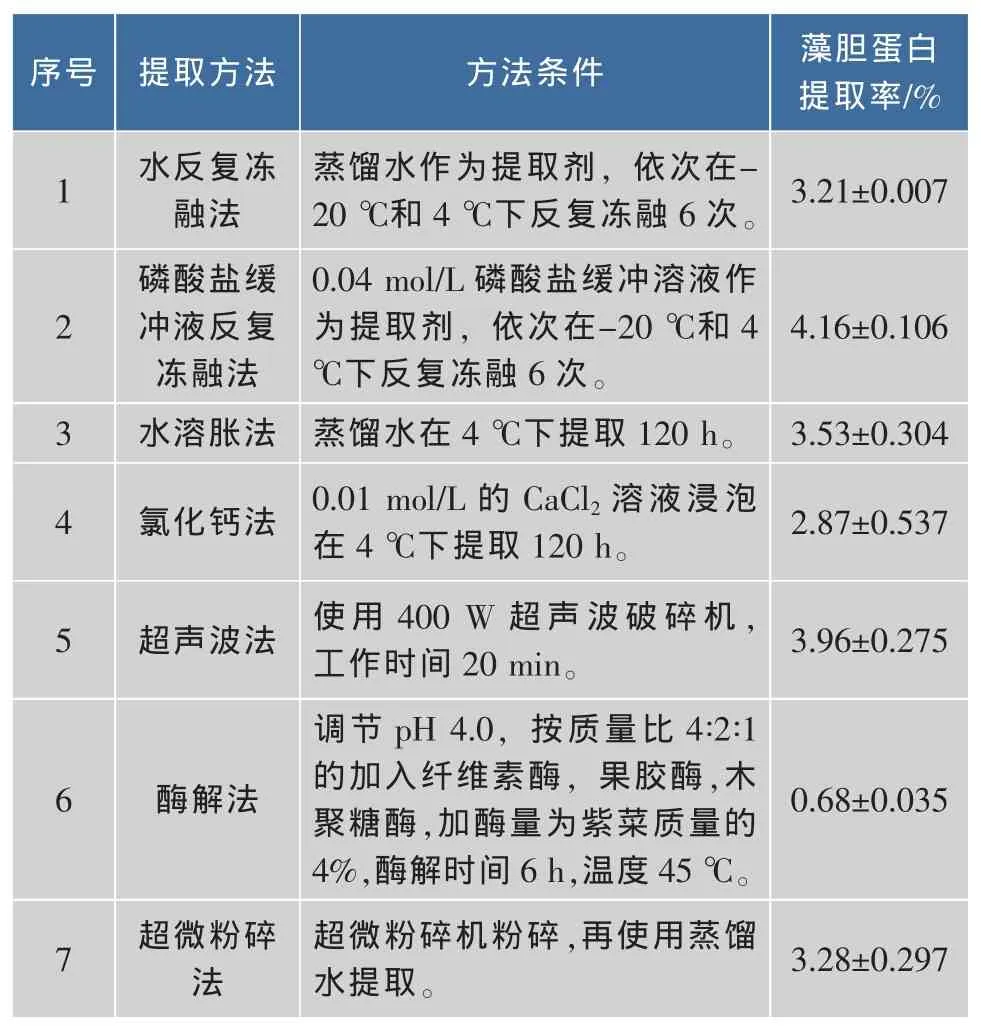
表1 不同提取方法的藻胆蛋白提取率Table 1 Extraction rate of phycobiliprotein by different methods
表1可见,磷酸盐缓冲液反复冻融法、水溶胀法和超声波法的蛋白提取率相对较高。考虑到水溶胀法需5 d,应用于实际生产则提取时间太长,所以并不是理想的提取方法。超声法法和磷酸盐缓冲液反复冻融法都有较高的提取率,且缩短了时间。综合考虑各因素,使用磷酸盐缓冲液作为提取剂结合超声波处理法应为最佳选择。验证试验结果表明,当磷酸盐缓冲液的浓度0.06 mol/L、超时功率400 W、空化比 3×10%、处理时间 20 min、溶液温度 40℃、料液比为1 g∶50 mL时,紫菜藻胆蛋白提取率为(7.05±0.671)%,显著高于任一方法单独使用的提取效果。藻胆蛋白提取方法的研究始终是多年以来的研究热点,除了上述方法之外,还有高压匀浆法、组织捣碎法、球磨机研磨法、液氮冻融法、溶菌酶等[7]被众多学者研究比较以便筛选高效合理的方法,但是不同的研究者由于研究角度的不同往往会得出不同的结论。因此,如何克服传统藻胆蛋白制备技术缺陷、减少操作步骤、缩短制备时间、提高产品提取率,并能够实现规模化工业生产,仍将是今后研究的热点与难点。
2.2 超声波处理的紫菜细胞显微特征
经过超声波处理前后的紫菜生物体细胞在10×100的光学显微镜下的显微图片见图1,1000倍电子扫描显微镜的图片见图2。

图1 超声波处理前(a)后(b)的光学显微图Fig.1 Optical micrograph before(a)and after ultrasonic treatment(b)
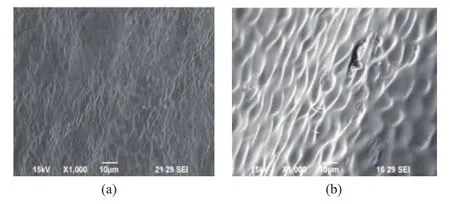
图2 超声波处理前(a)后(b)的扫描电镜图Fig.2 Micrograph before (a)and afterultrasonic treatment(b)by scanning electron microscope
由图1(a)可以看出,未经过任何处理的紫菜细胞形态完整,呈圆形或者椭圆形,且细胞排列整齐;而图1(b)用超声波处理的紫菜细胞,其破碎情况比较明显,细胞变小且形状各异,大多失去了原有的形状而带有一定的棱角;此外,细胞之间间距增大,说明有细胞液流出而占据细胞间空间,细胞结构受到了一定程度的破坏。图2(a)的扫描电镜照片可以看出,在1 000放大倍数时,未经过任何处理的紫菜叶状体,其表面纹理排列整齐且较为平整,结构致密;经过超声波处理的图2(b)图片显示,其细胞表面上有明显的裂口,可以说明是由于超声空化作用而造成了细胞结构的爆裂,从而促使胞内物质溶出提高了提取率,说明超声辅助磷酸盐缓冲液提取具有显著的提取优势。
2.3 藻胆蛋白人工胃液消化过程中游离氨基酸和生物活性变化
由图3可见,随人工胃液消化时间延长游离氨基酸含量增加,特别是在0~20 min,消化产物中氨基酸含量的增加十分明显,30 min以后则变化趋缓,这说明在模拟胃液消化中蛋白质在进入胃中即与胃液混合后随之即开始了消化,20 min之前蛋白质开始大量被消化,产生了较多的游离氨基酸,30 min后氨基酸的幅度变化不大,可以说明紫菜藻胆蛋白在动物体内的消化主要在20 min之前,紫菜蛋白质是易被人类消化的优质蛋白质。此外,消化过程中,消化产物对DPPH自由基的清除率显示了与氨基酸含量几乎一致的变化规律,由于氨基酸的抗氧化活性要强于未水解的蛋白质,由此可知,紫菜蛋白质的快速被消化对于人体及时吸收有效营养成分并改善生命体机能具有重要意义。
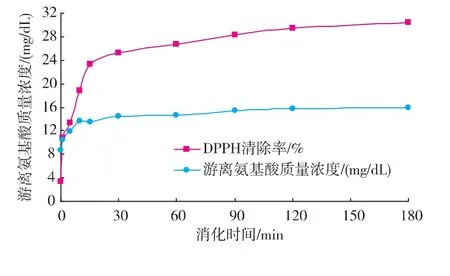
图3 人工胃液消化过程中游离氨基酸与DPPH清除率的变化Fig.3 Changes of free amino acid and DPPH removal rate by the digestion of artificial gastric juice
2.4 人工胃肠液连续消化进程分析
如图4所示,游离氨基酸在胃液和肠液2个消化阶段总体呈逐渐上升趋势,在消化的初始阶段较迅速,随着消化时间的延长,增加量逐渐放缓。胃液消化阶段,氨基酸的质量浓度从初始的8.70 mg/dL增加到30 min时的14.5 mg/dL,增加了66.7%,肠液消化阶段,氨基酸质量浓度从120 min时的15.8 mg/dL增加到300 min时的20.8 mg/dL,氨基酸质量浓度有31.6%的增加。可见,紫菜藻胆蛋白的消化主要存在于胃液消化阶段,由于在经过胃液消化后暴露了更多的胰蛋白酶作用位点,才使得蛋白质再度被肠液消化,游离的氨基酸得以更多产生,因此紫菜藻胆蛋白的肠液消化可以认为是胃液消化的补充与辅助。
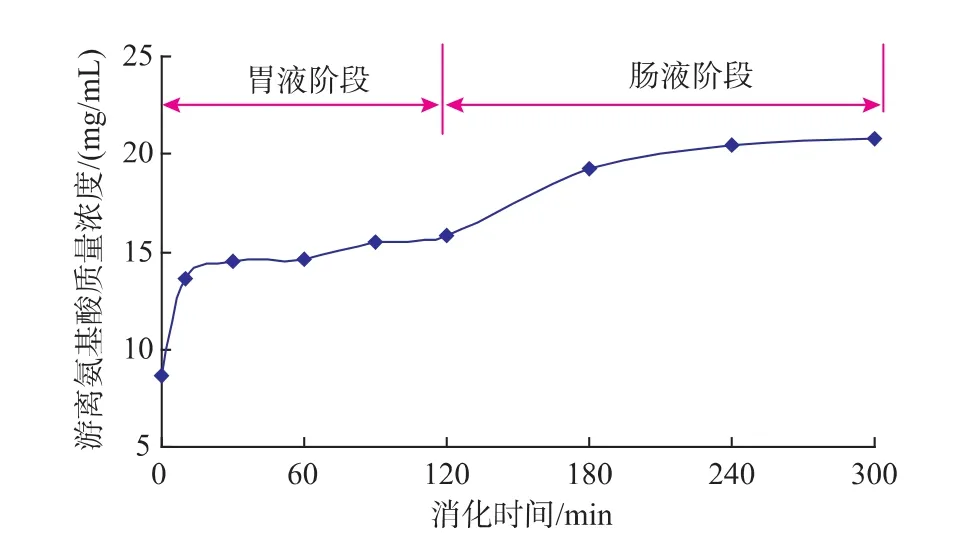
图4 紫菜藻胆蛋白胃肠液连续消化对氨基酸质量浓度的影响Fig.4 Amino acid variations of laver phycobiliprotein by the continuous digestion of gastrointestinal fluid
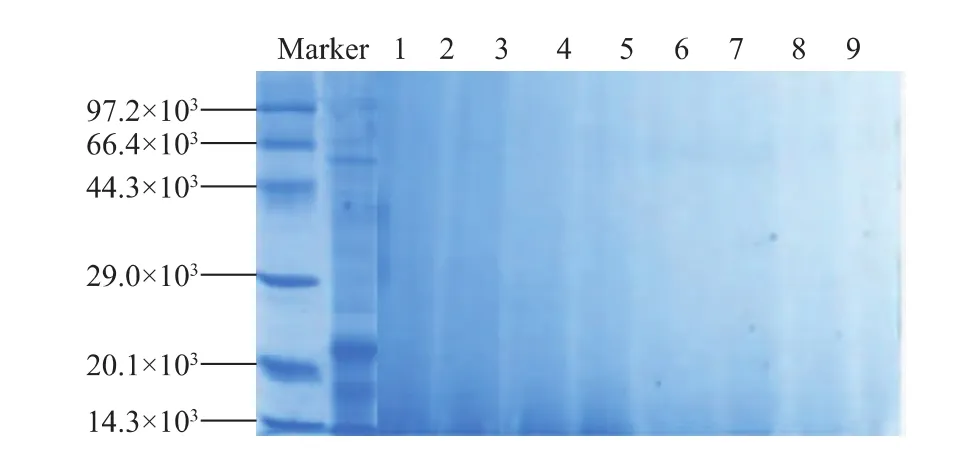
图5 紫菜藻胆蛋白胃肠消化液的SDS-PAGE图谱Fig.5 SDS-PAGE pattern of laver phycobiliprotein by the digestion of gastrointestinal fluid
由图5的消化产物电泳图可看出,紫菜藻胆蛋白在消化开始即被水解成相对分子质量低于10 000的多肽,消化产物未能在SDS-PAGE图谱上显现出清晰的电泳条带,仅在10、30、60、90 min的消化液中电泳图谱上的低相对分子质量部分 (约12 000~22 000)可见模糊的电泳影像且逐渐变淡,电泳图与游离氨基酸分析结果能够很好地相互印证。紫菜藻胆蛋白属于低相对分子质量的蛋白,相对分子质量为79 000和330 000,亚基相对分子质量为19 000、20 000[18]。胃蛋白酶是内肽酶,对芳香族氨基酸具有特异性,其酶解产物为蛋白胨及少量的多肽和氨基酸,人工胃液能够在很短时间内将绝大部分紫菜藻胆蛋白降解为多肽、氨基酸等小分子物质。
3 结语
通过研究比较几种藻胆蛋白的提取方法,将超声波破碎与磷酸盐缓冲液浸泡提取结合作为藻胆蛋白的制备最佳方法,当磷酸盐缓冲液的浓度0.06 mol/L、超时功率400 W、空化比3×10%、处理时间20 min、溶液温度40℃、料液质量体积比为1 g∶50 mL时,藻胆蛋白的提取率最大。光学显微镜和扫描电镜观察皆发现紫菜细胞结构和形态的变化,显示出细胞结构受到一定程度的破坏而使藻胆蛋白的提取率提高。
建立了紫菜藻胆蛋白模拟人体胃肠消化环境的消化模型,以游离氨基酸含量和DPPH自由基清除率作为评价指标并结合SDS-PAGA电泳技术考察藻胆蛋白的消化情况。结果表明,紫菜藻胆蛋白的消化主要在胃液开始消化的30 min和肠液消化开始阶段,在这一时间里产生了大量的氨基酸,但随后氨基酸的产生量逐渐放缓,水解产物的抗氧化活性同样呈现了与氨基酸相同的变化规律。紫菜蛋白质是较易被人体消化的优质蛋白质。
[1]曾呈奎,王素娟,刘思俭,等.藻类栽培学[M].上海:上海科技出版社,1985:135-211.
[2]Lahaye M,Jegou D.Chemical and physical-chemical characteristics of dietary fibres from Ulva lactuca,Thuret and Enteromorpha compressa[J].Journal of Applied Phycology,1993,5(2):195-200.
[3]吕钟钟,罗建光,管华诗.紫菜的生物活性研究进展[J].中国海洋大学学报,2009,39(5):47-51.LV Zhongzhong,LUO Jianguang,GUAN Huashi.Progress on chemical constituents and biological activities of porphyra[J].Periodical of Ocean University of China,2009,39(5):47-51.(in Chinese)
[4]Yoshizawa Y,Enomoto A,Todoh H,et al.Activity of marine macrophages by polysaccharides fractions from marine algae(Porphyra yezoensis)[J].Biosci,Biotech Biochem,1993,57(11):1862-1866.
[5]Yoshizawa Y,Ametani A,Tsunehiro J,et al.Macrophage stimulation activity of the polysaccharide fraction from a marine alga(Porphyra yezoensis):Structure-function relationships and improved solubility [J]. Bioscience,Biotechnology and Biochemistry,1995,59 (10):1933-1937.
[6]张唐伟,李天才.藻胆蛋白质的提取纯化与生物活性研究进展[J].生物技术通报,2010(1):9-13.ZHANG Tangwei,LI Tiancai.Review on extraction purification and biological activity of phycobiliprotein[J].Biotechnology Bulletin,2010(1):9-13.(in Chinese)
[7]王超,薛勇,刘鑫,等.天然藻胆蛋白纯化技术研究进展[J].食品工业科技,2011,32(4):445-448.WANG Chao,XUE Yong,LIU Xin,et al.Review on purification technology of natural phycobiliprotein[J].Science and Technology of Food Industry,2011,32(4):445-448.(in Chinese)
[8]姚翔,田亚平.低值紫菜蛋白酶解产物中抗氧化活性肽的纯化及分析鉴定[J].食品与生物技术学报,2012,31(6):648-653.YAO Xiang,TIAN Yaping.Purification and identification of antioxidant peptides from the product of protease hydrolysis the lowcost laver[J].Journal of Food Science and Biotechnology,2012,31(6):648-653.(in Chinese)
[9]Wenjuan Qu,Haile Ma,Zhongli Pan,et al.Preparation and antihypertensive activity of peptides from Porphyra yezoensis[J].Food Chemistry,2010,123(1):14-20.
[10]于立梅,于新,曾晓房,等.野生山毛豆蛋白制备及体外消化模拟研究[J].食品科学,2010,31(7):60-64.YU Limei,YU Xin,ZENG Xiaofang,et al.Preparation and in vitro digestibility of tephrosia candida protein[J].Food Science,2010,31(7):60-64.(in Chinese)
[11]Ragab D D M,Babiker E E,Eltinay A H,et al.Fractionation,solubility and functional properties of cowpea (Vigna unguiculata)proteins as affected by pH and/or salt concentration[J].Food Chemistry,2004,84(2):207-212.
[12]金飚,张敏,高克利.琼花叶表皮特征与叶绿体发育超微结构观察[J].电子显微学报,2012,31(6):534-538.JIN Biao,ZHANG Min,GAO Keli.Morphological characteristics of leaf epidermis and chloroplast development in Viburnum macrocephalum f.keteleeri[J].Journal of Chinese Electron Microscopy Society,2012,31(6):534-538.(in Chinese)
[13]程超,李伟,汪兴平,等.葛仙米藻胆蛋白的体外消化特性[J].食品科学,2012,33(15):6-10.CHENG Chao,LI Wei,WANG Xingping,et al.Digestion characteristics in vitro of phycobiliprotein from nostoc sphaeroides kuting[J].Food Science,2012,33(15):6-10.(in Chinese)
[14]高洪峰.不同生长期坛紫菜中藻胆蛋白的含量变化[J].海洋与湖沼,1993,24(6):645-648.GAO Hongfeng.The variation in the contents of phycobiliproteins from porphyra haitanensis collected in different growing stages[J].Oceanologia et Limnologia Sinica,1993,24(6):645-648.(in Chinese)
[15]冯岩,冯志彪,王楠.乳清蛋白水解物游离氨基浓度测定方法比较[J].中国乳品工业,2010,38(5):46-48.FENG Yan,FENG Zhibiao,WANG Nan.Methods available for determining free amino of hydrolysate of whey protein[J].China Dairy Industry,2010,38(5):46-48.(in Chinese)
[16]CHENG Zhihong,MOORE J,YU Liangli.High-throughput relative DPPH radical scavenging capacity [J].Journal of Agricultural and Food Chemistry,2006,54(20):7429-7436.
[17]KAUR G,JABBAR Z,ALAMMS,et al.Punica granatum (pomegranate)flower extract possesses potent antioxidant activity and abrogates Fe-NTAinduced hepatotoxicity in mice[J].Food and Chemical Toxicology,2006,44(7):984-993.
[18]隋正红,张学成.藻红蛋白研究进展[J].海洋科学,1998(4):24-27.SUI Zhenghong,ZHANG Xuecheng.Review on phycoerythrin research[J].Marine Sciences,1998(4):24-27.(in Chinese)

