小剂量睾酮补充治疗男性迟发性性腺功能减退症合并代谢综合征的临床研究
杨佳佳,张贤生,高晶晶,汤冬冬,叶元平,郝宗耀,周 骏,张翼飞,樊 松,梁朝朝
2002年国际老年男性研究学会(ISSAM)将男性更年期综合征重新命名为男性迟发性性腺功能减退症(late-onset hypogonadism,LOH),典型特征为性欲及勃起功能减退、易疲乏、抑郁和内脏脂肪沉积等临床症状及血清睾酮水平降低等。代谢综合征(metabolic syndrome,MS)是一种以腹型肥胖、糖耐量异常、高血压、血脂异常及炎症和血栓状态为病理生理基础,以多种代谢疾病共同出现为临床特点的症候群。研究[1-2]表明 LOH 及 MS均与低睾酮(testosterone,T)水平相关。该研究通过对80例中老年男性LOH合并MS患者进行小剂量睾酮补充治疗 (testosterone supplement therapy,TST),探讨TST对LOH合并MS的作用及影响。
1 材料与方法
1.1 研究对象 依照中华医学会男科学分会《2009男性性腺功能减退症诊疗手册》[3]中的中老年男性症状问卷(AMS)及MS诊断标准,将前列腺癌、红细胞增多症、严重睡眠呼吸暂停综合征等TST禁忌证予以排除后,选取2011年3月~2011年6月在安徽医科大学第一附属医院健康门诊体检的合并有LOH和MS的80例男性,年龄45~75(56.2±5.5)岁,以3∶1的比例随机分为实验组(n=60)和对照组(n=20),实验组年龄 45~73(57.2±5.1)岁;对照组年龄47~75(55.5±5.2)岁。实验组予以口服十一酸睾酮(每次40 mg,每日2次,餐后服用);对照组不做任何治疗。所有研究均取得患者知情同意,受试前至少6周未使用任何激素或对性激素水平有影响的药物。
1.2 问卷填写 应用AMS、国际勃起功能指数表(IIEF-5)及自制相关因素调查问卷,问卷内容包括年龄、身高、腰围(waist circumference,WC)、体重、职业、居住地、婚姻状况、受教育程度、收入情况、整体健康状况、行为及生活方式等,采用自我评分的方式,每3个月随访LOH症状,同时评估患者勃起功能障碍情况。所有问卷由被调查者结合自身情况及病史在泌尿外科医师指导下填写。文化程度低者,调查人员解释后根据调查对象口述真实填写。
1.3 实验室检查 每3个月随访监测血液中前列腺特异性抗原(prostate-specific antigen,PSA)水平、红细胞计数(red blood cell,RBC)、血红蛋白(hemoglobin,Hb)、红细胞比容(hematocrit,HCT)、空腹胰岛素(fasting insulin,FINS)及MS各项指标。胰岛素敏感性用胰岛素敏感指数(insulin sensitivity index,ISI),ISI=In(FBG ×FINS)-1。所有研究对象于晨7∶00~9∶00空腹肘静脉采血,分离血清后-20℃保存,所有血清标本由具有资质的实验人员统一测定。
1.4 判断标准 AMS量表共17个问题,每个问题1~5分,采用自我评分的方式评估LOH的严重程度,根据评分总分的不同分为:17~26分为无症状;27~36分为轻度;37~49分为中度;≥50分为重度。该量表同时分为精神心理、躯体及性功能3个分量:精神心理分量症状评分、躯体分量症状评分、性功能分量症状评分。各分量又具有各自的症状严重程度,精神心理分量症状评分的严重程度分为:无症状(5分)、轻度(6~8分)、中度(9~11分)、重度(≥12分)。躯体分量症状评分严重程度:无症状(7~8分)、轻度(9~12分)、中度(13~18分)、重度(≥19分)。性功能分量症状评分严重程度:无症状(5分)、轻度(6~7分)、中度(8~10分)、重度(≥11分)。
IIEF-5量表共有5个问题,每个问题0~5分,亦采用自我评估的方式评估勃起功能:总分22~25分为正常;12~21分为轻度障碍;8~11分为中度障碍;5~7分为重度障碍。
LOH诊断标准[4]:2002年ISSAM认可和推荐的标准——迟发性性腺功能低下的一种临床症候群,主要特征包括:性欲和勃起功能低下;情绪改变并伴有脑力和空间定向能力下降;容易疲劳、易怒、抑郁、肌力下降等;可伴有或无血清T水平降低。问卷采用应用广泛,权威性高,被国际上普遍接受的中老年男性症状问卷。
《2007中国成人血脂异常防治指南》[5]推荐的MS诊断标准,具备以下3项或更多诊断为MS,腹型肥胖:WC男性>90 cm,女性>85 cm;血三酰甘油(triglycerides,TG)≥1.70 mmol/L;血高密度脂蛋白胆固醇(HDL-C)<1.04 mmol/L;血压≥17.29/11.30 kPa或已确诊为高血压并治疗者;空腹血糖(fasting blood-glucose,FBG)≥6.1 mmol/L,或糖负荷后2 h血糖≥7.8 mmol/L,或有糖尿病史。
排除文献[3]提出的TST禁忌证:前列腺癌或乳腺癌患者、红细胞增多症患者、严重睡眠呼吸暂停综合征患者、良性前列腺增生伴有严重下尿路梗阻患者、严重心脏或肝、肾功能衰竭患者及PSA>4 ng/ml怀疑前列腺癌者。
1.5 统计学处理 采用SPSS 17.0统计软件进行分析。定量资料以±s表示,组间的差异性比较采用t检验。
2 结果
2.1 一般情况比较 治疗前两组患者年龄、临床症状评分、MS各项指标、T、PSA、RBC、Hb及 HCT比较,差异无统计学意义。见表1。
表1 对照组和试验组一般情况比较(±s)
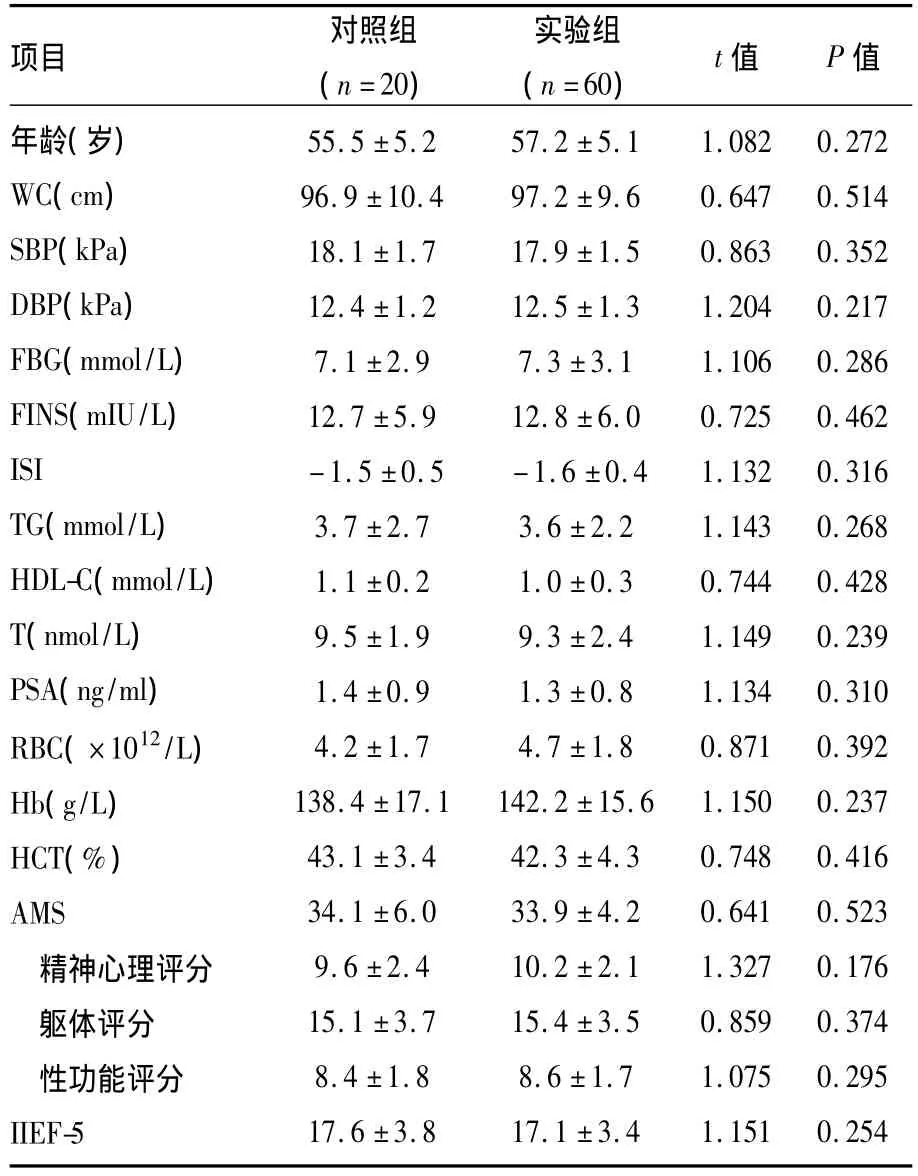
表1 对照组和试验组一般情况比较(±s)
?
2.2 血清T及临床症状评分变化 随访过程中实验组有2例失访,对照组有1例失访。实验组服用十一酸睾酮前血清T为(9.3±2.4)nmol/L(化学发光免疫分析法,参考值9.9~27.8 nmol/L),服用3、12个月后分别为(13.4±2.2)、(18.2±5.3)nmol/L,与对照组比较差异均有统计学意义(P<0.01)。实验组治疗3个月及12个月后精神心理症状、躯体症状评分及IIEF-5评分均有明显改善,与对照组比较差异有统计学意义(P<0.01)。见表2。
2.3 MS相关指标变化 实验组开始治疗3个月后FINS由(12.8±6.0)mIU/L降至(11.4±5.7)mIU/L,ISI由(-1.6±0.4)升至(-1.3±0.4),与对照组比较差异有统计学意义(P<0.05),其他MS指标变化与对照组比较,差异无统计学意义(P>0.05)。12个月后 WC、FBG、TG、HDL-C、FINS及ISI较治疗前均有明显改善,与对照组比较差异有统计学意义(P<0.01),而SBP及DBP改善不明显,与对照组比较差异无统计学意义(P>0.05)。见表3。
2.4 PSA、RBC、Hb及HCT变化 实验组治疗3个月及12个月后PSA、RBC、Hb及HCT较前均有升高,但个体间差异较大,差异无统计学意义(P>0.05)。见表4。
2.5 不良反应 使用十一酸睾酮治疗期间无明显不良反应出现,没有出现阴茎异常勃起,亦无水、钠潴留及排尿困难等症状发生。
表2 对照组和实验组血清T及临床症状评分变化(±s)
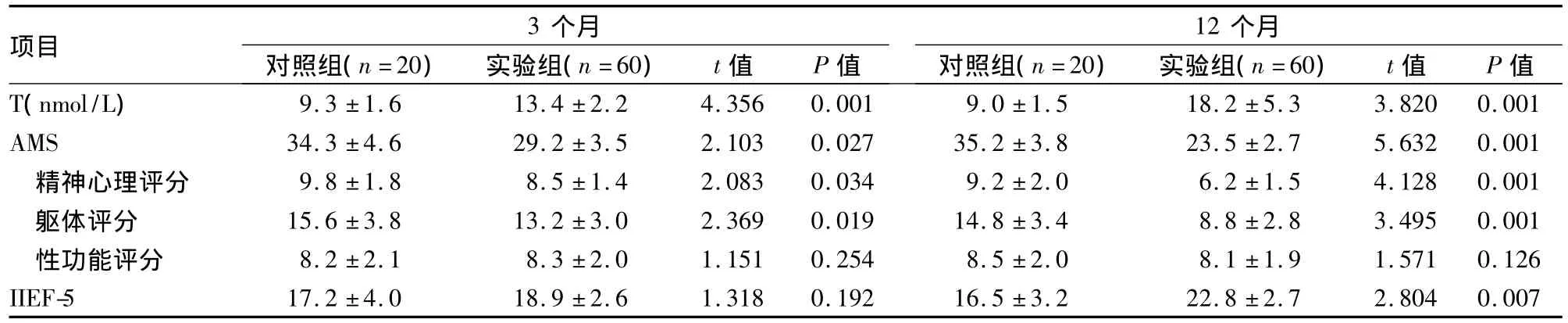
表2 对照组和实验组血清T及临床症状评分变化(±s)
?
表3 对照组和实验组MS相关指标变化(±s)
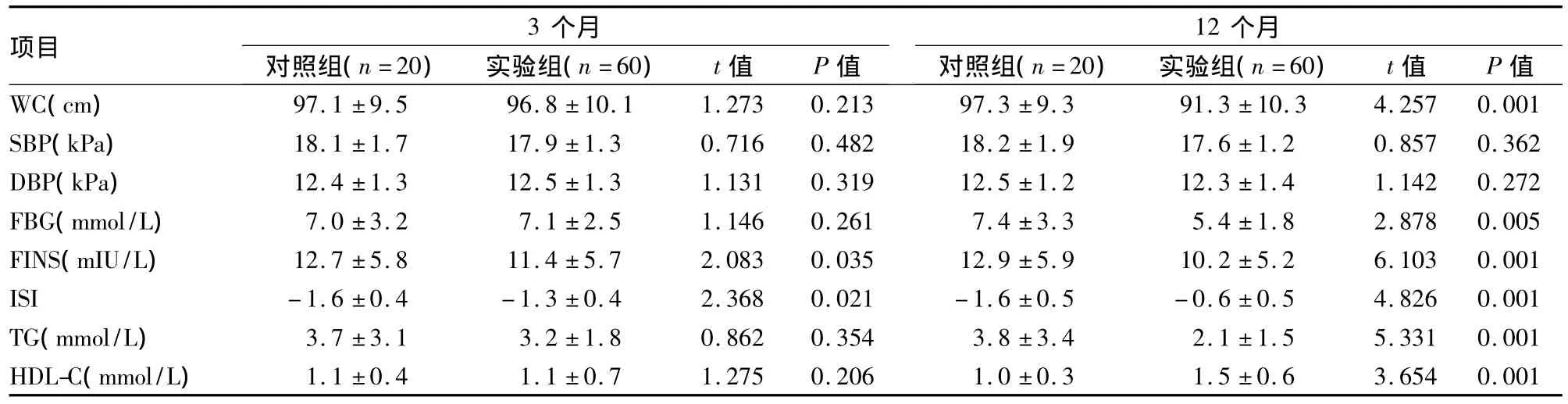
表3 对照组和实验组MS相关指标变化(±s)
?
表4 对照组和实验组PSA、RBC、Hb及HCT变化(±s)

表4 对照组和实验组PSA、RBC、Hb及HCT变化(±s)
?
3 讨论
现代医学对男性疾病越来越关注,尤其LOH及MS成为研究的热点。TST是LOH的首选治疗方案[2],对 MS 同样有效。Muller et al[1]发现,老年男性的血清T水平每升高一个标准差(每个标准差约为5.27 nmol/L),发生MS的危险将会降低57%。Kohei et al[6]对64例LOH患者采取TST观察至少6个月,发现精神心理及躯体症状评分明显改善。本研究中,对照组有3例(15.8%)精神心理及躯体症状出现改善,但使用十一酸睾酮患者改善率(35例,60.3%)明显高于对照组。随着T水平的增加,尽管性功能评分无明显意义的变化,但IIEF-5评分明显提高,与 Isidori et al[7]研究结果一致,这可能是因为虽然T提高了患者的勃起功能,但与低T相关的性欲低下、性交频率降低等并非原发于低T,而是性功能障碍引起的继发性反应。
腹型肥胖是MS发生、发展的关键环节,Allan et al[8]发现,为期1年的TST可选择性减少内脏脂肪聚集。研究[9]表明,TST可于短期内增加胰岛素敏感性,提高血糖控制能力。T可通过影响脂代谢而影响 MS 的发展,Haddad et al[10]指出,内源性睾酮对男性血脂代谢有益,前列腺癌患者手术去势后,T水平急剧下降,TG增加,高密度脂蛋白减少。Permpongkosol et al[11]观察 LOH 雄激素替代治疗,发现治疗后患者TG水平显著降低。研究[12]显示,十一酸睾酮可提高HDL水平。此外,T具有扩张血管、抑制平滑肌增殖的作用,可通过多种机制调节血压,Smith et al[13]指出,前列腺癌患者手术去势后,短期内可发生高血压和动脉硬化。本研究表明,TST后患者 WC、FBG、TG、HDL-C、FINS及 ISI水平均明显改善,但并未发现患者血压发生明显变化,笔者考虑可能与病例数较少、TST时间较短及个体差异等有关。
十一酸睾酮在体内通过乳糜管道直接吸收入血,避开肝脏的首过效应,口服安全有效。本研究中,实验组补充十一酸睾酮3个月后T水平上升至(13.4 ±2.2)nmol/L,12 个月后达到(18.2 ±5.3)nmol/L,笔者考虑这种差异一方面与样本量较小有关,另一方面,可能与T水平的周期性变化[14]有关。国外观察患者连续服用十一酸睾酮10年,其PSA在正常参考范围之内 (<4 μg/ml),对肝功能无不良影响[15]。本研究采取小剂量(40 mg/Bid)治疗,随访1年未见明显PSA升高、红细胞增多症等并发症发生。PSA不随TST发生持续而明显的升高或许可以用文献[16]解释,即当T低于一定水平时前列腺组织对T敏感,当T超过这一水平、雄激素受体达到饱和后前列腺对T的变化不再敏感。Pastuszak et al[17]对103例行前列腺癌根治术的患者采用平均27.5个月的TST后发现PSA升高,差异有统计学意义,但通过对PSA速率(PSAV)分析发现PSAV明显低于行TST的不伴前列腺癌的LOH患者及前列腺癌根治术后生化复发的患者,因此指出这种有统计学差异的PSA升高并不能说明TST会导致前列腺癌复发。Page et al[18]指出,T在 5α 还原酶作用下的代谢产物双氢睾酮(DHT)是前列腺增生及前列腺癌危险因子,补充T的同时补充适量的5α还原酶抑制剂可降低前列腺风险,笔者将在下一步研究中予以验证。
[1]Muller M,Grobbee D E,den Tonkelaar I,et al.Endogenous sex hormones and metabolic syndrome in aging men[J].J Clin Endocrinol Metab,2005,90(5):2618 -23.
[2]Toshiyasu Amano.New androgen replacement therapy trials in Japan[J].J Men's Health,2011,8:S33 -5.
[3]朱积川,王晓峰,邓春华,等.男性性腺功能减退症诊疗手册[M].北京:人民卫生出版社,2009:17-33.
[4]Morales A,Lunenfeld B.Investigation,treatment and monitoring of late-onset hypogonadism in aging males[J].Aging Male,2002,5(2):74-86.
[5]中国成人血脂异常防治指南制定委员会.中国成人血脂异常防治指南[J].中华心血管病杂志,2007,35(5):390 -413.
[6]Kohei Yamaguchi,Makoto Ando,Koji Chiba,et al.The efficacy of androgen replacement therapy in men with late-onset hypogonadism[J].J Men's Health,2011,8:S46 -9.
[7]Isidori A M,Giannetta E,Gianfrilli D,et al.Effects of testosterone on sexual function in men:results of a meta-analysis[J].Clin Endocrinol,2005,63(4):381 -94.
[8]Allan C A,Strauss B J,Burger H G,et al.Testosterone therapy prevents gain in visceral adipose tissue and loss of skeletal muscle in nonobese aging men[J].J Clin Endocrinol Metab,2008,93(1):139-46.
[9]Pitteloud N,Mootha V K,Dwyer A A,et al.Relationship between testosterone levels,insulin sensitivity,and mitochondrial function in men[J].Diabetes Care,2005,28(7):1636 -42.
[10]Haddad R M,Kennedy C C,Caples S M,et al.Testosterone and cardiovascular risk in men:a systematic review and meta-analysis of randomized placebo-controlled trials[J].Mayo Clin Proc,2007,82(1):29-39.
[11]Permpongkosol S,Tantirangsee N,Ratana-olarn K.Treatment of 161 men with symptomatic late onset hypogonadism with long-acting parenteral testosterone undecanoate:effects on body composition,lipids,and psychosexual complaints[J].J Sex Med,2010,7(11):3765-74.
[12]Zitzmann M,Nieschlag E.Androgen receptor gene CAG repeat length and body mass index modulate the safety of long-term intramuscular testosterone undecanoate therapy in hypogonadal men[J].J Clin Endocrinol Metab,2007,92(10):3844 -53.
[13]Smith M R,Lee H,Nathan D M.Insulin sensitivity during combined androgen blockade for prostate cancer[J].J Clin Endocrinol Metab,2006,91(4):1305 -8.
[14]蒋 鸣.男性排精后血清睾酮水平的周期性变化[J].生理学报,2002,54(6):535 -8.
[15]Gooren L J.A ten-year safety study of the oral androgen testosterone undecanoate[J].J Androl,1994,15(3):212 - 5.
[16]Khera M,Bhattacharya R K,Blick G,et al.Changes in prostate specific antigen in hypogonadal men after 12 months of testosterone replacement therapy:support for the prostate saturation theory[J].J Urol,2011,186(3):1005 -11.
[17]Pastuszak A W,Pearlman A M,Lai W S,et al.Testosterone replacement therapy in patients with prostate cancer after radical prostatectomy[J].J Urol,2013,190(2):639 - 44.
[18]Page S T,Hirano L,Gilchriest J,et al.Dutasteride reduces prostate size and prostate specific antigen in older hypogonadal men with benign prostatic hyperplasia undergoing testosterone replacement therapy[J].J Urol,2011,186(1):191 -7.

