Eg5基因对膀胱癌T24细胞增殖和迁移的影响
陈杰勋,于德新,张志强,王 铮,谢栋栋,王 毅,张 涛,陈 磊,丁德茂,邹 慈,闵 捷,褚 晗
纺锤体驱动蛋白 Eg5(又称 KSP、KIF11、KNSL1)最早是从非洲爪蟾卵中克隆出来的驱动蛋白超家族,属于驱动蛋白5家族[1]。Eg5基因位于10q24.1,基因组长6 216 kbp,含22个外显子,编码分子量为119 ku、1 057个氨基酸组成的蛋白质。Eg5主要在细胞质中表达,少部分在细胞核中表达,通过磷酸化来实现其调节纺锤体形成、核糖体转运率等功能,但过度表达Eg5会干扰正常纺锤体的组配和功能独特的平衡力,导致纺锤体缺失形成、遗传不稳定和肿瘤发生[2]。近来研究[3-5]显示 Eg5 在多种恶性肿瘤中呈高表达,如前列腺癌、肝癌、肺癌等。Ding et al[6]研究发现,膀胱癌组织 Eg5表达明显高于正常膀胱组织,且与预后密切相关,但具体机制尚不清楚。该研究旨在运用小干扰RNA(small interfering,siRNA)沉默 Eg5在膀胱癌 T24细胞株中表达,观察其对膀胱癌细胞增殖与迁移的影响。
1 材料与方法
1.1 材料 人膀胱移行上皮癌T24细胞株购于中国典型培养物保藏中心。Eg5鼠抗人单克隆抗体(美国Abcam公司);转染脂质体Lipofectamin 2000(美国Invitrogen公司);RPMI 1640细胞培养液、胰蛋白酶(美国Gibco公司);噻唑蓝(MTT)(美国Sigma公司)。3组针对Eg5基因的siRNA序列参照文献[7-9]由上海吉玛制药有限公司合成:干扰1组正义链:5'-CCGAGCUCUCUUAUCAACATT-3',反义链:5'-GAUAAGAGAUCGGTT-3;干扰2组正义链:5'-CUCAAGACCUGAAGACAAUTT-3',反义链:5'-AUUGUCUUCAGGUCUUCAGTT-3';干扰3组正义链:5'-AGGACAACUGCAGCUACUCTT-3', 反 义 链:5'-GAGUAGCUGCAGUUGUCCUTT-3'。
1.2 方法
1.2.1 细胞培养及转染分组 人膀胱移行细胞癌T24细胞株在无菌条件下用含10%胎牛血清、1%双抗(青霉素+链霉素)的RPMI 1640培养液中,置于37℃、5%CO2饱和湿度条件下培养。转染前1 d,将处于对数生长期的T24细胞以5×105个/孔的密度接种于6孔板中;次日,当T24细胞丰度为50%~70%时进行转染。实验将T24细胞分为3组:①干扰组,分别转染3条靶向Eg5-siRNA;②阴性对照组,转染无关siRNA;③空白对照组,只加入转染试剂。转染5 h后,更换含血清及抗生素的培养液继续培养。
1.2.2 Western blot法检测T24细胞 Eg5蛋白的表达 分别取转染后72 h的各组细胞,预冷PBS洗2次后提取细胞总蛋白,经BCA法定量蛋白后,分别取各组蛋白30 μg/孔进行SDS-PAGE凝胶电泳,250 mA恒流2.5 h后将蛋白转移至PVDF,用含5%BSA的TBST室温封闭1 h;加入相应抗体4℃孵育过夜,TBST洗3次,每次10 min,加入二抗,室温孵育1.5 h,TBST 洗 3 次,每次 10 min,最后用增强化学发光(ECL)检测信号强度。
1.2.3 台盼蓝实验检测细胞的死亡率 取对数生长期细胞调整浓度1×105/ml,接种于24孔培养板中,分别在转染 24、48、72 h后收取细胞,3 200 r/min离心3 min后以适量体积重悬,用0.04%台盼蓝溶液与等体积细胞悬液混匀3 min后计数活细胞和死细胞。细胞死亡率(%)=死细胞总数/(活细胞总数+死细胞总数)×100%。
1.2.4 MTT比色法检测细胞增殖抑制 将各组细胞以2×104个/孔接种于96孔板,体积200 μl/孔,每组设置3个复孔。分别于转染后24、48、72、96 h进行MTT检测,每孔加入5 g/L的MTT 20 μl,继续培养4 h,弃上清液,加150 μl二甲基亚砜(DMSO),震荡5 min。经酶联检测仪上于570 nm测吸光度(A)值,计算各组细胞增殖抑制率(IR)。IR(%)=(对照组A均值-实验组A均值)/对照组A均值×100%。
1.2.5 平板克隆形成实验测定细胞增殖能力 操作按参考文献[10],即细胞转染后48 h,再转染1次,48 h后将细胞以960/孔密度接种于6孔板,与培养箱培养6 d。PBS洗2次,甲醇固定,1%结晶紫染色,计算克隆数,各组实验重复3次。克隆形成率=克隆数/接种细胞数×100%。
1.2.6 划痕愈合实验检测细胞的迁移能力 细胞转染24 h后,将细胞以5×105个/孔接种到6孔板中,细胞丰度为95%时,使用20 μl枪头在单层细胞表面划痕,PBS漂洗2次,更换RPMI 1640培养基,继续培养12 h,分别在划痕后的0、6、12 h拍照观察细胞的相对迁移能力。细胞迁移距离=(0 h划痕距离-12 h划痕距离)。
1.3 统计学处理 采用SPSS 16.0统计软件分析,计量数据以±s表示,两组间比较采用t检验,多组比较采用单因素方差分析。
2 结果
2.1 siRNA干扰对T24细胞中Eg5表达的影响转染72 h后,Western blot检测结果显示,5组细胞均不同程度表达Eg5,3组特异性干扰组明显低于空白对照组,且干扰3组的Eg5表达相对强度明显低于干扰1、2两组,见图1。选用沉默效率最高的干扰组进行后续实验。

图1 siRNA转染对T24细胞中Eg5蛋白水平的影响
2.2 siRNA干扰对T24细胞死亡的影响 与空白对照组和阴性对照组细胞比较,Eg5基因瞬时转染到T24细胞后,对细胞死亡产生了促进作用,表现为在转染后24、48、72 h,干扰组细胞死亡率高于空白对照组,差异有统计学意义(t值分别为 -4.48、-22.61、-26.36,P <0.05)。而空白对照组和阴性对照组比较,差异无统计学意义(t值分别为-2.01、-2.95、-1.91,P >0.05)。见表1。
表1 siRNA干扰后不同时间T24细胞死亡率的变化(%,n=3,±s)
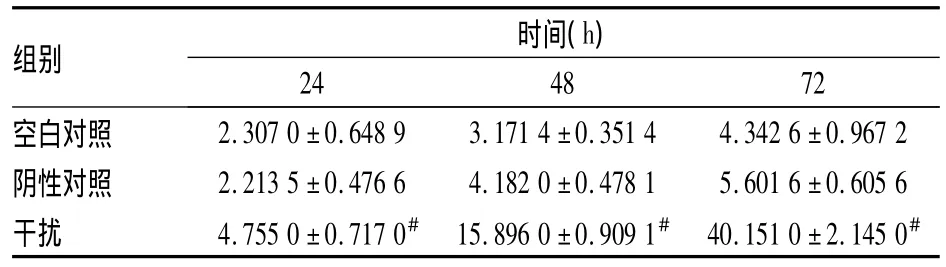
表1 siRNA干扰后不同时间T24细胞死亡率的变化(%,n=3,±s)
与空白对照组比较:#P<0.05
?
2.3 siRNA干扰后对T24细胞增殖的影响 MTT实验结果显示,T24细胞行Eg5基因干扰后24~96 h,与空白对照组细胞比较吸光度A值降低,阴性对照组T24细胞24~96 h增殖抑制率分别为0.72%、0.83%、1.25%、0.78%,干扰组T24细胞的24~96 h增殖抑制率分别为 5.91%、22.82%、38.50%、41.27%,对应时程组间增殖抑制率比较差异均有统计学意义(F 值分别为 113.6、214.7、247.3、517.2,P<0.05),见图2。平板克隆形成抑制的结果与此一致,干扰组的细胞克隆形成能力明显比空白对照组减弱,干扰组的克隆形成率为(8.2±0.08)%,空白照组、阴性对照组的克隆形成率分别为(23.61±0.36)%、(22.68±0.26)%,差异有统计学意义(F=84.87,P <0.05),见图3。
2.4 siRNA干扰后对T24细胞迁移能力的影响划痕实验表明,空白对照组、阴性对照组、干扰组的迁移距离分别为(593.59±1.73)、(588.97±5.86)、(434.56±8.39)μm,干扰组与空白对照组、干扰组与阴性对照组两两比较差异均有统计学意义(t值分别为32.16、26.13,P <0.05),见图4。
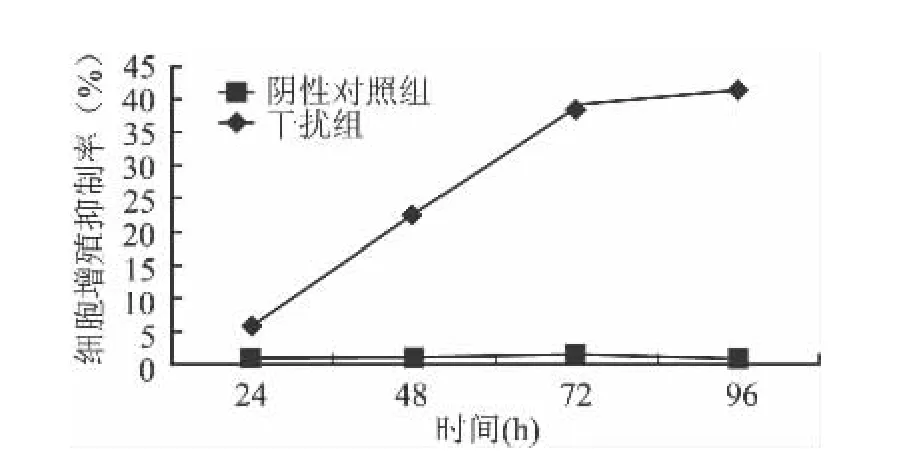
图2 MTT法检测转染后各时点T24细胞增殖抑制率

3 讨论
膀胱癌亦存在较高的复发率,寻找一种新的治疗方法已成为一个重要课题,而近年以siRNA为基础的基因治疗成为膀胱癌新治疗手段的研究热点。
本研究结果显示T24膀胱癌移行细胞株中存在Eg5阳性表达,且移行细胞癌是膀胱癌中最常见的肿瘤类型,故以T24膀胱癌移行细胞株为研究对象具有一定代表性。在采用siRNA沉默Eg5基因后进行的Western blot实验中,T24细胞中Eg5的蛋白水平明显下降,说明本实验设计序列具有特异性。
诱导细胞死亡是癌症治疗的一种手段。抗微管一直是被认为是诱导肿瘤细胞死亡的有效方法,但传统抗微管药(如紫衫烷类及长春新碱类)因会结合轴突微管引起明显的周围神经病变等毒副作用,因此Eg5作为抗微管的新靶点已成为热点。有学者[11]研究发现,对多西他赛耐药的前列腺癌细胞对Eg5抑制剂STLC仍然敏感,STLC对前列腺癌细胞杀伤作用不受P-糖蛋白水平的影响。本实验采用台盼蓝实验结果显示下调Eg5基因能促进膀胱癌T24细胞的死亡且存在时间依赖性,即随时间延长,细胞死亡率逐渐增加,并且作用在72 h达最大。
肿瘤形成的特点之一是细胞增殖不受机体调控以及形成大量非整倍体细胞。Marra et al[12]将特异性Eg5基因用电穿孔方法分别在0、15 d导入卵巢癌细胞SKOV-3成瘤的裸鼠中,与对照组比较实验组中裸鼠肿瘤的生长得到明显抑制,且大部分肿瘤细胞被抑制在亚G1期。克隆形成能力反映细胞群体依赖性和增殖能力两个重要特征,更倾向于反映肿瘤细胞的“接触不抑制”特征,是反映肿瘤恶性程度的重要指标。本实验结果显示,与空白对照组和阴性对照组相比,RNAi干扰Eg5基因表达后,膀胱癌细胞克隆数目和MTT吸光值明显下降,这表明沉默Eg5基因在T24细胞中表达能抑制T24细胞的增殖能力,可能与抑制细胞的过度有丝分裂、减少其产生非整倍体细胞、调控细胞周期有关。

图4 siRNA干扰Eg5基因对T24细胞迁移的影响 ×10A:空白对照组;B:阴性对照组;C:干扰组;1:0 h;2:12 h
肿瘤细胞的发生是多因素、多步骤、多阶段的,肿瘤细胞的转移是肿瘤恶性生物学行为的主要特征,是引起肿瘤治疗失败和死亡的主要原因。Sun et al[13]研究发现,dimethylenastron(一种 Eg5 抑制剂)可以明显抑制高表达Eg5基因胰腺癌细胞的迁移和侵袭能力。本研究采用划痕实验检测siRNA沉默Eg5基因对T24细胞迁移的影响,结果表明下调Eg5蛋白表达后可显著抑制T24细胞的迁移能力。肿瘤的转移能力与其诱导降解细胞外基质、基底膜的多种酶相关[14],而Eg5有可能上调此类相关酶类物质从而促进T24细胞侵袭转移。
[1]Le Guellec R,Paris J,Couturier A,et al.Cloning by differential screening of a Xenopus cDNA that encodes a kinesin-related protein[J].Mol Cell Bio,1991,11(6):3395 - 8.
[2]Castillo A,Morse H C 3rd,Godfrey V L,et al.Overexpression of Eg5 causes genomic instability and tumor formation in mice[J].Cancer Res,2007,67(21):10138 -47.
[3]Saijo T,Ishii G,Ochiai A,et al.Eg5 expression is closely correlated with the response of advanced non-small cell lung cancer to antimitotic agents combined with platinum chemotherapy[J].Lung Cancer,2006,54(2):217 -25.
[4]卢正磊,任维华,荚卫东,等.驱动蛋白Eg5在肝细胞癌中的表达及其意义[J].安徽医科大学学报,2012,47(9):1091 -4.
[5]Xing N D,Ding S T,Saito R,et al.A potent chemotherapeutic strategy in prostate cancer:S-(methoxytrityl)-L-cysteine,a novel Eg5 inhibitor[J].Asian J Androl,2011,13(2):236 - 41.
[6]Ding S,Xing N,Lu J,Zhang H,et al.Overexpression of Eg5 predicts unfavorable prognosis in non-muscle invasive bladder urothelial carcinoma[J].Int J Urol,2011,18(6):432 -8.
[7]Koller E,Propp S,Zhang H,et al.Use of a chemically modified antisense oligonucleotide library to identify and validate Eg5(kinesin-like 1)as a target for antineoplastic drug development[J].Cancer Res,2006,66(4):2059 -66.
[8]Rello-Varona S,Vitale I,Kepp O,et al.Preferential killing of tetraploid tumor cells by targeting the mitotic kinesin Eg5[J].Cell Cycle,2009,8(7):1030 -5.
[9]Matsuda M,Yamamoto T,Matsumura A,et al.Highly efficient eradication of intracranial glioblastoma using Eg5 siRNA combined with HVJ envelope[J].Gene Ther,2009,6(12):1465 - 76.
[10]Franken N A,Rodermond H M,Stap J,et al.Clonogenic assay of cells in vitro[J].Nat Protoc,2006,1(5):2315 - 9.
[11]Wiltshire C,Singh B L,Stockley J,et al.Docetaxel-resistant prostate cancer cells remain sensitive to S-trityl-L-cysteine-mediated Eg5 inhibition[J].Mol Cancer Ther,2010,9(6):1730 -9.
[12]Marra E,Palombo F,Ciliberto G,et al.Kinesin spindle protein SiRNA slows tumor progression[J].J Cell Physiol,2013,228(1):58-64.
[13]Sun X D,Shi X J,Sun X O,et al.Dimethylenastron suppresses human pancreatic cancer cell migration and invasion in vitro via allosteric inhibition of mitotic kinesin Eg5[J].Acta Pharmacol Sin,2011,32(12):1543 -8.
[14]张志强,于德新,黄 韵,等.小干扰RNA沉默血管内皮生长因子对ACHN肾癌细胞黏附、侵袭及迁移的影响[J].中华实验外科杂志,2011,28(11):1947 -9.

