野黄芩素及其葡萄糖醛酸结合物在大鼠体内的药动学研究
刘 跃,黄 勇,董永喜,王永林,郑 林
(贵阳医学院1.药学院贵州省药物制剂重点实验室、2.民族药与中药开发应用教育部工程研究中心,贵州贵阳 550004)
野黄芩苷为中药灯盏花制剂的主要有效成分,作为治疗心脑血管疾病的有效药物广泛应用于临床。野黄芩素(seutellarein)又称灯盏乙素苷元,为野黄芩苷的主要代谢产物[1-2]。Chen等[3]研究了野黄芩苷口服给药的人体药动学,推断野黄芩苷被肠道菌群及酶水解为苷元而吸收。居文政等[4]实验结果表明,在吸收入血前,胃肠道内野黄芩苷与其苷元并存,且苷元易于吸收。上述研究结果与黄芩苷等黄酮苷类成分口服后在肠道菌群作用下发生完全或部分水解,其药理作用被认为是通过代谢产物苷元吸收所产生的研究报道相符合[5-7]。车庆明等[2]对野黄芩素即灯盏乙素苷元的药动学研究中发现,野黄芩素被吸收后,在体内易发生葡萄糖醛酸化形成葡萄糖醛酸结合物。因此,野黄芩素及其葡糖糖醛酸化产物均可能为野黄芩苷的体内有效形式。
中药不少成分在体内转化为有效的代谢物而发挥药理作用,而了解这些代谢成分在体内的动态过程也相当重要[2]。目前对于野黄芩素的药动学研究较少,且对于野黄芩素体内主要存在形式葡萄糖醛酸结合物的药动学研究未见报道。本文采用酶水解方式,以UPLC-MS/MS法检测并研究了大鼠静脉给予野黄芩素后,野黄芩素及其代谢产物葡萄糖醛酸结合物的药动学过程,为全面评价野黄芩素的体内过程和野黄芩苷及其苷元系列药物的开发应用提供理论依据。
1 材料与仪器
1.1 药品试剂 葛根素(puerarin,批号0752-9605)购自中国食品药品检定研究院,野黄芩素(Scutellarein)实验室自制(纯度>95%),甲醇(天津科密欧化学试剂有限公司)、乙腈(德国Merck公司)为色谱纯,β-Glucuronidase from Helix pomatia(Type H-2,aquecous solution,≥85 000 kU·L-1,CAS:9001-45-01,Sigma),其余溶剂均为分析纯,水为超纯水。
1.2 仪器设备 Acquity系统超高液相色谱-三重四级杆串联质谱仪(美国Waters公司,包括二元梯度泵、自动进样器、柱温箱、三重四级杆质谱分析器和Masslynx4.1质谱工作站),ZH-2涡旋混合器(天津药典标准仪器厂),Allegra 64R低温高速离心机(美国 Beckma公司),MTN-2800D氮吹浓缩装置(天津奥特塞恩斯仪器有限公司)。
1.3 试验动物 健康Wistar大鼠♀♂兼用,体质量为(330±20)g,由贵阳医学院动物中心提供,动物许可证号SCXK(黔)2002-0001。
2 方法
2.1 标准溶液的配制
2.1.1 野黄芩素系列标准溶液的配制 称取野黄芩素9.4 mg,用甲醇定容至10 ml,获得野黄芩素(0.94 g·L-1)的储备液。量取野黄芩素对照品储备液适量,用甲醇按梯度稀释成所需浓度,得系列混合标准溶液。置冰箱(-20℃)保存,备用。
2.1.2 内标溶液的配制 精密称取葛根素10.33 mg,用甲醇定容至 25 ml,获得葛根素(0.4132 g·L-1)的储备液。取内标储备液适量至5 ml容量瓶中,用甲醇定容至刻度,配制成20 mg·L-1的内标溶液,置冰箱(-20℃)保存,备用。
2.2 色谱条件 色谱柱:Waters BEH C18(2.1 mm×50 mm,1.7μm)柱,保护柱:Waters Van Guard BEH C18(2.1 mm×5 mm,1.7μm),流动相:0.1%甲酸乙腈(A)-0.1%甲酸水(B),梯度洗脱(0~2.5 min,10%A;2.5~3 min,30%→90%A;3~4min,90%→ 10%A),流速:0.35 ml· min-1,柱温:45℃,进样体积为1μl。
2.3 质谱条件 采用电喷雾电离源,正离子模式(ESI+),毛细管电离电压3 kV,离子源温度120℃;喷雾气与反吹气:N2,去溶剂气流速:650 L·h-1,去溶剂气温度:350℃,反吹气流速为50 L·h-1;碰撞气:Ar,碰撞气流速:0.16 ml·min-1,扫描方式为多反应离子监测(MRM),质谱数据采集及处理软件为MassLynx V4.1工作站。野黄芩素及内标用于定量分析的监测离子反应分别为m/z 286.9→122.9;m/z 417.0→267.0。
2.4 样品处理
2.4.1 原型药物浓度的血浆样品的处理 取大鼠血浆100μl,置塑料离心管中,依次加入0.4%Vc溶液50μl,旋涡30 s,依次加入内标葛根素溶液20 μl(20 mg·L-1),50μl 1%甲酸,400μl甲醇,涡混30 s,超声5 min,15 000 r·min-1离心5 min,上清液吹干后400μl甲醇复溶,离心,取上清液进样分析。
2.4.2 水解后药物浓度的血浆样品的处理 取大鼠血浆100μl,置塑料离心管中,依次加入0.4%Vc溶液50μl,10μlβ-葡萄糖醛酸酶(8 500 kU·L-1,溶剂为蒸馏水)旋涡30 s,37℃温孵30 min,冰浴冷却,依次加入内标葛根素溶液20μl(20 mg·L-1),50μl 1%甲酸,400μl甲醇,涡混30 s,超声 5 min,15 000 r·min-1离心5min,上清液吹干后400μl甲醇复溶,离心,取上清液进样分析。
2.5 方法考察
2.5.1 专属性考察 取大鼠空白血浆100μl,除不加标液外,其余按“2.4样品处理”项下方法操作,获得空白样品色谱图A;将一定浓度标准溶液和内标加溶液入空白血浆,依同法操作,获得相应色谱图B;取大鼠给药后血浆,依法操作得相应色谱图C。野黄芩素及内标的保留时间分别为2.42、1.07,由Fig 1可以看出,成分间分离良好,未见血浆中杂质干扰。

Fig 1 Chromatogram of(A)blank solution,(B)blank solution spiked w ith standands and(C)real sam ple
2.5.2 标准曲线的制备和LLOD 取准溶液50μl至离心管中,48℃下N2吹干,依次加入0.4%Vc溶液50μl,大鼠空白血浆100μl,配制成相当于大鼠血浆药物浓度为 28.20、9.400、3.133、1.044、0.3480、0.1160 mg·L-1的血浆样品,其余按“2.4样品处理”项下操作,建立标准曲线。以待测物的峰面积与内标峰面积之比(A/Ai)为纵坐标Y,各物质浓度(C)为横坐标X进行直线回归,权重系数为1/X,求得直线方程,即为标准曲线。野黄芩素最低检测限(LLOD)定义为 S/N≥3。结果表明大鼠血浆中野黄芩素在其线性范围内(0.1160~28.20)线性关系良好(r≥0.999)。典型大鼠标准曲线为Y=0.286169X-0.03704。最低定量限(LLOQ)为0.1160 mg·L-1,其回收率为 104.7±6.2(n=6)。最低检测限为0.035 mg·L-1。

Fig 2 Concentration-time curves for scutellarein and its conjugate formation after intravenous adm inistration of 12 mg· kg-1 of scutellarein to rat(n=5)
2.5.3 准确度和精密度 按“2.5.2标准曲线的制备”项下分别配制野黄芩素大鼠血浆低、中、高3个浓度的质量控制样品(QC),每一个浓度进行5样本分析,3种浓度连续测定5 d,并与标准曲线同时进行。根据当日标准曲线计算QC样品的浓度,与配制浓度对照,将QC样品的结果进行计算,求得本方法的精密度与准确度。对3个浓度下大鼠血浆的日内和日间精密度进行了考察,结果表明野黄芩素日内和日间精密度RSD(%)小于4%,准确度范围为93.7%~105.3%,提示该方法准确、可靠、重现性好。
2.5.4 基质效应考察 取空白血浆100μl,除不加对照溶液与内标外,其余按“2.4样品处理”项下操作,向获得的上清液中加入低、中、高浓度的对照溶液50μl和内标20μl,涡流混合,48℃氮气吹干。残留物以400μl甲醇溶解,每个浓度进样5次,获得相应峰面积;另取上述低、中、高浓度的对照溶液50μL与内标20μl(溶剂均为甲醇),加甲醇稀释至400μl。每个浓度进样5次,获得相应峰面积,提取后的峰面积与之相比,比值计算基质效应。结果野黄芩素和内标结果比值均在90%和110%之间,表明均不存在明显基质效应。
2.5.5 提取回收率测定 取大鼠空白血浆100μl,按“2.5.2标准曲线的制备”项下配制大鼠血浆低、中、高3个浓度的质量控制样品(QC),每一个浓度进行5样本分析,以400μl甲醇溶解,记录其峰面积。另取空白血浆,按“2.4.1样品处理”项下操作。离心后获得上清液,加入与上述相应浓度的标准溶液(每一个浓度进行5样本分析),于48℃氮气吹干,以400μl甲醇溶解,获得相应峰面积值。经测定野黄芩素线性范围内低、中、高3个浓度的血浆样品提取回收率分别为:(84.4±7.6)%、(81.5±2.8)%、(90.5±3.0)%。内标的提取回收率为97.3%。
2.5.6 稳定性考察 按“2.5.2标准曲线的制备”项下配制大鼠血浆低、中、高3个浓度的质量控制样品(QC),在0 h、12 h分别进样,以考察处理后血浆样品中野黄芩素在自动进样器条件下的稳定性,以每一浓度5样本分析。此外,实验还考查了低、中、高3个QC浓度血浆样品在室温(约20℃)下放置6 h,4℃下冷藏12 h和冻融3次的稳定性。经测定,各成分所得到的峰面积与零时间点的偏差均在10%以内,提示实验条件下血浆样品稳定性良好。
2.6 实验方案与样品检测 健康Wistar大鼠6只,♂鼠,体质量为(330±20)g。给药剂量为12 mg·kg-1,给药前12 h禁食,自由饮水。尾静脉注射野黄芩素溶液,于给药前与给药后 5、10、15、20、30、40、60、80、100 min经眼底静脉丛取血约 0.4 ml置涂有肝素和Vc(1%)的塑料离心管中,5 000 r·min-1离心3 min,分离血浆于-20℃冰箱中保存,直至分析。
样品测定方法按“2.4样品处理”项进行,每批次生物样品测定随行标准曲线。在每批测定时随行测定低、中、高3个浓度的质控样品(QC),每个浓度的QC样品进行双样本分析。根据每一分析批的标准曲线计算QC样品和未知样品的浓度。
3 结果
大鼠静脉注射野黄芩素12 mg·kg-1后,通过温和酶解方式,将野黄芩素的代谢产物葡萄糖醛酸结合物转化为野黄芩素,然后以扣除原型本底方式间接求取野黄芩素葡萄糖醛酸结合物血浆浓度,野黄芩素及其葡萄糖醛酸结合物的平均血药浓度-时间曲线见图 2。采用DAS2.0软件计算药动学参数,见Tab 1。C-t曲线结果表明大鼠静脉给予野黄芩素后,原型进入体内后能快速转化为其葡萄糖醛酸结合物,除5 min外,各时间点大鼠血浆中葡萄糖醛酸结合型药物浓度明显高于原型。野黄芩素及其葡萄糖醛酸结合物均符合二室开放模型;由分布相半衰期、消除相半衰期结果可知,原型及其结合物在体内的分布行为较为接近;但消除半衰期差异较大(P<0.05),结合物消除较慢可能与其分子极性和分子量大于母体苷元而导致跨膜转运受阻有关。其余药动学参数无差异(P>0.05),表明两者在体内有相似的分布及清除行为;AUC参数提示野黄芩素在体内很大部分转化为其葡萄糖醛酸结合物,以结合形式作为其主要存在形式。
Tab 1 Main pharmacokinetic parameters after intravenous adm inistration of 12 mg·kg-1 of scutellarein to ra
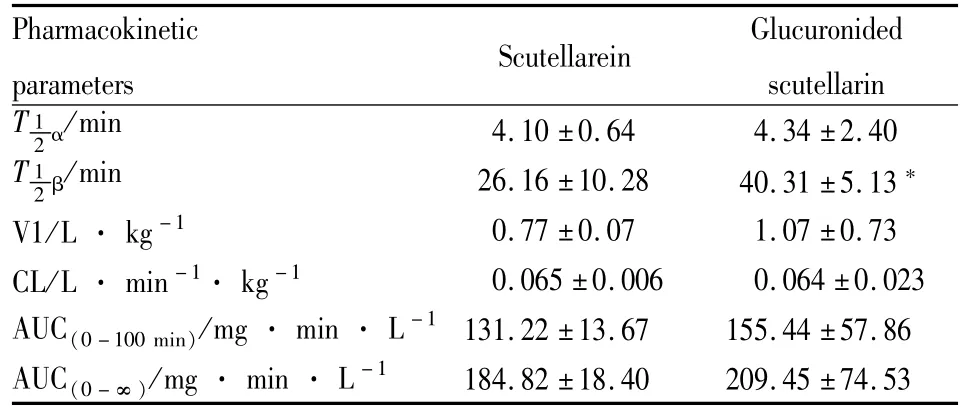
Tab 1 Main pharmacokinetic parameters after intravenous adm inistration of 12 mg·kg-1 of scutellarein to ra
*P<0.05 vs scutellarein
Pharmacokinetic parameters Scutellarein Glucuronided scutellarin T 4.10±0.64 4.34±2.40 T 12α/min 12β/min 26.16±10.28 40.31±5.13*V1/L· kg-1 0.77±0.07 1.07±0.73 CL/L· min-1· kg-1 0.065±0.006 0.064±0.023 AUC(0-100 min)/mg· min· L-1 131.22±13.67 155.44±57.86 AUC(0-∞)/mg· min· L-1184.82±18.40 209.45±74.53
4 讨论
现阶段中药药代动力学研究多以药物母体形式为研究对象,往往忽视药物在进入体内后其代谢产物的药动学变化规律,这种忽略有可能会对药物的动力学甚至是药理、毒理评价带来偏倚。黄酮类化合物拥有广泛的生物学和药理学活性,这类化合物在血浆中主要以葡萄糖醛酸的结合形式存在[8]。因此,在研究黄酮类药物原型成分药动学过程的同时,应考虑对其代谢产物药动学过程的分析。但由于药物代谢产物在生物样本中浓度较低且大多缺乏供定量检测用的标准对照品,极大限制了药物代谢产物的体内过程研究。
前期研究表明,野黄芩素及其主要代谢产物葡萄糖醛酸结合物在体内并存,因此本研究采取专属温和的酶解方式,将结合物转化为野黄芩素,然后以扣除原型本底方式间接求取野黄芩素葡萄糖醛酸结合物血浆浓度。运用此方法获知野黄芩素及其葡萄糖醛酸结合物的体内经时变化过程,初步阐明了野黄芩素及其主要代谢产物的动态变化规律。本研究以酶解间接测定野黄芩素代谢物,在一定程度上解决了代谢物定量缺乏标准对照品的难题,拓展了药代动力学研究的手段。
本实验还考察了酶解条件,研究结果表明,当酶浓度为85 unit、酶解30 min时,样品中野黄芩素葡萄糖醛酸结合物完全水解为野黄芩素。且在预实验中发现,野黄芩素在血浆中有少量降解现象,通过参考有关文献[9],在血浆样品制备时,加入了一定量的Vc溶液以确保样品制备过程中的稳定。
参考文献:
[1] 车庆明,潘丽怡,陈 颖,等.灯盏花乙素苷元的药动学研究[J].中国药学杂志,2007,42(18):1418-21.
[1] Che Q M,Pan L Y,Chen Y,etal.Study on pharmacokinetics of scutellarein in rats[J].Chin Pharm J,2007,42(18):1418-21.
[2] 车庆明,陈 颖,潘丽怡,等.灯盏花乙素苷元的胆汁排泄研究[J].中国药学杂志,2006,31(20):1710-2.
[2] Che Q M,Chen Y,Pan L Y,et al.Study on bile excretions of scutellarein[J].Chin Pharm J,2006,31(20):1710-2.
[3] Chen X,Cui L,Duan X,et al.Pharmacokinetics and metabolism of the flavonoid scutellarin in humansafter a single oraladministration[J].Drug Metab Dispos,2006,34(8):1345-52.
[4] 居文政,许美娟,谈恒山.灯盏乙素药动学研究进展[J].中草药,2007,38(9):4-7.
[4] Ju W Z,Xu M J,Tan H S.The development of pharmacokinetic research on scutellarin[J].Chin Tradit Herb Drugs,2007,38(9):4-7.
[5] 李晨睿,牛银波,潘亚磊,等.黄芩药动学研究进展[J].中国药理学通报,2013,29(8):1048-53.
[5] LiC R,Niu Y B,Pan Y L,et al.Research progress of pharmacokinetics study on Radix Scutellariae[J].Chin Pharmacal Bull,2013,29(8):1048-53.
[6] Liu Y,Hu M.Absorption and metabolism of flavonoids in the Caco-2 cell culturemodel and a perfused rat in testinalmodel[J].Drug Met Dispos,2002,30(4):370-7.
[7] Chen DW,Zou Y S,Lia ng Y Z,etal.Studies on the absorption kinetics of rosiglitazonemaleate in rats intestine[J].Chin Pharm J,2002,37(6):4362-81.
[8] 陈秀杰,刘 磊,朱文良,等.木犀草素在大鼠体内的药动学研究[J].药物分析杂志,2009,29(9):1462-95.
[8] Chen X J,Liu L,Zhu W L,et al.Study on pharmacokinetics of luteolin in rats[J].Chin J Pharm Anal,2009,29(9):1462-95.
[9] 何秀琼,裴利霞,王一涛,等.高效液相色谱法研究大鼠灌胃黄芩素的药动学[J].中国医院药学杂志,2010,30(22):1901-5.
[9] He X Q,Pei LX,Wang Y T,etal.Study on pharmacokinetics of baicalein by HPLC-UV after intragastric administration in rats[J].Chin Hosp Pharm J,2010,30(22):1901-5.