基于氨基酸代谢的抗脑缺血益气解毒配伍中药协同作用研究
王军玲,杨 阳,高 健,方清影,李德凤,吴传鸿,黄志英,5,杨更亮,李韶菁
(1.河北大学药学院,河北 保定 071002;2.中国中医科学院中药研究所,北京 100700;3.中国中医科学院,北京 100700;4.安徽中医药大学药学院,安徽合肥 230031;5.中国药科大学药学院,江苏南京 211198)
缺血性脑中风是一类严重危害人类健康的疾病。作为目前临床的常见病、多发病,其发病机制复杂,缺乏有效的预防和治疗手段[1-3]。近年来,中药及其有效成分在脑缺血的预防和治疗方面因其独特的效果越来越受到人们的重视。中药主要是通过多靶点、多环节来发挥作用,且毒副作用相对较小,因此,寻找有效中药无疑是一条值得探索的路径,但中药整体起效、协同调节平衡的作用尚缺乏有效的研究方法和评价手段[4-5]。
中医理论认为脑髓失养、毒邪内生和毒伤脑髓,三者因果互济,共同构成了缺血性中风急性期脑髓损伤的病理基础[6],本研究所用益气解毒方来源于益气解毒治法的中医临床经验方,由人参、黄连、栀子3味中药组成。此3味配伍,可以在扶正的基础上,有效化解毒邪,起到很好的协同治疗作用。本课题组在原方基础上,采用3味中药中的主要活性组分,即人参总皂苷、盐酸小檗碱、栀子苷,按一定比例配伍成新的益气解毒方。经我们前期药理学研究发现,新的益气解毒方具有较好的抗脑缺血保护作用,可明显降低大鼠局灶性脑缺血后的脑梗死体积,改善局部脑血流量,减轻血脑屏障损伤导致的脑水肿,保护受损的线粒体的结构和功能[7]。近年来研究表明,氨基酸是脑缺血病理过程的主要参与者,其中兴奋性氨基酸是缺血时最早释放的氨基酸递质,主要包括谷氨酸(Glu)和天冬氨酸(Asp),脑缺血后血液及脑脊液中兴奋性氨基酸释放增多,易造成兴奋性氨基酸毒性。γ-氨基丁酸(GABA)和甘氨酸(Gly)为抑制性递质,可抑制神经元兴奋,减少由兴奋性氨基酸造成的神经细胞损伤。脑缺血损伤后,GABA浓度急剧升高,可减少由于Glu大量释放所造成的损伤[8-10]。N-乙酰天冬氨酸(NAA)被认为是神经元的标志物,其代谢紊乱时会导致氧化应激,引起神经退行性病变和生理畸变。脑缺血早期,NAA的下降主要反映了神经元功能活性下降[11]。同样,同型半胱氨酸(Hcy)、丙氨酸(Ala)、丝氨酸(Ser)、苯丙氨酸(Phe)在脑缺血疾病发生后均会发生不同程度的变化,影响中枢神经系统[12-14]。而酪氨酸(Tyr)、色氨酸(Trp)和甲硫氨酸(Met)作为体内发挥重要生理功能的氨基酸,目前在脑缺血中发挥的作用和功能尚不太清楚,仍需深入研究。总之,目前国内、外脑缺血病理研究仍多集中在兴奋性和抑制性氨基酸类神经递质上,而对其他氨基酸代谢产物如丝氨酸、苯丙氨酸、酪氨酸、色氨酸、甲硫氨酸等相对研究较少,因此,系统研究血清中的氨基酸含量整体变化可能对从生化通路的角度揭示脑缺血机制起到重要作用。
因此,本研究拟以该配伍中药为研究对象,采用代谢组学中常用的液质联用技术,采用已建立的一套与脑缺血相关的12种内源性氨基酸代谢物同时定量的方法[15],从整体角度分析脑中风急性期氨基酸代谢物水平变化,比较和评价益气解毒方中3种组分不同给药组合方式对氨基酸水平的调控作用,从一个新的角度探讨其抗脑缺血的综合起效和协同作用机制。
1 材料
1.1 实验动物 Sprague-Dawley(SD)大鼠,♂,体质量250~270 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001。置于温度25℃±2℃饲养室,动物均自由饮水进食。动物实验操作过程依照中国中医科学院动物实验伦理委员会的要求执行。
1.2 主要试剂与仪器 标准品:GABA、Gly、Ala、Ser、Glu、Asp、Hcy、Met、Tyr、NAA、Phe、Trp、氘代 -丙烯酰胺(D3-acrylamide,内标)(购于Sigma公司);水合氯醛(国药集团化学试剂有限公司);甲醇、乙腈为Fisher色谱纯,水为Milli-Q water system(Millipore,Bedford,MA,MSA)过滤后的纯水。羧甲基纤维素钠(国药集团化学试剂有限公司);人参总皂苷(Rg1+Re+Rd≥40.55% ±2.10%)(南京泽朗医药科技有限公司);盐酸小檗碱(纯度≥95.18%)(咸阳航空168生物工程有限公司);栀子苷(纯度≥99.68%)(宝鸡市方晟生物开发有限公司);安捷伦1200系列快速分离液相色谱(RRLC),安捷伦电喷雾三重四级杆质谱检测器(ESI-QQQ/MS),台式高速离心机(美国 Labnet公司);十万级天平(AUW220D,日本岛津公司);氮吹仪(Organomation N-EVAP,南京欧熙科贸有限公司)。
2 方法
2.1 实验分组与给药 160只大鼠随机分为16组,即假手术组(sham)、模型组(vehicle)、7组给药量为25 mg·kg-1不同组合的给药组、7组给药量为5 mg·kg-1不同组合的给药组。各给药组于手术麻醉前10 min灌胃给药,采用0.5%的羧甲基纤维素钠使混悬均匀。同时,假手术组和模型组则分别灌胃给予相应容积的溶剂。益气解毒方协同作用实验各组具体给药方案见Tab 1。

Tab 1 Synergistic experiment design of YQJD formula
2.2 大鼠局灶性脑缺血模型的制备 实验前禁食12 h,10%的水合氯醛溶液(3 ml·kg-1)腹腔注射麻醉动物。参照Longa等[16]建立的大鼠中动脉线栓改良法,通过对大鼠左侧大脑中动脉栓塞建立大鼠大脑中动脉栓塞模型(MCAO)。
2.3 神经行为学评分 将动物处死前进行神经行为学观察和打分,参照Bederson评分法进行5分制神经功能症状评分(0-4分)[17]。通常分数越高,则说明其神经行为损伤越严重。
2.4 大鼠血清标本采集、处理及氨基酸定量检测大鼠造模缺血12 h后,进行腹主动脉取血,迅速于4℃下,4 000 r·min-1离心 15 min,取离心后的上清液,于-80℃冷冻储存备用。
取50μl血清样品,加入10μl内标使用液(终浓度为 1 000μg·L-1D3-丙烯酰胺)和 200μl乙腈,涡旋混匀1 min,再加入240μl的初始流动相,涡旋混匀1min。然后,在4℃下,10 000 r·min-1离心5 min,取350μl上清液过滤膜进样。
氨基酸定量检测方法参见文献[15],在15 min内对已处理的每个血清样本中未衍生化的12种内源性氨基酸的含量同时进行检测,具体条件为:Diamonsil C18(250 mm×4.6 mm,5μm)色谱柱,乙腈-0.1%甲酸水梯度洗脱,流速为0.5 ml·min-1。离子源为ESI,正离子扫描模式,扫描方式为多反应检测。
2.5 数据分析 应用 SIMCA-P(version 12.0,Umertrics,Umea,Sweden)统计软件中有监督的偏最小二乘判别分析法(PLS-DA)进行数据分析,观察正常组与模型组之间的差异,挑选出具有明显聚类特征的氨基酸变量。对于PLS-DA模型,Q2>0.5,被认为是有效模型,并且通过各变量的VIP值进一步筛选,当变量的VIP值大于1.0时,则认为该变量对该模型有较大影响[18],所以,为了关注差异明显的变量,只选择了VIP大于1.0的氨基酸变量[19]。然后,使用SPSS 17.0统计软件对氨基酸结果进行单因素方差分析(One-Way ANOVA)和主成分分析(PCA),研究益气解毒方不同组合的协同作用。
3 结果
3.1 益气解毒方对神经功能的影响 与假手术组相比,模型组大鼠的神经行为学评分明显升高,差异具有显著性(P<0.01),说明造模成功。与模型组相比,益气解毒方各给药组均能降低脑缺血大鼠的神经行为学评分,其中ABC三组分给药组(5 mg·kg-1和25 mg·kg-1)和 AC两组分给药组(25 mg·kg-1)的神经行为学评分明显降低(P<0.05),能明显改善大鼠局灶性脑缺血后12 h的神经损伤症状,其中三组分共同给药改善效果最为明显。见Fig 1。
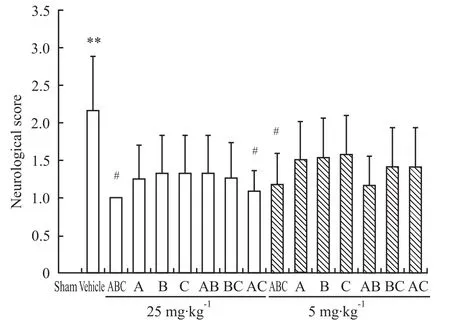
Fig 1 Effect of YQJD on neurological deficits induced by MCAO**P<0.01 vs sham group;#P<0.05 vs vehicle group
3.2 益气解毒方不同组分对血清中氨基酸水平的调控
3.2.1 PLS-DA分析益气解毒方各组分对氨基酸水平的影响 通过构建PLS-DA判别模型(Q2Y=0.727),对正常状态和病理状态下氨基酸水平进行分析。PLS-DA得分图(Fig 2)显示,正常组和模型组两组结果区分较好,说明在脑缺血损伤过程中12种氨基酸水平发生了明显变化。同时,筛选出模型组与假手术组中明显变化的5个氨基酸(VIP>1),即 Glu、Asp、Met、Hcy和 Phe。

Fig 2 PLS-DA score p lots derived from sham and vehicle group 12 h after MCAO by SIMCA-P12.0
3.2.2 One-Way ANOVA分析益气解毒方各组分对氨基酸水平的影响 RRLC-QQQ定量分析研究结果显示,缺血性脑损伤后,血清中12种氨基酸水平均发生变化,对不同组间大鼠血清中12种氨基酸的浓度分别进行单因素方差分析。首先,与假手术组相比,模型组大鼠的 Glu、Asp、Met、Hcy和 Phe 5种氨基酸水平都明显升高(P<0.01)。其次,与模型组相比,25 mg·kg-1ABC和5 mg·kg-1ABC三组分共同给药组大鼠中 Glu、Asp、Met、Hcy和 Phe 5种氨基酸的水平均明显降低(P<0.01,P<0.05),说明三组分共同给药对氨基酸水平有明显的调控作用,能明显改善脑缺血损伤后的异常氨基酸水平变化。同时,A单组分给药、C单组分给药及AC两组分共同给药较两个剂量下其他给药组均有明显变化,同时次序依次为AC两组分共同给药、A单组分给药及C单组分给药,说明A单组分给药、C单组分给药及AC两组分共同给药对氨基酸水平也有一定调控作用。见Fig 3。
3.2.3 PCA分析益气解毒方各组分对血清中氨基酸水平的影响 对两种不同给药量下(25 mg·kg-1和5 mg·kg-1)各给药组动物血清中氨基酸的浓度值分别进行主成分分析,结果将12种氨基酸指标降维为7个主成分(PC1~PC7),且前7个主成分的累积贡献度达到86%以上,满足累积贡献度大于85%的降维标准。见Fig 4。
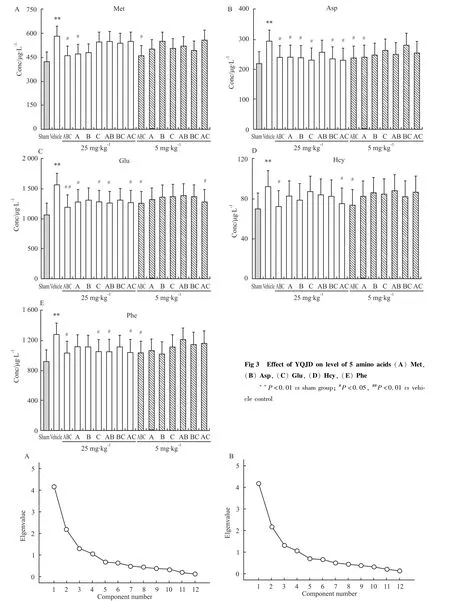
Fig 4 Scree plots at dosage of 5 mg·kg-1(A)and 25 mg·kg-1(B)
在给药量为25mg·kg-1各组中,PC1、PC3、PC4三个主成分中,ABC三组分协同给药组氨基酸水平最接近假手术组水平。说明ABC三组分共同给药在这三个主成分中贡献度较大。在给药量为5 mg·kg-1各组中,PC1~PC5及PC7六个主成分中对应的贡献度最大的给药组也是ABC组。而在给药量25 mg·kg-1的 PC2、PC6和给药量 25 mg·kg-1的PC6主成分中均显示AC两组分协同作用贡献度较大。由以上结果可见,两个剂量下三组分共同给药对病理状态下氨基酸水平的调控作用明显优于两组分和单组分给药的作用。见Fig 5。
4 讨论
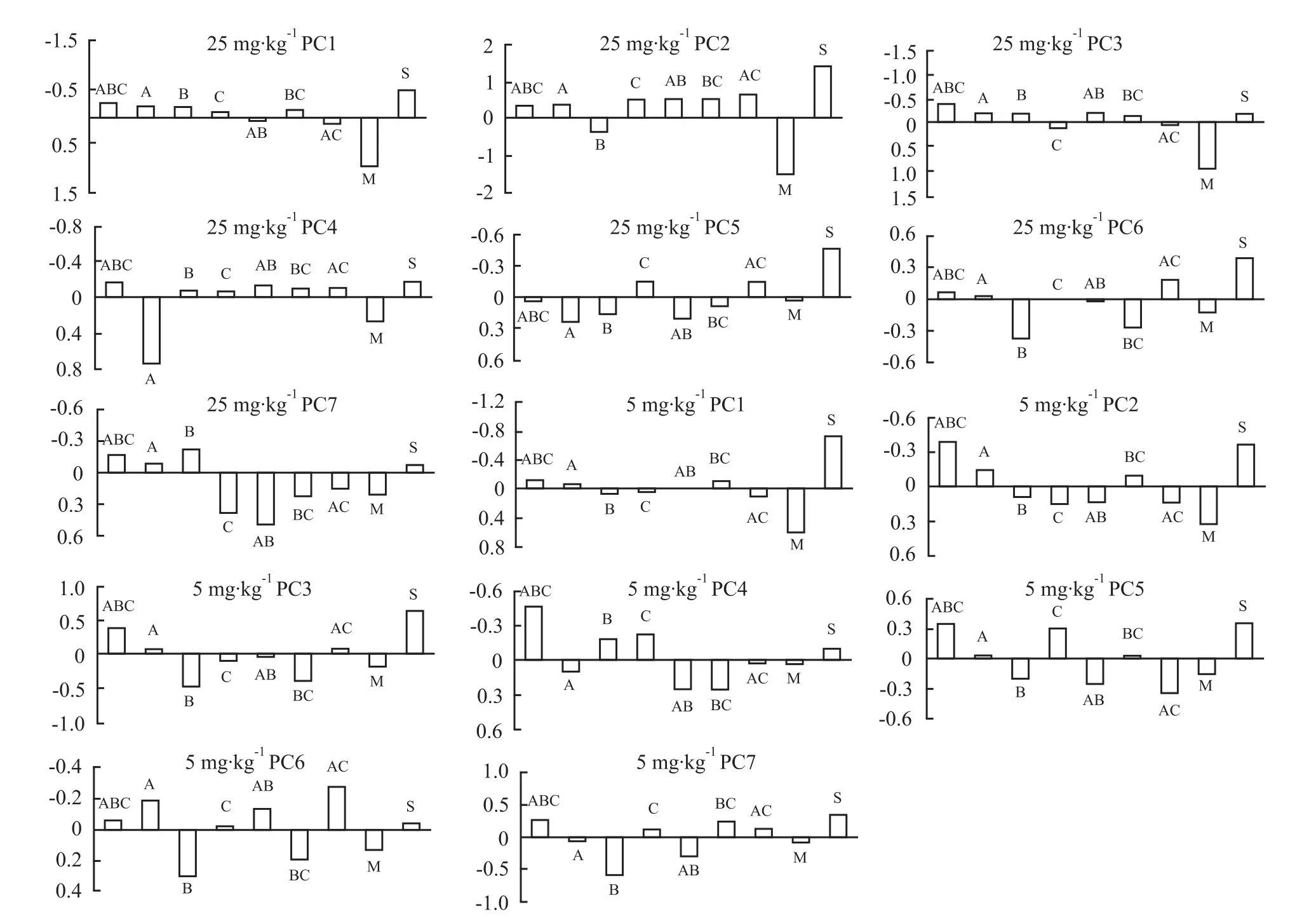
Fig 5 Association between values of each PCswith drugs combination(PCs at the dosage of 25 mg·kg-1 and 5 mg·kg-1)
随着系统生物学(system biology)、多向药理学(polypharmacology)和网络药理学(network pharmacology)等概念的提出,药理学研究已经进入到一个崭新的阶段。单一靶点的药物治疗模式已不能满足复杂疾病的治疗要求,开发多靶点、多途径、整合调节网络平衡的有效组合药物正逐渐成为现代药物研发的新趋势[20],这无疑为开发有效治疗中风的中药提供了良好的契机。中医药的系统、整体治疗理念在临床脑缺血治疗方面有着独特的优势,尤其开发针对其关键病机的中药有效组分组合作为中药配伍的新模式,很有可能成为未来新型脑中风治疗候选药物的有效来源。本研究抽提人参、黄连、栀子的主要药效成分人参总皂苷、黄连素、栀子苷进行组合,经本课题组前期研究证明其具有明显的抗急性脑缺血保护作用,且具有多靶点、多通路的作用特点。现代药理学研究也表明,该组方中人参总皂苷作为补益类药物人参中的主要活性组分,其作用广泛,在中枢神经、内分泌、免疫和心血管系统中均能发挥较好的药理作用[21-23],例如人参皂苷 Rg、Rd均能保护海马神经元免受脑缺血后谷氨酸诱导的兴奋性毒性损伤[24]。盐酸小檗碱作为中药黄连中的主要药效成分,最先作为抗胃肠道感染药物用于临床,但近年发现其在治疗心血管疾病、中风、糖尿病、高血脂和慢性炎症方面也均见诸多报道[25],具有良好的药用前景。同时,其作为解毒良品,在缺血/再灌注损伤中能够清除多种氧自由基,具有抗氧化的保护作用[26]。作为经典清热解毒中药复方中常用中药栀子的主要药效成分,栀子苷能有效减少神经元坏死,抑制炎性和兴奋性毒性产生,通过“解毒”也可发挥良好的抗脑缺血作用,且其抗炎作用机制可能与栀子苷能减少脑组织IL-1β、IL-6、TNF-α的含量,减轻白细胞与血管内皮细胞间的黏附作用,从而抑制炎症的发生与发展[27-29]。
代谢组学是一种全面、系统、终点式的研究方法,旨在通过测定机体中代谢物的变化来反映体内代谢物在病理状态及药物干预下的变化规律[30]。借助网络药理学研究手段,对脑缺血的代谢组学开展研究,有助于从新的角度对脑缺血损伤的分子机制进行深入研究,同时也可为抗中风中药新药研发提供新方法。本研究通过已建立的液质联用RRLCQQQ方法对血清样品中12种内源性氨基酸同时定量检测,对益气解毒方不同给药组合干预脑缺血过程中氨基酸代谢水平调控作用进行了系统研究,并采用逐层递进的分析方法揭示了其协同作用。首先,通过 PLS-DA判别分析挑选出 Glu、Asp、Met、Hcy和Phe 5个氨基酸可作为脑缺血的关键内源性标记物。然后,通过One-Way ANOVA及PCA对血浆中氨基酸水平的比较和综合分析,证明了三组分组合协同作用最强,可明显改善脑缺血后内源性氨基酸的代谢水平异常,其次分别是人参总皂苷和栀子苷的两组分协同作用、人参总皂苷单组分作用、盐酸小檗碱单组分作用,而3个组分中人参总皂苷可能较栀子苷、盐酸小檗碱来说发挥着更重要的作用。神经行为学评分结果与PCA结果基本一致,佐证了益气解毒方的协同作用,证明该方中每个组分均发挥着重要作用,三组分缺一不可。
中药研究是一项复杂的系统工程,缺乏系统的方法阐释其科学内涵是制约其发展的瓶颈问题。本文首次从氨基酸代谢的角度证明益气解毒方治疗脑缺血各组分的协同作用,是一次从整体的角度阐述中药协同作用的有意义的尝试。这也为治疗复杂性疾病的中药多组分协同作用和整体调节的机制研究提供了新思路。
参考文献:
[1] 陈剑梅,郭洁文,潘竞锵.中药治疗缺血性中风的药理研究进展[J].今日药学,2011,21(03):138-41.
[1] Chen JM,Guo JW,Pan JQ.Pharmacological study progress of traditional chinesemedicine for treatment of ischemic stroke[J].Pharmacy Today,2011,21(03):138-41
[2] Manolescu B N,Oprea E,Farcasanu I C,et al.Homocysteine and vitamin therapy in stroke prevention and treatment:a review[J].Acta Biochimica Polonica,2010,57(4):467-77.
[3] 宋修云,胡金凤,陈乃宏.神经细胞凋亡与脑缺血疾病[J].中国药理学通报,2012,28(3):307-10.
[3] Song X Y,Hu JF,Chen N H.Neurons apoptosis and cerebral ischemia[J].Chin Pharmacol Bull,2012,28(3):307-10.
[4] Shi Z S,Loh Y,Walker G,etal.Endovascular thrombectomy for acute ischemic stroke in failed intravenous tissue plasminogen activator versus non-intravenous tissue plasminogen activator patients:revascularization and outcomes stratified by the site of arterial occlusions[J].Stroke,2010,41(6):1185-92.
[5] 刘树玲,刘梅芳,朱宝亮.中草药成分抗缺血性脑卒中药理作用的研究进展[J].医学综述,2009,15(22):3478-80.
[5] Liu S L,Liu M F,Zhu B L.Study progress on Chinese herbal medicine componentswith activity against ischemic stroke[J].Med Recap,2009,15(22):3478-80.
[6] 张根明.对缺血性中风急性期病机的再认识[J].北京中医药大学学报:中医临床版,2010,17(3):37-9.
[6] Zhang GM.The recognition of the pathogenesis of the acute ischemic stroke[J].J Beijing Univ Tradit Chin Med(Clin Med),2010,17(3):37-9.
[7] LiSJ,Wu CH,Chen JX,etal.An effective solution to discover synergistic drugs for anti-cerebral ischemia from traditional Chinese medicinal formulae[J].PlosOne,2013,8(11):e78902.
[8] Bie X,Chen Y,Han J,etal.Effects of gastrodin on amino acids after cerebral ischemia-reperfusion injury in rat striatum[J].Asia Pac JClin Nutr,2007,16(Sl):305-8.
[9] Matsumoto K,Lo E H,Pierce A R,et al.Secondary elevation of extracellular neurotransmitter amino acids in the reperfusion phase following focal cerebral ischemia[J].J Cereb Blood Flow Met,1996,16(1):114-24.
[10]Skvortsova V I,Raevskii K S,Kovalenko A V,et al.Levels of neurotransmitter amino acids in the cerebrospinal fIuid of patients with acute ischemic insult[J].Neutosci Behav Physiol,2000,30(5):491-5.
[11]Jantzie L L,Cheung PY,Johnson ST,etal.Cerebralamino acid profiles after hypoxia-reoxygenation and N-acetylcysteine treatment in the newborn piglet[J].Neonatology,2010,97(3):195-203.
[12]陆 敏,姜建东,袁存国,等.缺血性脑卒中患者血浆同型半肤氨酸水平变化的临床意义[J].卒中与神经疾病,2008,15(4):213-4.
[12]Lu M,Jiang JD,Yuan CG,et,al.Th value of plasma homocysteinemia concentration in recurrent ischemic stroke[J].Stroke Nerv Dis,2008,15(4):213-4.
[13]李 桦,李 超,闫智颖.微透析-毛细管电泳监测实验大鼠脑缺血时 D型 -丝氨酸的变化[J].分析化学,2009,37(A03):F054
[13]Li Y,LiC,Yan Z Y.Monitoring the change of D-serine in the ischemia rats by microdialysis-capillary electrophoresis experiment[J].Chin JAnalytical Chem,2009,37(A03):F054.
[14]Kagiyama T,Glushakov A V,Sumners C,et al.Neuroprotective action of halogenated derivatives of L-phenylalanine[J].Stroke,2004,35(5):1192-6.
[15]Gao J,Yang H J,Chen JX,et al.Analysis of serum metabolites for the discovery of amino acid biomarkers and the effect of galangin on cerebral ischemia[J].Mol Syst Bio,2013,9(9):2311-21.
[16]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[17]Huang Z,Huang P L,Panahian N,et al.Effects of cerebral ischemia inmice deficient in neuronal nitric oxide synthase[J].Science,1994,265(5180):1883-5.
[18]Smith CA,Want E J,O′Maille G,etal.XCMS:processingmass spectrometry data for metabolite profiling using nonlinear peak alignment,matching,and identification[J].Anal Chem,2006,78(3):779-87.
[19]Werner E,Croixmarie V,Umbdenstock T,etal.Mass spectrometry-based metabolomics:accelerating the characterization of discriminating signals by combining statistical correlations and ultra-high resolution[J].Anal Chem,2008,80(13):4918-32.
[20]陈 畅,马 兴,臧 琛,等.组合药物——现代药物研发的新趋势[J].中国实验方剂学杂志,2012,18(14):310-2.
[20]Chen C,Ma X,Zang C,et,al.Combinational drug-an new trend of the development of modern drugs[J].Chin J Exp Tradit Med Formul,2012,18(14):310-2.
[21]Gillis C N.Panax ginseng pharmacology:a nitric oxide link[J]?Biochem Pharmacol,1997,54(1):1-8.
[22]Attele A S,Wu JA,Yuan C S.Ginseng pharmacology:multiple constituents and multiple actions[J].Biochem Pharmacol,1999,58(11):1685-93.
[23]LüJM,Yao Q Z,Chen C.Ginseng compounds:an update on theirmolecular mechanisms and medical applications[J].Curr Vasc Pharmacol,2009,7(3):293-302.
[24]Wu X B,Jiang R,Zhang M Q,etal.Network-based global inference of human disease genes[J].Mol Syst Biol,2008,4(1):189.
[25]Nibbe R K,Koyutuk M,Chance M R.An integrative-omics approach to identify functional sub-networks in human colorectal cancer[J].PLoSComput Biol,2010,6(1):e1000639.
[26]李东海,秦 刚,徐苏洋,陈永强.黄连及其活性成分对缺血一再灌注损伤保护机制[J].国际骨科学杂志,2011,32(5):321-3.
[26]Li D H,Qin G,Xu SY,Chen Y Q.The protectivemechanism of berberine and itsactive ingredientagainst ischemia-reperfusion iniury[J].Int JOrthop,2011,32(5):321-3.
[27]Nicholson JK,Lindon JC,Holmes E.“Metabonomics”:understanding themetabolic responses of living systems to pathophysiological stimuliviamultivariate statistical analysisof biological NMR spectroscopic data[J].Xenobiotica,1999,29(11):1181-9.
[28]李 敏,王 斌,唐志书,等.黄芩苷、栀子苷对大鼠脑缺血保护作用的机制[J].中药药理与临床,2012,28(3):34-6.
[28]LiM,Wang B,Tang ZS,etal.The protectivemechanism ofberberine and jasminoidin in ischemia rats[J].Pharmacol Clin Chin Mat Med,2012,28(3):34-6.
[29]郭曙军,赵志英.栀子苷的药理作用及其作用机制研究进展[J].包头医学院学报,2013,29(2):111-3.
[29]Guo S J,Zhao Z Y.The research development of jasminoidin’s pharmacological effects and its mechanism[J].J Baotou Med Coll,2013,29(2):111-3.
[30]高 健,杨更亮,杨洪军,李韶菁.代谢指纹图谱分析技术及数据处理方法研究进展[J].中国中药杂志,2012,37(17):2519-23.
[30]Gao J,Yang G L,Yang H J,Li S J.Advance of studies on metabolic fingerprinting analytical techniquesand data processingmethods[J].China JChin MatMed,2012,37(17):2519-23.