大胡蜂肥大细胞脱粒肽对血管生成的抑制作用
刘文君,徐学清
(南方医科大学药学院,广东,广州 510515)
在过去的几十年里,蜂毒因为含有许多药理活性物质而引起了人们的密切关注,这些对于大胡蜂防御天敌和捕食等生存活动所必须的药理活性分子包括:多肽类,如,趋化肽、肥大细胞脱粒肽[1-2];酶类,如,磷脂酶 A2、透明质酸酶、酸(碱)磷酸酶[3];有机小分子,如,组胺、胆碱、甘油、氨基酸等。众多活性分子使蜂毒具有抗炎、镇痛、抗病毒和抗肿瘤等多种药理活性,在临床上可被应用于治疗肿瘤、风湿和肩周炎等多种疾病。
血管生长与抗肿瘤有密切联系,很多具有血管生长抑制活性的物质同时具有抗肿瘤活性。宋长城等[4]报道蜂毒有抑制血管生成作用,且推断蜂毒抑制肝癌血管生成可能是其抗肿瘤作用的重要机制之一。
在过去的研究中,我们从大胡蜂毒中分离纯化得到一组肥大细胞脱粒肽[2],尽管肥大细胞脱粒肽有数种生物活性,如磷脂酶A2、磷脂酶C、G蛋白和鸟苷酸环化酶活化,细胞脱颗粒和抗菌等活性[2,5-6],但是发现其具有血管生长抑制活性尚属于首次,现将结果报道如下:
1 材料与方法
1.1 材料 实验用受精鸡胚(10 d龄)购自华南农业大学;Wistar大鼠:南方医科大学实验动物中心;大胡蜂肥大细胞脱粒肽12a(INWKGIAAMAKKLL):本实验室合成;扶济复(重组人碱性成纤维细胞生长因子,rh-bFGF),北京双鹭药业股份有限公司,批号:20041212;0.1% 新洁尔灭:上海经纬化工有限公司;定性滤纸:英国Whatman公司产品,批号:002090;带数码相机显微镜:德国 Leica公司;RPMI 1640培养基、胰酶、小牛血清均来自Gibco公司;BD BioCoatTM血管生长板购自 BD Biosciences;MTT检测试剂盒来自建成生物工程研究所;其他试剂:国产分析纯。
1.2 方法
1.2.1 鸡胚绒毛尿囊膜(CAM)实验
1.2.1.1 供试品载体的制备 将过滤除菌的12a和rh-bFGF溶液分别或一起均匀涂布于直径为5 mm的无菌Whatman滤纸上,使实验组纸片除含有rh-bFGF 0.2μg外,还分别含有0.1或1μg的12a,阳性对照组上含有rh-bFGF 0.2μg,阴性对照含有蒸馏水,所有纸片均自然风干。
1.2.1.2 药物处理 10日龄鸡胚随机分组,每组10只,在照卵灯下观测,然后在距胚头前1 cm、两条卵黄静脉之间的卵壳投影部位,用铅笔画出相对无血管区。用0.1%新洁尔灭擦拭鸡胚蛋壳,在鸡胚气室处钻一小孔,负压吸引,使窗口处形成人工气室。在已标记无血管处的蛋壳表面钻孔,轻轻去除蛋壳及壳膜,暴露CAM。用镊子夹取待试药物滤纸片放在CAM上(加药面向下),医用胶布密封窗口,放入孵育箱37℃继续孵化2 d,揭开封口胶布,按照朱国福等[7]的方法对CAM进行处理和结果判断。10个经12a纸片处理的CAM血管生成抑制率=[(+)+(++)]/10。
1.2.2 人脐静脉内皮细胞(HUVEC)增殖和血管形成实验 根据MatrigelTM基质用户手册准备BD Bio-CoatTM血管生长板。在96孔板上,HUVEC用含10%胎牛血清的RPMI 1640培养基培养到70%~80%满,胰酶消化后,50μl 4×108细胞·L-1细胞悬液接种到包被了Matrigel基质的培养板上,在含5%CO2的培养箱内37℃培养16~18 h。用MTT法测量12a对HUVEC生长的抑制情况,血管生成实验板用带数码相机的显微镜观察并拍照。用MetaMorph软件系统测量血管点面积,长度和分枝点计算血管形成[8]。结果统计时,没有12a而只有PBS和rh-bFGF的孔看做100%,所有实验浓度至少做4个重复。
1.2.3 统计学分析 采用Excel软件分析,数据用表示,组间比较用t检验。
2 结果
2.1 大胡蜂肥大细胞脱粒肽12a抑制CAM生成
结果如Fig 1所示,蒸馏水组CAM血管生长良好,颜色鲜红,血管分支适中,网络清晰,呈叶脉样放射状生长;rh-bFGF对照组血管生长更旺盛,密度明显增大,管径粗且分支多;12a处理组则大范围血管明显褪色,血管密度减少,结构模糊,分支多处断开。并且随浓度加大,毛细血管数目较对照组明显减少,颜色更浅、更苍白,载体放置的中间部位和周边几乎都无血管生成。对各组的统计分析表明:0.1μg和1μg 12a对CAM生成的抑制率分别为60.2%和90.3%。显然,大胡蜂肥大细胞脱粒肽12a能明显抑制新生血管生成。
2.2 大胡蜂肥大细胞脱粒肽12a抑制HUVEC增殖和血管形成 在 Fig 2,1 mg·L-1和10 mg·L-1的12a能明显抑制HUVEC的体外增殖(P<0.01),其IC50接近1mg·L-1。和CAM血管生成抑制试验以及HUVEC的体外增殖结果相一致,12a能明显抑制HUVEC在96孔板上形成血管环,与对照组相比,在1 mg·L-1时内皮细胞簇集和血管形成明显降低,在10 mg·L-1时内皮细胞血管环形成几乎完全消失。因此,大胡蜂肥大细胞脱粒肽12a能明显抑制血管生成。
3 讨论
癌细胞的迁移和生长都依赖新生血管的生成[9]。因此,抗血管生成因子很有可能被研发成优良的抗肿瘤药物。血管生成的体内实验模型包括CAM法、卵黄囊膜法、鼠皮下气囊法、微血管密度法、大鼠肠系膜窗血管生成法、动物角膜或虹膜内移植等。CAM血管生成模型因为实验材料易得、操作简便、实验周期短等优点而成为国内外该类研究的最常用方法。但是CAM血管生成模型也存在一些缺陷,如,存在个体差异,加入载体后可能出现非特异性炎症和结果很难精确测量等。我们在研究中对来自同一批,相同孵化条件下的多个鸡胚进行重复试验来减少实验误差。处理48 h后,对照组的CAM血管网络清晰可见,生长良好。而12a处理组则大范围血管明显褪色,密度减少,结构模清晰,分支多处断开。并且随浓度加大抑制现象更明显。这些数据表明12a对体内血管生成有较好的抑制作用。
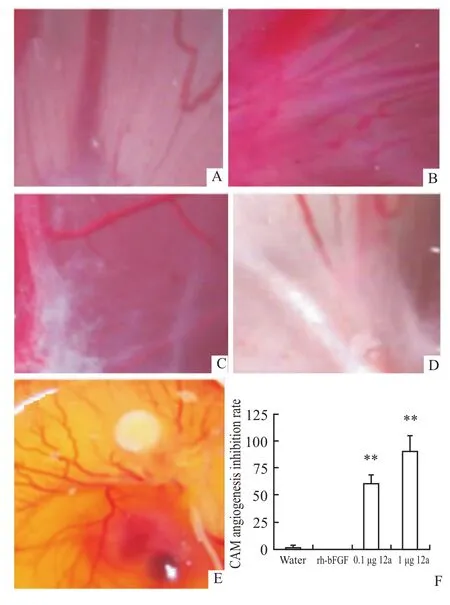
Fig 1 Anti-angiogenic effects ofmastoparan-like peptide12a from wasp(Vespa magnifica)venom in CAM sFertilized chick embryoswere incubated under conditions of constant humidity at37℃.On the tenth day,a square window was open in the egg shell and CAMswere treated with(A)water,(B)0.2μg rh-bFGF,(C)0.1μg12a+0.2μg rh-bFGF,(D,E)1μg12a+0.2μg rh-bFGF.(F)Statistical analysis of the above treatment.CAMswere examined on day 12.**P<0.01 vs0.2μg rh-bFGF

Fig 2 Effect of 12a on HUVEC proliferation and angiogenesis(A)Statistical analysis of proliferation and angiogenesis of HUVEC treated by 0,1,10 mg·L-1 12a;(B)Tube formation of HUVEC treated by 0,1,10 mg·L-1 12a,**P<0.01 vs control
肥大细胞脱粒肽是蜂毒中重要组分,具有多种生物活性,其活化肥大细胞后导致肥大细胞释放颗粒包含物组胺、5-羟色胺、白三烯、肝素、前列腺素、嗜酸性粒细胞趋化因子等[5-6],肥大细胞及其颗粒包含物能加速CAM的正常血管生成[10-12]。因此,我们的试验结果似乎与其相矛盾。但是肥大细胞在鸡胚发育10.5 d后才在CAM上出现和在17.5~20 d后才达到丰盛[13],并且15 d龄的鸡胚的肥大细胞才对外界有免疫力,即能分泌颗粒物质[14]。因此,在我们的实验系统中的CAM肥大细胞没有活力,大胡蜂肥大细胞脱粒肽12a对CAM血管生长的抑制作用可能与其脱粒肽活性不相关联。在我们过去的研究中12a仅有微弱的溶血活性[2],因此,12a在目前的实验浓度下抑制内皮细胞增殖不是由于其毒性作用所致。Ribatti等[11]认为CAM内主要的促进血管生长因子是纤维原细胞生长因子和血管内皮细胞因子。在实验中,当我们在实验组中不加入rh-bFGF,12a对CAM血管生长的抑制作用不是很明显。并且12a对内皮细胞的增殖的抑制能力不如其对血管环的形成。因此,我们推测大胡蜂肥大细胞脱粒肽12a可能是通过作用于FGF相关的信号通路抑制内皮细胞增殖。另外,外源性能神经节苷脂GM1能结合FGF-2影响血管生成,但是mastoparan能抑制这种结合[15]。
因此,大胡蜂肥大细胞脱粒肽12a具有明显的血管生成抑制活性,其作用机制尚不清楚,它能否与VEGF、FGF和内皮抑素等血管生成相关的生长因子发生作用有待进一步探讨。但该发现对肥大细胞脱粒肽12a的开发应用有重要意义。因为以前的研究已经表明大胡蜂肥大细胞脱粒肽12a毒副作用小,安全性好,易于合成和能特异性结合G蛋白受体等,若能将其开发为抗血管生成药物将有着广阔的应用前景。
参考文献:
[1] Xu X,Yang H,Yu H,etal.Themastoparanogen from wasp[J].Peptides,2006,27(12):3053-7.
[2] Xu X,Li J,Lu Q,et al.Two families of antimicrobial peptides from wasp(Vespa magnifica)venom[J].Toxicon,2006,47(2):249-53.
[3] Yang H,Xu X,Ma D,et al.A phospholipase A1 platelet activator from the wasp venom of Vespa magnifica(Smith)[J].Toxicon,2008,51(2):289-96.
[4] 宋长城,吕 祥,程彬彬,等.蜂毒素对人肝癌BEL-7402细胞裸鼠皮下移植瘤生长及肿瘤血管生成的影响[J].癌症,2007,26(12):1315-22.
[4] Song C C,LüX,Cheng B B,et al.Effects ofmelittin on growth and angiogenesis of human hepatocelluar carcinoma Bel-7402 cell xenografts in nude mice[J].Chin J Cancer,2007,26(12):1315-22.
[5] Song D L,Chang G D,Ho C L,Chang C H.Structural requirements of mastoparan for activation of membrane-bound guanylate cyclase[J].Eur JPharmacol,1993,247(3):283-8.
[6] Todokoro Y,Yumen I,Fukushima K,et al.Structure of tightly membrane-bound mastoparan-X,a G-protein-activating peptide,determined by solid-state NMR[J].Biophys J,2006,91(4):1368-79.
[7] 朱国福,张慧卿,侯爱君,等.雷公藤化合物对鸡胚绒毛尿囊膜血管生成的影响[J].中西医结合学报,2007,5(5):517-20.
[7] Zhu G F,Zhang H Q,Hou A J,etal.Effectsof three compounds extracted from Tripterygium wilfordiiHook on angiogenesis in chick chorioallantoic membrane[J].J Chin Integr Med,2007,5(5):517-20.
[8] Dasgupta P,Sun J,Wang S,etal.Disruption of the Rb-Raf-1 interaction inhibits tumor growth and angiogenesis[J].Mol Cell Biol,2004,24(21):9527-41.
[9] Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl JMed,1971,285(21):1182-6.
[10]Rizzo V,DeFouw D O.Mast cell activation accelerates the normal rate of angiogenesis in the chick chorioallantoic membrane[J].Microvasc Res,1996,52(3):245-57.
[11]Ribatti D,Crivellato E,Candussio L,et al.Mast cells and their secretory granules are angiogenic in the chick embryo chorioallantoic membrane[J].Clin Exp Allergy,2001,31(4):602-8.
[12]Ribatti D,Crivellato E,Candussio L,etal.Angiogenic activity of ratmast cells in the chick embryo chorioallantoic membrane is down-regulated by treatmentwith recombinant human alpha-2a interferon and partly mediated by fibroblast growth factor-2[J].Haematologica,2002,87(5):465-71.
[13]Andrew A,Rawdon B B.The embryonic origin of connective tissuemast cells[J].JAnat,1987,150:219-27.
[14]Solomon J B.Actively acquired transplantation immunity in the chick embryo[J].Nature,1963,198:1171-3.
[15]RusnatiM,Tanghetti E,Urbinati C,et al.Interaction of fibroblast growth factor-2(FGF-2)with free gangliosides:biochemical characterization and biological consequences in endothelial cell cultures[J].Mol Biol Cell,1999,10(2):313-27.