水杨酸钠对大鼠海马神经元电压门控性钙离子通道的影响
朱小丽,刘砚星,种宝贵,马红芳,江 平,张晓燕
(1.河北医科大学药理学教研室,河北省新药药理毒理研究重点实验室,河北石家庄 050017;2.河北省哈励逊国际和平医院,河北衡水 053000)
耳鸣是一种常见的听觉系统疾病,其特点是在无外部相应声源的情况下耳内出现的幽灵般的铃音或蜂鸣声,是一种主观的声音感觉[1]。大量研究显示水杨酸钠会导致耳鸣[2-4],因此水杨酸钠成为研究耳鸣发生机制的重要工具药。Liu等[5]通过观察水杨酸钠对颞皮层上延迟整流钾离子通道的影响,证实了耳鸣与听觉中枢有关。耳鸣通常伴随失眠、厌烦等不良情绪,许多临床医生已经注意到了耳鸣和情绪状态之间的联系[6]。影像学研究已证实,耳鸣和抑郁症之间存在激活的神经回路,噪音创伤后耳鸣的动物模型和抑郁症的动物模型都伴有海马神经元的损伤[7]。实际上认知行为疗法对某些耳鸣患者是有效的[8]。这些耳鸣和情绪反应之间的联系使一些学者提出边缘系统参与耳鸣不良情绪的形成这一观点[9]。Mirz等[10]利用 PET技术对 8名耳鸣患者和8名健康志愿者进行对比,发现患者的右前额叶、右颞叶脑区的脑血流量明显增加,同时左半脑区的边缘系统的杏仁核部位的脑血流量也有所增加。同时,Mirz等[11]还对12名健康志愿者进行研究,利用噪音来模拟耳鸣的心理声学特征及其对患者造成的情感反应,再利用PET检测大脑局部血流分布的改变。该研究发现这些声音刺激引起初级听皮层、次级听皮层、背外侧额叶以及与情感相关的边缘系统脑血流的增加,证明边缘系统可能与耳鸣的感知和情绪产生有关。Lockwood等[12]应用PET研究大脑的代谢活动,通过观察大脑对去氧葡萄糖的摄取情况,发现耳鸣患者不仅Brodmann41区域(即原始听区域)的代谢活动增强,边缘系统也出现异常的代谢活动,听觉系统和边缘系统间存在着异常构成联系,耳鸣与颞横回、颞上回、颞下回及海马等脑区的活动有关。同时,他还用15O标记的H215O作为示踪剂,通过PET观察了4例均能通过口面随意运 动 (performing voluntary oral facial movements,OFM)改变耳鸣响度的耳鸣患者,在其静息状态、口面活动期间及给予声音信号时的脑血流变化,发现耳鸣响度增加时对侧听皮层脑血流增加,而且声音信号在耳鸣患者脑内引起脑活动的区域比正常人更广泛,它包括初级听皮层、岛叶、海马、边缘系统、丘脑等,同时还观察到听觉系统与海马存在着异常联系,为边缘系统参加耳鸣感觉形成的推论提供了依据[12]。有研究显示兴奋性神经递质谷氨酸[12]和抑制性神经递质γ-氨基丁酸[13]与耳鸣的形成关系密切,而电压门控性钙通道(voltage-gated calcium channels,VGCC)与神经递质释放及激素分泌密切相关[11]。所以,本研究利用脑片膜片钳技术,观察水杨酸钠对大鼠海马神经元电压门控性钙离子通道电生理学特性的影响。
1 材料与方法
1.1 脑片制备 选用健康14 d龄的SD大鼠,快速断头,掀开颅骨,完全断开脑神经,完整剥离出全脑,使脑组织在0~4℃预先氧饱和(95%O2+5%CO2)的人工脑脊液(artificial cerebrospinal fluid,ACSF)中冷却。按冠状切面修整剥离出的全脑,用滤纸吸干表面的ACSF,用氰丙烯酸盐胶垂直粘在切片机上已事先固定好的琼脂制标本托上。将标本槽快速充满0~4℃预先氧饱和(95%O2+5%CO2)的ACSF,使全脑浸埋其中,并持续通气。将其用振动切片机切成300μm厚的脑片,然后将脑片移至孵育槽内,持续通气,在温度为(30~32)℃下,孵育1 h。
ACSF:NaCl 119, MgCl21.3, KCl 5.4,NaH2PO4·2H2O 1,NaHCO326.2,D-Glucose 11,CaCl22.5,浓度单位为 mmol·L-1,pH值调节至7.35~7.40,并用0.22μm孔径的微孔滤膜滤过。
1.2 全细胞膜片钳记录 将孵育好的脑片置于灌流槽中,浸没于液面下约3~4 mm。用盖网固定法固定脑片,用氧饱和的标准细胞外液进行持续灌流,流速约为3 ml·min-1。利用红外微分干涉相差显微镜,通过图像采集软件成像于计算机监视器屏幕上,观察并选择状态良好的海马神经元进行实验。将硬质有芯玻璃毛坯管拉制成电阻为4~6Ω的玻璃微电极,从微电极尾部充灌电极内液,然后通过微电极操纵器引导电极到达记录部位,到达记录部位后释放正压、给予负压,形成高阻抗(>1 GΩ)封接,再继续施以负压吸破细胞膜,形成全细胞记录模式。
ICa的标准细胞外液:TEA 140,CsCl 5,HEPES 10,D-Glucose 11,BaCl25,MgCl21,TTX 0.01.浓度单位均为mmol·L-1,将pH值调至7.35,并用孔径为0.22μm的微孔滤膜滤过。
ICa的电极内液:CsCl 110,HEPES 10,EGTA 10,TEA 30,Mg-ATP 5,Na-GTP 0.3,浓度单位均为mmol·L-1,将pH值调至7.2,并用孔径为0.22 μm的微孔滤膜滤过。
1.3 给药方式 以标准细胞外液为溶媒,配制不同浓度的水杨酸钠溶液。采取灌流方式给药。
1.4 数据处理和统计分析 采用EPC-10软件(HECK公司)收集所有的实验数据,采用Origin 7.5软件分析数据。实验数据用¯x±s表示。采用配对t检验进行两组数据间的比较。
2 结果
2.1 水杨酸钠对海马神经元钙电流的抑制作用钳制电压-50 mV,给以10 mV持续200 ms的去极化脉冲得到的电流即ICa。采用灌流法给予不同浓度(分别为 0.1、0.3、1、3、10 mmol·L-1)的水杨酸钠,观察水杨酸钠对ICa的影响。以水杨酸钠作用的效应率为纵坐标,水杨酸钠的浓度为横坐标作图,得到浓度 -效应关系曲线(Fig 1)。加入0.1、0.3、1、3、10 mmol·L-1的水杨酸钠后,ICa幅度分别减小为加药前的(94.56±1.07)%、(84.48±1.02)%、(63.39±1.37)%、(40.47±3.57)%、(23.42 ±3.90)%。按照Hill方程对浓度-效应关系进行拟合。拟合后的浓度-效应曲线的半抑制浓度IC50为1.64 mmol·L-1,Hill系数h为0.22。实验结果表明,水杨酸钠对ICa有抑制作用,而且这种抑制作用具有剂量/浓度依赖性。本实验的水杨酸钠的实验浓度选为1 mmol·L-1。
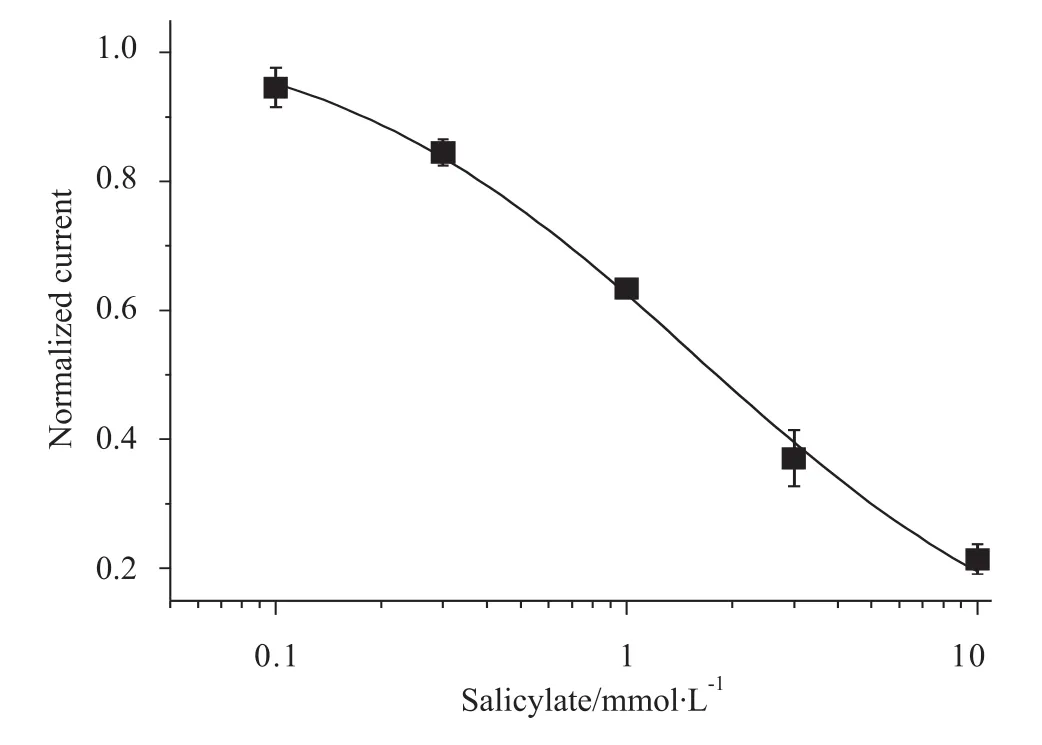
Fig 1 Dose response inhibition of sodium salicylate on I Ca
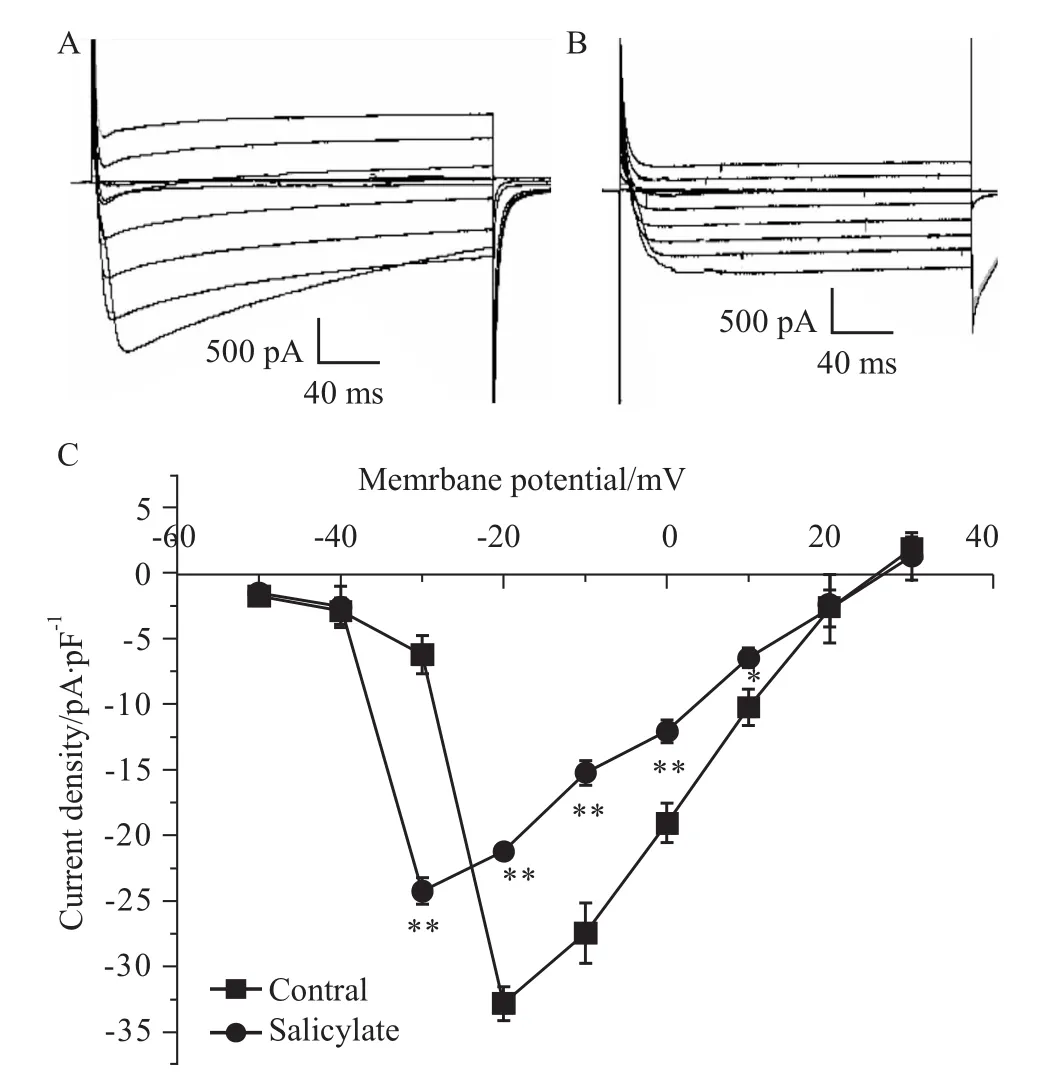
Fig 2 Effect of 1mmol·L-1 salicylate on the I-V relationship of peak I CaA:Original current traces of control I Ca;B:Original current traces of I Ca after 1 mmol·L-1 salicylate application;C:Peak I-V curves for control and 1 mmol·L-1 salicylate.*P<0.05,**P<0.01 vs control.

Fig 3 Effect of 1 mmol·L-1 salicylate on the steady-state activation curve of I Ca
钳制电压-50 mV,给以 -50~+40 mV持续200 ms,阶跃为10mV的一系列去极化测试脉冲,刺激频率为0.1 Hz,可以记录到一系列ICa。
以电流的峰值/膜电容(pA/pF)为纵坐标,以相对应的电压为横坐标作图,即得到ICa的电流密度-电压曲线。Fig 2A和 Fig 2B分别显示给药前和给药后的原始电流图。Fig 2C显示1 mmol·L-1水杨酸钠使ICa的幅度减小,对其有抑制作用。而且,加药前,ICa在-50 mV左右开始激活,在-30 mV到达到峰值,然后逐渐减小,到+25 mV翻转成外向电流。给药后,ICa也是在-50 mV左右开始激活,在-40 mV左右达到峰值,然后逐渐减小,到+25 mV翻转成外向电流。从实验数据得到1 mmol·L-1水杨酸钠使ICa的I-V曲线的峰值电压向超级化方向移动10 mV,但是不改变其翻转电位。
2.2 水杨酸钠对海马神经元钙电流的稳态激活曲线的影响 钳制电压-50 mV,给以-50~-10 mV,持续200 ms,阶跃为10 mV的一系列去极化脉冲,刺激频率为0.1 Hz。将每次电流的峰值转化为电导值,以归一化的电导值为纵坐标,相对应的膜电位为横坐标,作图。用最小二乘法,按照Boltzmann方程进行曲线拟合。得到稳态激活曲线(Fig 3)。在加药前半激活电压V1/2为(-23.52±0.50)mV,斜率k为(2.43±0.29)。给药后半激活电压V1/2为(-32.19±1.45)mV(P<0.05,n=8),斜率k为(2.30±1.31)(P>0.05,n=8)。实验结果表明,1 mmol·L-1水杨酸钠使ICa的稳态激活曲线向超极化方向移动大约9 mV,但是曲线的斜率并不改变。
2.3 水杨酸钠对海马神经元稳态失活曲线的影响钳制电压 -50 mV,给以 -70~+10 mV,持续2 000 ms,阶跃为10 mV的一系列条件脉冲,然后给予去极化至+10 mV,持续200 ms的测试脉冲,刺激频率为0.1 Hz。以电流峰值的相对值(I/Imax)为纵坐标,相对应的条件脉冲为横坐标作图,再利用最小二乘法,按照Boltzmann方程进行拟合,得到ICa的稳态失活曲线(Fig 4)。加药前,半失活电压 V1/2为(-23.71±1.21)mV,斜率 k为(8.35±1.14);给药后,半失活电压 V1/2为(23.08±0.71)mV(P>0.05,n=8),斜率 k为(9.43±0.68)(P>0.05,n=8)。实验结果表明,1 mmol·L-1水杨酸钠既不使ICa的稳态失活曲线向去极化方向移动,也不向超极化方向移动,也不改变其斜率。
3 讨论
钙电流是细胞动作电位的重要电流,在形成动作电位的平台期方面起重要作用。VGCC开放,大量Ca2+内流使神经递质释放增多[13]。实验结果表明,水杨酸钠对ICa有抑制作用,且这种作用具有浓度依赖性。Taggart[14]在研究水杨酸钠的安全用药剂量时发现,水杨酸钠导致耳鸣的发病率与水杨酸钠的血药浓度成正比,本实验结果与他的研究结论一致。本实验还显示,1 mmol·L-1水杨酸钠会改变ICa的激活动力学特征,使ICa的稳态激活曲线向超级化方向移动大约9 mV,但是不改变其失活动力学特征。水杨酸钠的抑制作用可能是因为它能与海马部位神经元上的VGCC的静息态和激活态相结合。
Brozoski等[15]用高分辨率质子磁共振波谱技术观察噪音导致耳鸣的大鼠,发现下丘和听皮层的兴奋性神经递质谷氨酸含量增多,而抑制性神经递质γ-氨基丁酸含量减少。Liu等[16]利用微透析技术观察到水杨酸钠使豚鼠下丘和颞皮层的葡萄糖和乳酸含量增高,同时观察到5-羟色胺含量也增高。大鼠暴露在噪音中4个月后,检测到甘氨酸受体β亚基的含量减少[17]。我们推测兴奋性氨基酸释放的增多、抑制性氨基酸释放的减少可能是水杨酸钠对神经元上各种电压门控性离子通道的综合作用的结果。这是因为它对电压门控性钾通道和钠通道的抑制会导致神经递质释放的增多,而它对电压门控性钙通道的抑制会导致神经递质释放的减少。本试验结果只显示了海马神经元上某种离子通道的总体的变化情况,并未对神经元进行详细划分(例如分为兴奋性和抑制性神经元两大类),所以若想弄清水杨酸钠对神经递质影响不同的确切原因,还有待于进一步研究。
本部分实验利用脑片膜片钳技术研究了水杨酸钠对海马部位神经元上的VGCC的影响。水杨酸钠抑制ICa的幅度,且这种抑制作用具有浓度依赖性,使稳态激活曲线向超级化方向移动,导致海马神经元的神经递质减少。研究结果显示,水杨酸钠对海马神经元上的VGCC有明显影响,这可能与耳鸣不良情绪的产生相关。
参考文献:
[1] Leaver A M,Renier L,Chevillet M A,et al.Dysregulation of limbic and auditory networks in tinnitus[J].Neuron,2012,69(1):33-43.
[2] Jastreboff P J,Brennan JF,SasakiC T.An animalmodel for tinnitus[J].Laryngoscope,1988,98(3):280-6.
[3] Bauer C A,Brozoski T J,Rojas P,et al.Behavioral model of chronic tinnitus in rats[J].Otolarygol Head Neck Surg,1999,121(4):457-62.
[4] Rüttiger J,Jürgen C,Hans-Peter Z,et al.A behavioral paradigm to judge acute sodium salicylate-induced sound experience in rats:a new approach for an animalmodel on tinnitus[J].Hear Res,2003,180(1-2):39-50.
[5] 刘砚星,李学佩,张海林,等.水杨酸钠对大鼠颞皮层神经元延迟整流钾通道的抑制作用[J].中国药理学通报,2011,27(4):482-6.
[5] Liu Y X,Li X P,Zhang H L,et al.Inhibition of sodium salicylate on delayed rectifier potassium channels in rat auditory cortex neurons?[J].Chin Pharmacol Bull,2011,27(4):482-6.
[6] Dobie R A.Depression and tinnitus[J].Otolaryngol Clin North Am,2003,36(2):383-8.
[7] Langguth B,Landgrebe M,Kleinjung T,et al.Tinnitus and de-pression[J].World JBiol Psychiatry,2009,12(7):489-500.
[8] Robinson SK,Viirre E S,Bailey K A,et al.A randomized controlled trial of cognitive-behavior therapy for tinnitus[J].Int Tinnitus J,2008,14(2):119-26.
[9] McCullough L D,Sokolowski JD,Salamone JD.A neurochemical and behavioral investigation of the involvement of nucleus accumbens dopamine in instrumental avoidance[J].Neuroscience,1993,52(4):919-25.
[10]Mirz F,Gjedde A,Ishizu K,et al.Cortica l networks subserving the perception of tinnitus-a PET study[J].Acta Otolaryngol Suppl,2000,543(2):241-3.
[11]Mirz F,Gjedde A,Sodkilde-Jrgensen H,et al.Functional brain imaging of tinnitus-like perception induced by aversive auditory stimuli[J].Neuroreport,2000,11(3):633-7.
[12]Lockwood A H,SalviR J,Coad M L,etal.The functional neuroanatomy of tinnitus:evidence for limbic system links and neural plasticity[J].Neurology,1998,50(1):114-20.
[13]Takahashi K,WakamoriM,Akaike N.Hippocampal CA1 pyramidal cells of rats have four voltage-dependent calcium conductances[J].Neurosci Lett,1989,104(1-2):229-34.
[14]Taggart A J.Symptomatic salicylate ototoxicity:a useful indicator of serum salicylate concentration[J]?Ann Rheum Dis,1992,51(5):704.
[15]Brozoski T,Odintsov B,Bauer C.Gamma-aminobutyric acid and glutamic acid levels in the auditory pathway of rats with chronic tinnitus:a direct determination using high resolution point-resolved proton magnetic resonance spectroscopy(H-MRS)[J].Front Syst Neurosci,2012,6:9.
[16]Liu J,Li X.Effect of acute salicylate on 5-HTergic activity in the inferior colliculus and the auditory cortex of rat[J].Hear Res,2003,175(1-2):45-53.
[17]Wang H,Turner JG,Brozoski T J.Plasticity at glycinergic synapses in dorsal cochlear nucleus(DCN)of rats with behavioral evidence of tinnitus[J].Neuroscience,2009,164(2):747-59.