重组旋毛虫蛋白rTsP38对小鼠肠缺血/再灌注肠损伤的保护作用及机制研究
刘卫锋,温仕宏,李云胜,沈建通,刘克玄
(中山大学附属第一医院麻醉科,广州广东 510080)
肠I/R损伤是临床常见现象,死亡率高[1]。巨噬细胞在肠I/R损伤中起重要作用[2-5]。针对肠巨噬细胞的干预措施,有可能成为肠I/R损伤的有效防治手段。巨噬细胞主要可分为M1和M2型巨噬细胞。研究发现,在脑、肾、心脏等I/R损伤中,M1向M2的转变,能减轻组织损伤,促进组织修复[6-7]。宿主肠道寄生虫感染,能够促进Th2型细胞因子生成、激活M2型巨噬细胞,减轻宿主并存的免疫相关疾病[8-9]。前期研究已证实重组旋毛虫蛋白rTsP38引起小鼠Th2型免疫反应,在M1和M2型巨噬细胞的激活或转变方面可能有调控作用[10]。
本研究拟建立小鼠肠I/R肠黏膜损伤的模型,观察rTsP38对小鼠肠I/R损伤的保护效应,并观察肠I/R损伤对肠黏膜巨噬细胞分型的影响,以及rTsP38对肠黏膜巨噬细胞分型转变的影响。
1 材料与方法
1.1 主要仪器与试剂 正立显微成像系统(Leica公司,德国),ELX800酶标仪(Biotek公司,美国),PTC240PCR仪(Bio-Rad公司,美国),弗氏佐剂(Sigma公司,美国),HRP-山羊抗兔 IgG(Jackson公司,美国),兔抗小鼠CD163抗体(Epitomics公司,美国),兔抗小鼠MPO抗体(BioGenex公司,美国),兔抗小鼠Ki-67抗体(Dako公司,丹麦),TRIzol提取液(Bio-Rad公司,美国),Taq聚合酶(TaKaRa公司,日本),Real-time PCR试剂盒(TOYOBO公司,日本)。
1.2 动物模型制备 SPF级♂ BALB/c小鼠120只,购自广东省医学实验动物中心。术前禁食12h,自由饮水。参照本课题组前期研究方法复制肠I/R损伤模型[11]。小鼠麻醉采用七氟烷,经小动物麻醉机面罩诱导,新鲜气体流量2 L·min-1,吸入浓度5%,维持2%~3%。常规消毒,经腹正中切口,分离肠系膜上动脉(superiormesenteric artery,SMA)后用无创微动脉夹夹闭,缝合切口,60min后经原切口进腹,松开微动脉夹,恢复血供,缝合伤口并消毒,术后自由进食食物和水。
1.3 实验分组与免疫 如Fig 1所示,上述动物随机分为4组:假手术组(S组):仅行开腹,分离SMA但不夹闭;肠I/R损伤组(I组):分离SMA,微动脉夹夹闭之后缝合切口,60min后经原切口进腹,松开动脉夹,恢复血流进行再灌注;(3)rTsP38免疫组(T组):操作同I/R组;(4)佐剂免疫组(A组):操作同I/R组。免疫方案:建立I/R模型前6周,予小鼠背部皮下多点注射下述试剂,共3次,每次间隔14 d。S组予 PBS 0.2 ml,I组处理同 S组,T组予rTsP38 0.2 ml(含25μg与等体积弗氏完全或不完全佐剂乳化混匀的rTsP38),A组予0.1 ml PBS+0.1 ml弗氏完全或不完全佐剂乳化混匀的混合液。
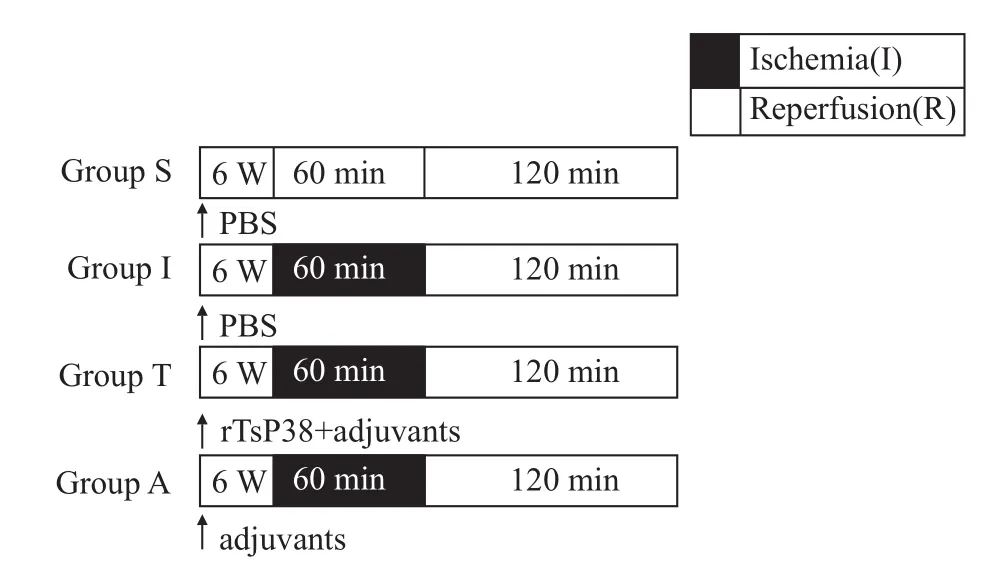
Fig 1 Experimental protocols
1.4 实验取材 于建立小鼠肠I/R损伤模型前,尾静脉采血,低温离心,分离血清,放进-80℃冰箱保存,用于rTsP38引起的抗体滴度测定。再灌注2 h(每组10只小鼠)和7 d(每组20只小鼠)后,于深麻醉下断颈处死实验动物。距回肠末端5 cm处相同部位取一约3 cm肠段,除去外膜脂肪组织,平均分为两段。其中一段置于4%多聚甲醛固定12 h,常规石腊切片,用于病理学检测。另一段小肠用4℃PBS溶液冲洗后,置于-80℃低温冰箱保存,用于细胞因子和巨噬细胞标志物检测。
1.5 rTsP38引起的小鼠血清抗体滴度测定 于建立小鼠肠I/R损伤模型前,尾静脉采血,室温放置4 h,冰上放置30~60 min,吸出已析出的血清,2 700×g离心沉淀后,再析出分离的血清,然后10 000×g瞬时离心去除少量红细胞,采用间接ELISA法,按说明书检测小鼠血清抗体滴度变化。
1.6 再灌注后小鼠进食量和体重变化 测量并记录再灌注7 d组存活小鼠每日进食量及再灌注1、2、4及7 d体重变化情况。
1.7 肠黏膜损伤和修复的评价 常规石蜡切片,HE染色。在光学显微镜下观察2 h组小鼠小肠黏膜形态学变化,采用改良Chiu′s评分法评价肠黏膜损伤程度,评分越高,表明损伤越严重[12]。在正立显微成像系统下,观察7 d组小鼠小肠绒毛恢复情况,随机选取8~10个绒毛并测量其绒毛顶端至隐窝的高度。
1.8 qRT-PCR法测定小鼠小肠组织IL-6、IL-10和巨噬细胞标志物NOS2(M 1型巨噬细胞)、Arg-1(M 2型巨噬细胞) 取100 mg小肠组织,采用Trizol一步法提取小肠组织总RNA,并于260 nm和280 nm处测定其OD值,计算OD260/OD280值。以βactin为内参,半定量qRT-PCR法检测 IL-6、IL-10、NOS2和Arg-1 mRNA表达水平。引物设计见Tab 1。

Tab 1 PCR primer design
1.9 小肠组织M 2巨噬细胞标志物CD163、中性粒细胞MPO和增殖细胞K i-67表达检测 常规脱蜡水化后,采用Envision免疫组织化学法测定小肠组织M2巨噬细胞标志物CD163、中性粒细胞MPO和增殖细胞Ki-67表达变化。
1.10 统计学处理 采用SPSS 13.0统计软件分析数据,计量资料以¯x±s表示,组间比较采用单因素方差分析,两两比较采用Tukey post hoc检验。
2 结果
2.1 小鼠血清抗体滴度变化 rTsP38免疫后小鼠血清IgG1水平明显升高,与S组、I组和A组比较差异有统计学意义(P<0.01)。rTsP38免疫后小鼠血清IgG2a水平也明显升高,与S组、I组和A组比较差异有统计学意义(P<0.05),但IgG2a升高的倍数明显低于IgG1升高的倍数,差异有统计学意义(P<0.01,Fig 2)。
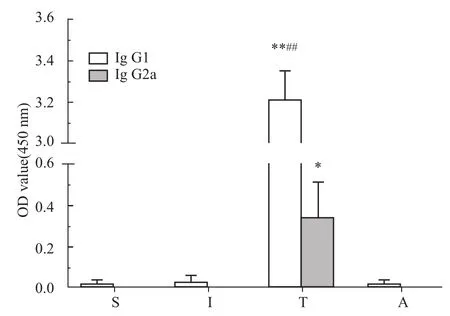
Fig 2 Serological antibody response to rTsP38 immunization in m ice(±s)*P<0.05,**P<0.01 vs group S,Iand A;##P<0.01 vs IgG2a
2.2 小鼠进食量和体重变化 再灌注后1 d,I组、T组和A组小鼠进食量明显少于S组,差异有统计学意义(P<0.05)。T组小鼠于再灌注后2 d进食量明显增加,与S组比较,差异无统计学意义。再灌注后2~7 d,T组小鼠进食量明显高于I组和A组,差异有统计学意义(P<0.05,Fig 3A)。
再灌注后1、2和4 d,I组、T组和A组小鼠体重增加明显低于S组,差异有统计学意义(P<0.01)。与Ⅰ组和A组比较,T组小鼠于再灌注后4 d和7 d体重明显增加,差异有统计学意义(P<0.05,Fig 3B)。
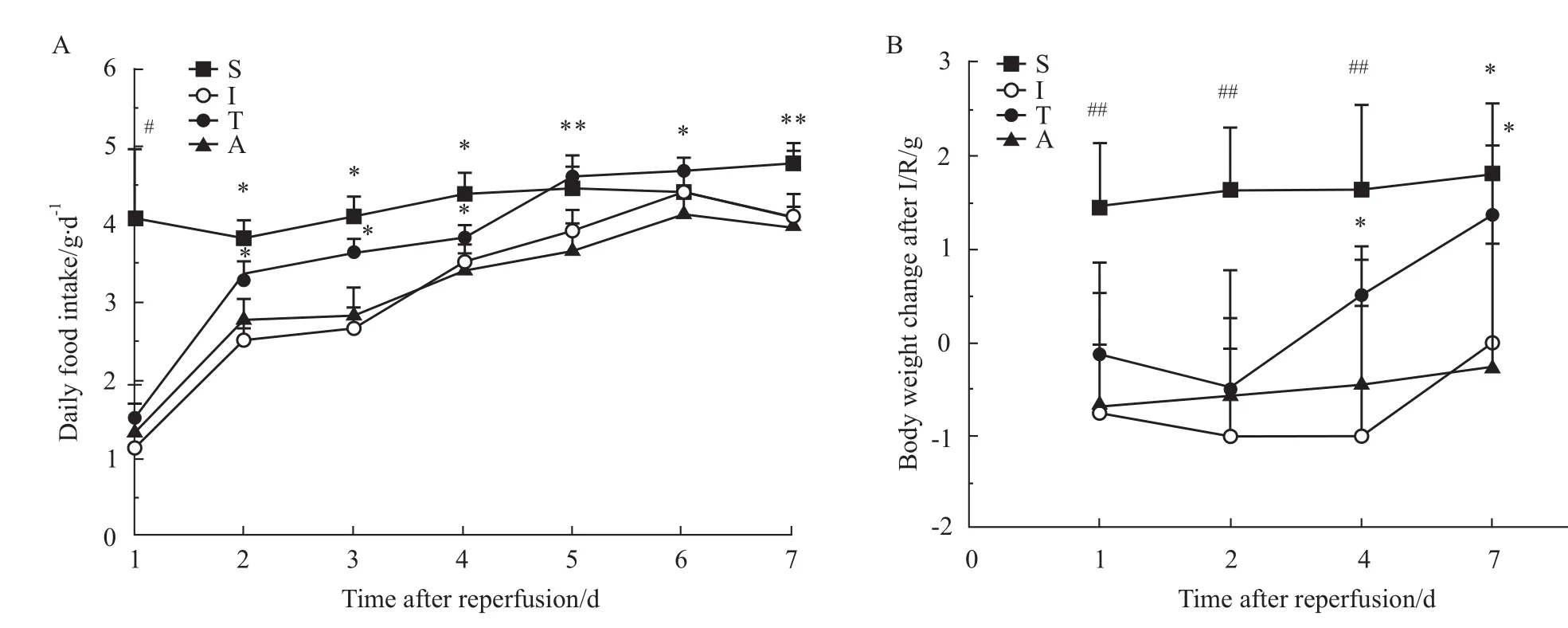
Fig 3 Daily food intake and body weight change after intestinal ischem ia/reperfusion(I/R)(±s,n=7-10)*P<0.05,**P<0.01 vs group Iand A;#P<0.05,##P<0.01 vs group I,T and A

Fig 4 Histopathological changes of intestinalmucosa and the evaluation of intestinal injury with modified Chiu′s scores under lightm icroscopy(hematoxylin and eosin staining,magnification:×200,¯x±s)A,B,C,D represent group S,I,T and A.(n=9-10,#P<0.05 vs group Iand A;**P<0.01 vs group S)
2.3 小鼠小肠组织光学显微镜下形态学及改良Chiu′s评分变化 光镜下可见S组小肠黏膜组织完整。与S组比较,I组、T组和A组小鼠的小肠组织改良Chiu′s评分均升高,差异具有统计学意义(P<0.01)。T组小鼠的小肠组织改良Chiu′s评分明显低于I组和A组,差异有统计学意义(P<0.05,Fig 4)。
再灌注后7 d,T组小鼠小肠绒毛高度明显高于S组、I组和A组,差异有统计学意义(P<0.01,Fig 5)。与S组、I组和A组相比较,T组小鼠小肠绒毛高度增长了17%~23%。
2.4 小鼠小肠组织IL-6、IL-10和巨噬细胞标志物NOS2(M 1型巨噬细胞)、Arg-1(M 2型巨噬细胞)的表达变化
2.4.1 小鼠小肠组织IL-6表达变化 再灌注后2 h,S组、I组和A组小鼠小肠组织IL-6基因表达变化差异无统计学意义,而T组小鼠小肠组织IL-6基因表达明显高于S组、I组和A组,差异有统计学意义(P<0.01)。再灌注后7 d,I组、T组和A组小鼠小肠组织IL-6基因表达明显高于S组,差异有统计学意义(P<0.05或 P<0.01,Fig 6A)。与再灌注后2 h比较,I组、T组和A组小鼠小肠组织IL-6基因表达分别升高了2.5、14.8和2.6倍。
2.4.2 小鼠小肠组织IL-10表达变化 再灌注后2 h,I组、T组和A组小鼠小肠组织IL-10基因表达明显高于S组,差异有统计学意义(P<0.01)。再灌注后7 d,I组和A组小鼠小肠组织IL-10基因表达回落,与S组比较,差异无统计学意义;而T组小鼠小肠组织IL-10基因表达明显升高,与S组、I组和A组比较,差异有统计学意义(P<0.01,Fig 6B)。与再灌注后2 h比较,I组、T组和A组小鼠小肠组织IL-10基因表达分别升高了0.2、317.3和0.2倍。
2.4.3 小鼠小肠组织NOS2表达变化 再灌注后2 h,S组、I组、T组和A组小鼠小肠组织NOS2基因表达变化差异无统计学意义。再灌注后7 d,I组、T组和A组小鼠小肠组织NOS2基因表达明显高于S组,差异有统计学意义(P<0.01),T组小鼠小肠组织NOS2基因表达明显高于I组和A组,差异有统计学意义(P<0.01,Fig 6C)。与再灌注后2 h比较,I组、T组和A组小鼠小肠组织NOS2基因表达分别升高了3.1、7.4和4.0倍。

Fig 5 Changes in villus height of intestinalmucosa(hematoxylin and eosin staining,magnification:×200,±s,n=7-10)**P<0.01 vs group S,Iand A
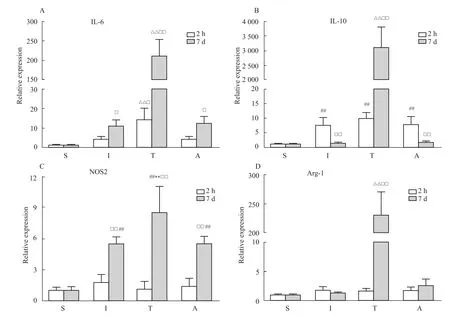
Fig 6 Changes of cytokines,Arg-1,and NOS2 mRNA levels in intestine at different reperfusions(±s,n=5-6)A,B,represent IL-6 and IL-10 mRNA levels in intestine,respectively.C,D,denote Arg-1 and NOS2 mRNA levels in intestine,respectively.**P<0.01 vs groups Iand A;##P<0.01 vs group S;ΔΔP<0.01 vs groups S,Iand A;□P<0.05,□□P<0.01 vs2 h
2.4.4 小鼠小肠组织Arg-1表达变化 再灌注后2 h,S组、I组、T组和A组小鼠小肠组织Arg-1基因表达变化差异无统计学意义。再灌注后7 d,T组小鼠小肠组织Arg-1基因表达明显升高,与S组、I组和A组比较,差异有统计学意义(P<0.01,Fig 6D)。与再灌注后2 h比较,I组、T组和A组小鼠小肠组织Arg-1基因表达分别升高了0.7、134.9和1.4倍。
2.5 免疫组化测定小肠组织M 2巨噬细胞标志物CD163、中性粒细胞MPO和增殖细胞Ki-67表达的变化
2.5.1 CD163免疫组化测定 再灌注后2 h和7 d,T组小鼠小肠组织CD163阳性细胞数较S组、I组和A组明显增多,差异有统计学意义(P<0.05或 P<0.01,Fig 7)。
2.5.2 MPO免疫组化测定 再灌注后2 h,S组和T组小鼠小肠组织可见少量MPO阳性细胞,I组和A组明显增多,差异有统计学意义(P<0.01)。再灌注后7 d,S组、I组、T组和A组小鼠小肠组织MPO阳性细胞数回落,但I组和A组MPO阳性细胞数仍明显高于T组,差异有统计学意义(P<0.05,Fig 8)。
2.5.3 Ki-67免疫组化测定 再灌注后2 h,T组小鼠小肠组织Ki-67阳性细胞数较I组和A组明显增多,差异有统计学意义(P<0.05)。再灌注后7 d,Ki-67阳性细胞数回落,但T组小鼠小肠组织Ki-67阳性细胞数明显高于S组、I组和A组,差异有统计学意义(P<0.01,Fig 9)。

Fig 7 Changes of CD163-positive cells in intestine at different reperfusions(¯x±s,n=5)*P<0.05,**P<0.01 vs group S;#P<0.05,##P<0.01 vs groups S,Iand A;ΔΔP<0.01 vs2 h
3 讨论
本研究中,再灌注后2 h,I组小鼠Arg-1(M2型巨噬细胞标志物)和NOS2(M1型巨噬细胞标志物)mRNA水平均升高,7 d时Arg-1水平下降,NOS2水平明显升高;与Arg-1和NOS2 mRNA水平变化趋势相似,再灌注后2 h,I组小鼠IL-10和IL-6 mRNA水平均升高,7 d时IL-10水平下降,IL-6水平明显升高。上述结果提示,肠I/R损伤在再灌注早期促进巨噬细胞激活,在后期促进M2向M1型巨噬细胞的转变。Kigerl等[13]在小鼠脊髓I/R损伤的研究中也有类似发现。
M1和M2型巨噬细胞在组织损伤和修复中的作用至关重要。M1向M2型巨噬细胞的转变,对于炎症的恢复具有重要意义。本研究中,rTsP38免疫后T组小鼠血清IgG1水平明显升高,虽然IgG2a也有所升高,但明显低于IgG1水平。与I组小鼠比较,再灌注后7 d,T组小鼠Arg-1和NOS2 mRNA水平均升高,但以Arg-1升高为主(135倍 vs 7倍),CD163+细胞数明显增多;与Arg-1和 NOS2 mRNA水平变化趋势相似,再灌注后7 d,T组小鼠IL-10和IL-6 mRNA水平均较I组小鼠升高,但以IL-10升高为主(317倍 vs 15倍)。上述结果表明,rTsP38具有很好的免疫原性,并引起宿主偏向Th2型的免疫反应,激活巨噬细胞,并促进了M1向M2型巨噬细胞的转变。
已有研究表明,在脑、肾、心脏等I/R损伤中,M1向M2巨噬细胞的转变,能减轻组织损伤,促进组织修复[6-7]。本研究发现,与I组和A组比较,T组小鼠再灌注后2 h,肠黏膜损伤明显减轻,改良Chiu′s评分明显降低;再灌注后7 d,T组小鼠小肠绒毛高度较其余各组明显增加;此外,T组小鼠进食量、体重变化以及增殖细胞数均明显增加,中性粒细胞浸润明显减少。上述结果表明rTsP38通过促进M1向M2型巨噬细胞的转变,从而减轻肠I/R损伤、促进肠修复和小鼠肠功能恢复。
综上所述,肠I/R激活巨噬细胞并促进M2向M1型巨噬细胞转变;rTsP38促进Th2型免疫反应,逆转肠I/R损伤所致M2向M1型巨噬细胞的转变,并促进M1向M2型巨噬细胞转变,从而减轻小鼠肠I/R所致肠损伤,促进肠黏膜修复和肠功能恢复。
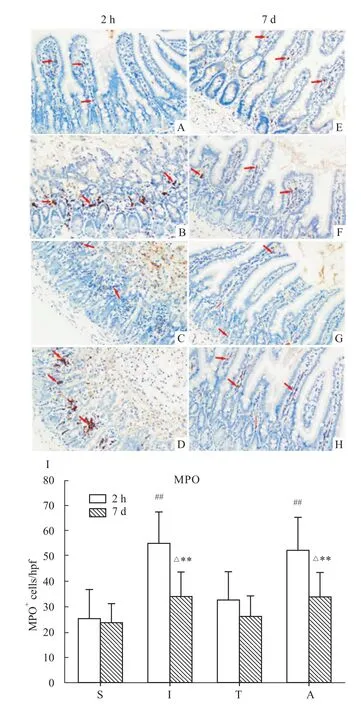
Fig 8 Changes of MPO-positive cells in intestine at different reperfusions(±s,n=5)ΔP<0.05 vs group T;**P<0.01 vs group S;##P<0.01 vs groups S and T.

Fig 9 Changes of K i-67-positive cells inintestine at different reperfusions±s,n=5)#P<0.05 vs groups Iand A;**P<0.01 vs groups S,Iand A
参考文献:
[1] Martin B.Prevention of gastrointestinal complications in the criti-cally ill patient[J].AACN Adv Crit Care,2007,18(2):158-66.
[2] Wu M C,Brennan F H,Lynch JP,et al.The receptor for complement component C3a mediates protection from intestinal ischemia-reperfusion injuries by inhibiting neutrophilmobilization[J].Proc Natl Acad Sci USA,2013,110(23):9439-44.
[3] Chen J,Crispín JC,Tedder T F,et al.B cells contribute to ischemia/reperfusion-mediated tissue injury[J].J Autoimmun,2009,32(3-4):195-200.
[4] Chen Y,Lui V C,Rooijen N V,Tam PK.Depletion of intestinal residentmacrophages prevents ischaemia reperfusion injury in gut[J].Gut,2004,53(12):1772-80.
[5] Schaefer N,Tahara K,Schmidt J,et al.Residentmacrophages are involved in intestinal transplantation-associated inflammation and motoric dysfunction of the graftmuscularis[J].Am J Transplant,2007,7(5):1062-70.
[6] Lee S,Huen S,Nishio H,et al.Distinctmacrophage phenotypes contribute to kidney injury and repair[J].J Am Soc Nephrol,2011,22(2):317-26.
[7] Troidl C,Möllmann H,Nef H,et al.Classically and alternatively activated macrophages contribute to tissue remodelling after myocardial infarction[J].JCell Mol Med,2009,13(9B):3485-96.
[8] Summers R W,Elliott D E,Urban J F Jr,et al.Trichuris suis therapy for active ulcerative colitis:a randomized controlled trial[J].Gastroenterology,2005,128(4):825-32.
[9] Du L,Tang H,Ma Z,et al.The protective effect of the recombinant53-kDa protein of Trichinella spiralis on experimental colitis inmice[J].Dig Dis Sci,2011,56(10):2810-7.
[10]Zhan JH,Yao JP,Liu W,etal.Analysis of a novel cathepsin B circulating antigen and its response to drug treatment in Trichinella-infected mice[J].Parasitol Res,2013,112(9):3213-22.
[11]刘克玄,吴伟康,朱有凯,等.四逆汤对大鼠肠缺血再灌注肠黏膜细胞凋亡的影响及神经酰胺机制[J].中国药理学通报,2005,21(2):240-4.
[11]Liu K X,Wu W K,Zhu Y K,et al.Effects of sini decoction on intestinalmucosal cell apoptosis and its ceramidemechanism after intestinal ischemia reperfusion in rats[J].Chin Pharmacol Bull,2005,21(2):240-4.
[12]Liu K X,Li Y S,HuangW Q,et al.Immediate postconditioning during reperfusion attenuates intestinal injury[J].Intensive Care Med,2009,35(5):933-42.
[13]Kigerl K A,Gensel JC,Ankeny D P,et al.Identification of two distinct macrophage subsets with divergent effects causing either neurotoxicity or regeneration in the injuredmouse spinal cord[J].JNeurosci,2009,29(43):13435-44.