齐留通通过激活ERK1/2信号通路减轻大鼠脑缺血炎症反应和缺血性脑损伤
涂献坤,石松生,杨卫忠,陈建屏,陈 琰,王立胜
(福建医科大学附属协和医院神经外科,福建省神经外科研究所,福建福州 350001)
炎症反应是介导缺血性脑损伤最重要的病理生理机制之一,并且炎症反应已被广泛认为是治疗缺血性脑中风的重要靶点[1]。本课题组前期研究发现,5-脂氧合酶(5-lipoxygenase,5-LOX)抑制剂 zileuton通过抑制炎症反应减轻大鼠缺血性脑损伤[2]。在脑缺血中,ERK1/2被认为一种促神经细胞生存的信号通路,研究表明,神经保护剂Leptin通过激活ERK1/2信号通路减轻缺血性脑损伤[3],但是 5-LOX抑制剂zileuton是否通过调节ERK1/2信号通路减轻脑缺血诱导的炎症反应及缺血性脑损伤,目前尚未见报道。本实验对此进行了初步的研究。
1 材料与方法
1.1 主要试剂 TTC染料购自美国Amersco公司,MPO检测试剂盒购自南京建成生物公司,ELISA试剂盒购自厦门泰京生物公司,PD98059购于Promega公司,Zileuton来自湖北鑫顺源医药化工,p-ERK1/2和 t-ERK1/2抗体购于Santa Cruz公司,蛋白提取试剂盒及检测试剂盒购于碧云天生物技术公司,水合氯醛由福建医科大学附属协和医院提供。
1.2 动物分组、动物模型制备及脑室内注射 清洁级♂SD大鼠,体质量250~300 g,由上海斯莱克实验动物有限责任公司提供。随机将大鼠分为4组,即对照组(sham)、脑缺血+溶媒处理组(MCAO)、脑缺血+zileuton治疗组(zileuton)和脑缺血+zileuton治疗+PD98059干预组(PD98059)。脑缺血后,zileuton 50 mg·kg-1用生理盐水稀释(无水酒精助溶),通过灌胃给药,该剂量参考本课题组前期发表论文[2]。
脑缺血动物模型参考课题组前期工作[4],采用直径0.32 mm的尼龙鱼线,10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉,钝性分离右侧颈总动脉、颈外动脉、颈内动脉,结扎颈外动脉。在颈外动脉近分叉处剪一“V’形切口,插入备用鱼线,用镊子轻轻将栓线送至大脑中动脉起始处,平均进线(18.0±2.0)mm。
PD98059溶于DMSO,并用PBS稀释成10μmol·L-1。在建立脑缺血模型时取10μl PD98059行脑室内注射,运用立体定向注射仪(深圳瑞奥德公司)。定向仪注射以前囟前方0.8 mm,中线外侧1.5 mm为穿刺点,穿刺深度3.5 mm。
1.3 评估大鼠神经功能损伤程度 根据文献报道的神经功能损伤评分方法[5],对脑缺血24 h大鼠进行神经功能评分。0分,无神经功能障碍;1分,提起大鼠尾巴对侧前肢屈曲;2分,行走时地上打转,静止时身体无偏向对侧;3分,行走时地上打转,静止时身体也偏向对侧;4分,严重意识障碍。
1.4 测量脑梗死体积 脑缺血24 h,取鼠脑,沿冠状位将鼠脑切成6片(前囟前方2片,后方4片),每片厚度约2 mm,放在2%TTC溶液中避光孵育20 min。正常脑组织呈鲜红色,梗死脑组织呈白色。利用Photoshop等软件测量各脑片梗死面积,并按如下公式计算脑梗死体积,V=t×(A1+A2+…An),V为梗死体积,t为脑片厚度,A为梗死面积;数据采集以脑梗死比作统计,脑梗死体积/%=(手术对侧半球的体积-手术侧半球未梗死部分的体积)/手术对侧半球的体积×100%。
1.5 分析缺血脑组织含水量 分析脑含水量可作为评估脑水肿的依据。脑缺血24 h,取鼠脑,用滤纸吸除脑表面的水珠,称重可获得湿重(wet weights,WW),放烤箱烤干后,再称重获得干重(dry weights,DW),脑含水量计算公式:H2O/%=(WW-DW)/WW×100%。
1.6 检测缺血脑组织髓过氧化物酶水平 髓过氧化物酶(myeloperoxidase,MPO)是中性粒细胞的标志性物质,通过检测MPO的活性可获得中性粒细胞的浸润程度,从而间接反映脑缺血炎症反应的程度。脑缺血24 h取大鼠缺血脑组织,匀浆,按试剂盒说明书步骤操作,并计算MPO活性。
1.7 ELISA检测血浆TNF-α的含量 脑缺血24 h,采集血液,3 000 r·min-1离心后15 min获得上清,将标准蛋白样品和待测样品加入包被好一抗的96孔板,按试剂盒说明书步骤操作,最后测定OD值。根据已知浓度的标准蛋白的OD值绘制标准曲线,并根据标准曲线计算各待测样品的TNF-α含量。
1.8 W estern blot法检测大脑 p-ERK1/2和 t-ERK1/2的含量 脑缺血24 h,取大鼠缺血脑组织,蛋白提取试剂盒提取总蛋白,并测定蛋白浓度。经灌胶、上样、凝胶电泳、转膜等步骤后,一抗4℃孵育过夜,二抗室温孵育2 h,然后经显影、定影、图像采集等,用Quantity one软件分析蛋白条带。
1.9 统计学处理 统计结果以表示,统计学方法采用单因素方差分析(ANOVA),两两比较选用LSD法分析,用SPSS13.0统计软件处理。
2 结果
2.1 Zileuton减轻神经功能损伤和脑梗死体积的作用被PD98059抑制 假手术组大鼠无神经功能障碍,脑缺血24 h大鼠神经功能损伤评分明显增高(2.67±0.51,P<0.01),zileuton 50 mg·kg-1治疗组明显减轻大鼠脑缺血诱导的神经功能损伤(1.5±0.54,P<0.05),这种作用被 PD98059抑制(2.5±0.55,P<0.05,n=6)。
假手术组未见脑梗死,脑缺血24 h大鼠脑梗死比明显增大(0.411±0.015,P<0.01),zileuton 50 mg·kg-1治疗组大鼠脑梗死比(0.228±0.036)明显小于溶媒组脑梗死比(P<0.05),这种作用被PD98059抑制(0.342±0.035,P<0.05,n=6)。
2.2 Zileuton减轻缺血性脑水肿的作用被PD98059抑制 大鼠脑缺血24 h缺血侧脑组织含水量(84.7±3.1)%和假手术组(73.6±1.1)%相比明显增高(P<0.01),zileuton 50 mg·kg-1组(79.7±2.4)%明显减小大鼠脑含水量(P<0.01),这种作用被 PD98059抑制(82.1±1.8)%,(P<0.05,n=6)。
2.3 Zileuton降低MPO活性的作用被PD98059抑制 大鼠脑缺血24 h缺血脑组织MPO活性明显增高(P<0.01),zileuton 50 mg·kg-1可减轻缺血脑组织MPO的活性,即抑制脑缺血诱导的炎症反应,这种抗炎症反应作用被PD98059抑制(Tab 1)。
2.4 Zileuton降低TNF-α表达的作用被PD98059抑制 大鼠脑缺血24 h血浆TNF-α的水平增高(P<0.01),zileuton 50 mg·kg-1可明显降低血浆 TNF-α的水平,这种抑制TNF-α表达的作用被脑室内注射的PD98059抑制(Tab 1)。
Tab 1 Zileuton reduces MPO activity and TNF-αcontent in rats of cerebral ischem ia via modulating ERK 1/2 signaling pathway

Tab 1 Zileuton reduces MPO activity and TNF-αcontent in rats of cerebral ischem ia via modulating ERK 1/2 signaling pathway
**P<0.01 vs sham group;#P<0.05,##P<0.01 vs MCAO group;△P<0.05 vs zileuton-treated group.
Group MPO activity TNF-αcontent Sham 0.136±0.012 7.37±1.01 MCAO 0.475±0.024 20.7±2.58**Zileuton 50 mg·kg-1 0.356±0.052**#16.45±1.35**##LY294002+Zileuton 0.415±0.031**△ 19.97±2.1**△
2.5 Zileuton激活 ERK1/2信号通路的作用被PD98059抑制 大鼠脑缺血24 h缺血脑组织p-ERK1/2的蛋白表达明显降低(P<0.01),而 t-ERK1/2的蛋白表达不变(P>0.05)。Zileuton 50 mg·kg-1明显上调缺血脑组织p-ERK1/2的蛋白表达水平(P<0.01),而对t-ERK1/2的蛋白表达没有影响(P>0.05)。Zileuton上调p-ERK1/2表达的作用被 PD98059抑制(P<0.05),PD98059对 t-ERK1/2的蛋白表达没有影响(P>0.05),见 Fig 1。
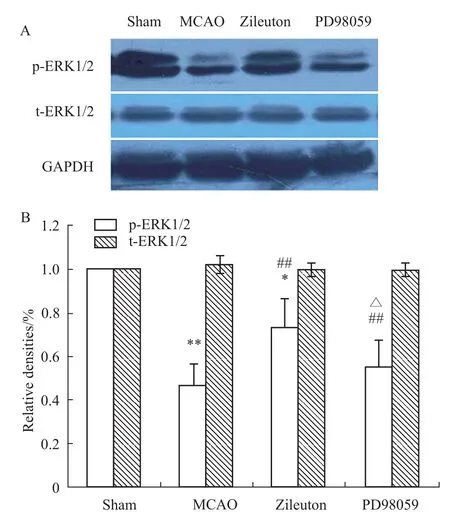
Fig 1 Zileuton up-regulates the expression of p-ERK1/2 in rats of cerebral ischem ia,which is inhibited by PD98059 adm inistration±s,n=6)*P<0.05,**P<0.01 vs sham group;##P<0.01 vs MCAO group;△P<0.05 vs zileuton-treated group.
3 讨论
急性缺血性脑中风的治疗包括两个方面:溶栓治疗和神经保护治疗[6]。阿替普酶是目前急性缺血性脑中风溶栓治疗的最有效的药物,但是溶栓治疗的时间窗只有3~4.5 h[7],这么短的治疗时间窗导致了临床上实际能够接受溶栓治疗的病人不足2.1%[8]。探索新的神经保护措施或神经保护药物,提高缺血神经细胞的耐受性,弥补溶栓治疗的不足,目前已成为全世界的研究热点。我们前期研究发现,脑缺血后5-LOX表达增高,5-LOX抑制剂zileuton可抑制脑缺血5-LOX的表达从而减轻大鼠脑缺血损伤[9],此外zileuton可抑制炎症反应、血脑屏障破坏和神经元凋亡减轻缺血性损伤[2,10],但其潜在的分子机制目前尚未完全明确。
本项研究利用已成功建立的大鼠脑缺血模型,借助脑立体定向仪将 ERK1/2的特异性抑制剂PD98059注射脑室内,用于干预ERK1/2信号通路。结果显示,zileuton可减轻大鼠脑缺血诱导的神经功能障碍,减小脑梗死体积,减轻缺血性脑水肿,这3个方面说明zileuton可减轻大鼠缺血性脑损伤,对脑缺血具有神经保护作用。上述zileuton的3种作用均被脑室内注射的PD98059所抑制,这充分表明zileuton对脑缺血的神经保护作用和调节ERK1/2信号通路有关。已知zileuton通过抑制炎症反应减轻缺血性脑损伤,本研究发现zileuton抗炎症反应的作用也被脑室内注射的PD98059所抑制,这说明zileuton是通过调节ERK1/2信号通路减轻脑缺血炎症反应。因此,5-LOX抑制剂是通过调节ERK1/2信号通路减轻炎症反应,进而减轻缺血性脑损伤。
为了证实zileuton是如何调节ERK1/2信号通路,我们检测了信号通路的关键蛋白p-ERK1/2和t-ERK1/2的蛋白表达水平,结果发现脑缺血后p-ERK1/2的表达下降,这和ERK1/2信号通路促神经细胞生存的说法是完全一致的,但t-ERK1/2的表达没有变化,这和ERK1/2磷酸化激活的理论也是一致的[11]。Zileuton可以上调 p-ERK1/2的表达,对t-ERK1/2没有影响,说明 zileuton激活脑缺血ERK1/2信号通路具备可能性;进一步研究发现zileuton上调p-ERK1/2表达的作用被脑室内注射的PD98059抑制,这说明zileuton通过激活ERK1/2信号通路并发挥生物学效应。因此,zileuton对脑缺血的神经保护作用和抗炎症反应的作用是通过激活ERK1/2信号通路起作用。但是,zileuton的抗炎症反应是否与其抑制5-LOX表达有关,目前没有明确的结论。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是一种炎症性细胞因子,在脑缺血性损伤的病理生理过程中起重要作用,可加重炎症反应从而介导脑损伤[12]。脑缺血 TNF-α的表达升高,zileuton可抑制TNF-α的表达,这种作用也被脑室内注射的PD98059所抑制,这进一步表明zileuto的抗炎症作用和ERK1/2信号通路的激活有关。综上所述,zileuton通过激活ERK1/2信号通路减轻大鼠脑缺血炎症反应和缺血性脑损伤。
参考文献:
[1] del Zoppo G J.Acute anti-inflammatory approaches to ischemic stroke[J].Ann N Y Acad Sci,2010,1207(10):143-8.
[2] Tu X K,Yang W Z,Wang C H,et al.Zileuton reduces inflammatory reaction and brain damage following permanent cerebral ischemia in rats[J].Inflammation,2010,33(5):344-52.
[3] Zhang J,Deng Z,Liao J,et al.Leptin attenuates cerebral ischemia injury through the promotion of energy metabolism via the PI3K/Akt pathway[J].JCereb Blood Flow Met,2013,33(4):567-74.
[4] 涂献坤,杨卫忠,石松生,等.黄芩苷抑制缺血性脑损伤大鼠脑组织TNF-α和AQP-4表达及减轻脑损伤的研究[J].中国药理学通报,2013,29(9):1222-5.
[4] Tu X K,Yang W Z,Shi SS,et al.Effect of baicalin on inflammatory reaction and blood-brain barrier disruption following cerebral ischemia in rats[J].Chin Pharmacol Bull,2013,29(9):1222-5.
[5] 雷军荣,秦 军,张 晶,等.姜黄素对大鼠缺血性脑损伤炎症反应和血脑屏障通透性的影响[J].中国药理学通报,2010,26(1):120-3.
[5] Lei JR,Qin J,Zhang J,et al.Effects of curcumin on inflammatory reaction and blood-brain barrier permeability in rats following cerebral ischemic injury[J].Chin Pharmcol Bull,2010,26(1):120-3.
[6] Rosso C,Samson Y.The ischemic penumbra:the location rather than the volume of recovery determines outcome[J].Curr Opin Neurol,2014,27(1):35-41.
[7] Hacke W,Kaste M,Bluhmki E,et al.Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke[J].N Engl J Med,2008,359(26):1317-29.
[8] Kleindorfer D,Lindsell C J,Brass L,etal.National USestimates of recombinant tissue plasminogen activator use:ICD-9 codes substantially underestimate[J].Stroke,2008,39(3):924-8.
[9] Tu X K,YangW Z,Shi SS,etal.5-lipoxygenase inhibitor zileuton attenuates ischemic brain damage:invovlement ofmatrixmetalloproteinase-9[J].Neurol Res,2009,31(8):848-52.
[10]Shi S S,Yang W Z,Tu X K,et al.5-Lipoxygenase inhibitor zileuton inhibits neuronal apoptosis following focal cerebral ischemia[J].Inflammation,2013,36(6):1209-17.
[11]Wang Z,Zhang H,Xu X,etal.bFGF inhibits ER stress induced by ischemic oxidative injury via activation of the PI3K/Akt and ERK1/2 pathways[J].Toxicol Lett,2012,212(2):137-46.
[12]Kalay S,Oztekin O,Tezel G,et al.Role of immunoglobulin in neuronal apoptosis in a neonatal rat model of hypoxic ischemic brain injury[J].Exp Ther Med,2014,7(3):734-8.

