黄芪甲苷对Th2型淋巴细胞D10.G4.1体外作用的研究
金华良,王利民,罗清莉,厉 蓓,杜懿杰,吕玉宝,董竞成
(1.南京医科大学附属杭州医院呼吸科,浙江 杭州 300021;2.复旦大学附属华山医院中西医结合科,上海 200041)
Th2细胞因子在过敏性疾病(如哮喘)中发挥重要作用。研究证实其可促进B细胞分泌IgE,嗜酸性细胞聚集及气道上皮粘液分泌,是气道炎症产生的主要机制[1]。黄芪甲苷属于三萜皂苷类药物,是传统益气类中药黄芪的的主要活性成分,也是黄芪质量控制的标准。本课题组前期发现黄芪可抑制哮喘模型 IL-4、IL-5、IL-13水平,改善气道炎症[2]。研究证实黄芪甲苷具有抗炎、免疫调节、抗氧化、抗纤维化等作用,对哮喘气道炎症及重塑均有较好的改善作用[3]。本课题组推测黄芪甲苷可抑制Th2型反应,但目前报道多为对脾淋巴细胞等模型的干预研究。本研究采用D10.G4.1(D10)淋巴细胞,其为目前公认的Th2淋巴细胞株,旨从细胞水平探讨黄芪甲苷对Th2型反应的免疫调节机制。
1 材料与方法
1.1 材料 D10细胞株来源:购于美国ATCC公司,货号:TIB-224TM;黄芪甲苷(纯度:>99%)购于上海融禾医药科技发展有限公司;地塞米松注射液由山东新华制药股份有限公司提供;刀豆素蛋A(concanavalin A,ConA)、碘化丙啶(propidium iodide,PI)购于美国 Sigma公司;RPMI 1640完全培养液、胎牛血清、2-巯基丙醇购自美国Gibco公司;TSTIM购于美国BD公司;小鼠IL-1α购于美国R&D公司;细胞增殖-毒性检验试剂盒(cell counting kit-8,CCK-8)购自日本同仁化学研究所;IL-4、IL-5、IL-13、TNF-α酶联免疫吸附测定试剂盒购于上海西唐生物医药公司;gata-3兔抗小鼠多克隆抗体购于美国Santa Cruz公司。
1.2 方法
1.2.1 实验分组 ① 空白组:将D10细胞予完全培养基中培养,予培养基对照处理。② ConA组:将D10细胞予完全培养基中培养,予以50 mg·L-1ConA。③地塞米松(Dex)组:将D10细胞予完全培养基中培养,予以10-8mol·L-1Dex。④、⑤、⑥ 黄芪甲苷低、中、高剂量组:将D10细胞予完全培养基中培养,予以 50 mg·L-1ConA,及分别为 2、4、8×10-5mol·L-1黄芪甲苷。
1.2.2 D10细胞株培养条件 RPMI 1640培养基,10%T-STIM和 Con A,10% 胎牛血清,0.05 mmol·L-12-巯基丙醇,10 ng·L-1小鼠 IL-1α,在 37.0℃,5%CO2条件下培养。
1.2.3 CCK-8法检测细胞毒性及细胞增殖 细胞毒性实验:无菌条件下,向96孔培养板中依次加入D10细胞悬液,使每孔细胞数为104,再加入黄芪甲苷(使终浓度为2、4、8×10-5mol·L-1)或地塞米松(终浓度为10-8mol·L-1)或等体积培养基,共孵育48 h。最后加入10μl CCK-8试剂,37℃孵育3 h。
细胞增殖实验:先用黄芪甲苷(使终浓度分别为2、4、8×10-5mol·L-1)或地塞米松(终浓度为10-8mol·L-1)或等体积培养基预处理D10细胞2 h,然后每孔加入 ConA(终浓度为 50 mg·L-1),共刺激48 h。最后加入10μl CCK-8试剂,37℃孵育3 h。最后采用酶标仪测定吸光度值,读取波长为570 nm。
1.2.4 流式细胞仪检测细胞凋亡与周期 无菌条件下,向12孔培养板中依次加入D10细胞悬液,使每孔细胞数为106,加入黄芪甲苷(使终浓度分别为2、4、8×10-5mol·L-1)或地塞米松(终浓度为 10-8mol·L-1)或等体积培养基预处理2 h。再加入ConA(终浓度为 50 mg·L-1),共刺激 48 h后,收集细胞悬液。1 000 r·min-1离心收集细胞。冰70%乙醇4℃固定2 h。离心细胞去除乙醇,用PBS洗1遍。加PI染色液放置1 h后上流式细胞仪,检测细胞凋亡比例及细胞周期。
1.2.5 ELISA检测D10细胞培养上清细胞因子
无菌条件下,向24孔培养板中依次加入D10细胞悬液,使每孔细胞数为105,加入黄芪甲苷(使终浓度分别为2、4、8×10-5mol·L-1)或地塞米松(终浓度为10-8mol·L-1)或等体积培养基预处理 2 h。再加入ConA(终浓度为50 mg·L-1),共刺激48 h后,收集细胞悬液,1 500 r·min-1,5 min,收集细胞上清液,采用 ELISA法测定 IL-4、IL-5、IL-13、TNF-α水平,具体操作参照厂家说明书进行。
1.2.6 Western blot测定D10细胞gata-3表达水平
无菌条件下,向6孔培养板中依次加入D10细胞悬液,使每孔细胞数为2×106,加入黄芪甲苷(使终浓度分别为2、4、8×10-5mol·L-1)或地塞米松(终浓度为10-8mol·L-1)或等体积培养基预处理2 h。再加入ConA(终浓度为50 mg·L-1),共刺激48 h后,收集细胞,提取总蛋白,BCA法测定蛋白浓度。灌注凝胶,上样,电泳60V×30 min后改用80 V恒压电泳;300 mA恒流转膜90 min;封闭2 h;加入TBST稀释的gata-3抗体,4℃过夜;加羊抗兔二抗,室温2 h;ECL显色后将滤膜在暗室曝光后显影,定影,使用Quantity One软件进行条带光密度值扫描。以β-actin作内参对照。
1.2.7 统计学方法 采用SPSS16.0统计软件进行统计分析,数据采用¯x±s表示,凡符合方差齐性的数据,采用单因素方差分析(One-Way ANOVA),两组间比较采用Dunnett法。对不符合方差齐性的数据,则进行秩和检验(Kruskal-Wallis法),多组间两两比较采用Mann-Whiteney-U法。
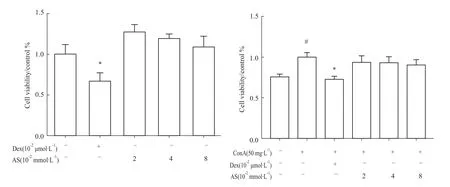
Fig 1 Effects of AS and/or ConA on D10 cell viability#P<0.05 vs blank group;*P<0.05 vs ConA group
2 结果
2.1 黄芪甲苷对D10淋巴细胞体外增殖的影响细胞毒性实验结果显示,培养48h后,地塞米松可明显抑制D10细胞活性(P<0.05),而不同浓度的黄芪甲苷(2、4、8×10-5mol·L-1)对 D10细胞活性无明显影响(P>0.05);加入 5 mg·L-1ConA刺激后,细胞活性明显提高(P<0.05);地塞米松可明显抑制ConA诱导的细胞增殖(P<0.05);不同浓度的黄芪甲苷(2、4、8×10-5mol·L-1)对 D10细胞活性无明显影响(P>0.05)。见Fig 1。
2.2 黄芪甲苷对D10细胞体外凋亡和细胞周期的影响 结果显示,ConA组凋亡较正常组明显减少(P<0.05);地塞米松组较ConA组细胞凋亡明显增多(P<0.05),G0/G1期细胞比例明显增加(P<0.01),而 S期和G2/M期细胞比例明显减少(P<0.01)。黄芪甲苷低、中、高剂量组D10细胞G0/G1期、S期均无明显变化(P>0.05),而高剂量组G2/M期细胞比例较ConA组明显减少(P<0.05)。以上说明黄芪甲苷在本实验浓度内对D10细胞无明显的促凋亡作用,但高剂量组对细胞周期有一定影响。见 Fig 2、3,Tab 1。

Fig 2 Representative plots of flow cytometry of cycle distribution

Fig 3 Effects of AS on apoptosis of D10 cells#P<0.05 vs blank group;*P<0.05 vs ConA group.
2.3 黄芪甲苷对培养上清中细胞因子(IL-4、IL-5、IL-13、TNF-α)的影响 结果显示,培养48 h后,ConA组较正常组IL-4、IL-5、IL-13及TNF-α水平均明显升高(P<0.05),地塞米松组 IL-4、IL-5、IL-13及TNF-α水平明显下降(P<0.05,P<0.01);黄芪甲苷高剂量组可明显下降D10细胞培养上清中IL-13水平(P<0.01),而低剂量组TNF-α水平明显下降(P<0.01)。但黄芪甲苷各剂量组对 IL-4、IL-5水平无明显影响(P>0.05)。见Fig 4。
2.4 黄芪甲苷对D10细胞gata-3表达水平的影响
结果显示,ConA组较空白组gata-3表达水平明显增加(P<0.05);而地塞米松组gata-3表达水平明显降低(P<0.05);黄芪甲苷高剂量组gata-3表达水平较ConA组明显下降(P<0.05),而低、中剂量组无明显差异(P>0.05)。见Fig 5。
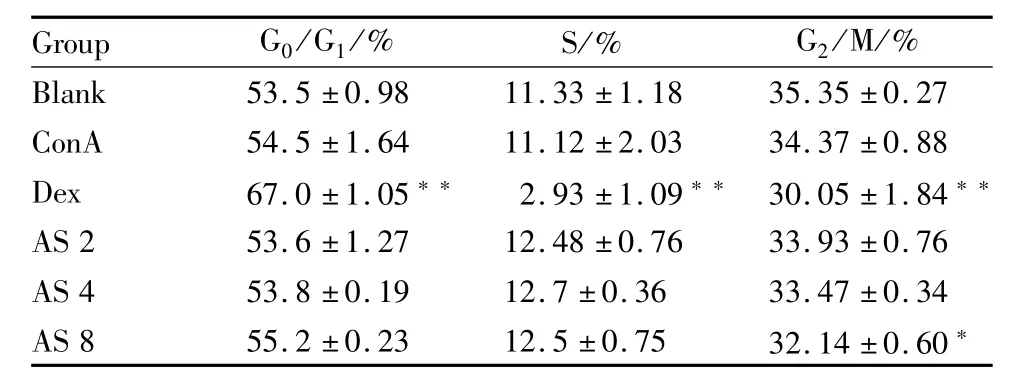
Tab 1 Effect of ASon cycle distribution of D10 cells
3 讨论
现代药理学研究表明,黄芪甲苷具有良好的免疫调节作用,可抗炎、抗氧化、抗病毒等作用[4-6]。哮喘是Th2淋巴细胞等介导的气道炎症性疾病。既往的研究[7]提示黄芪甲苷可调节T、B淋巴细胞增殖,但罕见对Th2型淋巴细胞作用的相关报道。因此,本研究通过探讨黄芪甲苷体外干预Th2淋巴细胞株(D10细胞)的作用,进一步阐明黄芪甲苷对哮喘等疾病的作用机制,为临床应用奠定理论基础。
为探讨黄芪甲苷是否存在细胞毒性作用,本研究首先检测药物对细胞活性的影响。结果发现,在有、无ConA刺激时,黄芪甲苷在本实验浓度下(2、4、8×10-5mol·L-1)对 D10细胞活性均无明显影响,说明在本实验浓度下,黄芪甲苷对D10细胞无细胞毒性作用。地塞米松在有、无ConA刺激的条件下,均可明显抑制D10细胞的活性,说明本实验浓度下的地塞米松(10-8mol·L-1),对 D10细胞具有一定的细胞毒性。

Fig 4 Effects of ASon cytokines in culture supernatants of D10 cells#P<0.05,##P<0.01 vs blank group;*P<0.05,**P<0.01 vs ConA group

Fig 5 Effects of AS on gata-3 expression of D10 cells#P<0.05 vs blank group;*P<0.05 vs ConA group.
凋亡和细胞周期的检测可进一步分析药物对细胞增殖的影响。本研究发现,与ConA组比较,低、中、高剂量组黄芪甲苷对D10细胞凋亡均无明显影响,进一步证实本实验浓度下黄芪甲苷对D10细胞无细胞毒性。但黄芪甲苷高剂量组G2/M期细胞比例明显减少,说明一定剂量的黄芪甲苷可减缓细胞的有丝分裂。而地塞米松组D10细胞凋亡明显增加,G0/G1期的细胞比例时间明显上调,而S与G2/M期的细胞比例明显减少,提示地塞米松可以抑制D10细胞内DNA合成,促使细胞停滞在静止期。
IL-4、IL-5及IL-13是经典的Th2型淋巴细胞因子,也是哮喘气道炎症的主要炎症介质[8]。研究已证实黄芪甲苷可抑制气道炎性因子水平,减少嗜酸性粒细胞聚集,从而改善气道炎症[9]。本课题从体外研究发现,黄芪甲苷对Th2型细胞因子IL-4及IL-5水平无明显影响,但可明显抑制IL-13水平。IL-13在哮喘发病机制中发挥多种功能,可促进气道粘液分泌,加重气道炎症及气道高反应性[10]。此外,本研究还发现,低剂量组黄芪甲苷可抑制TNF-α水平。TNF-α可以促进嗜酸性粒细胞和中性粒细胞的募集,促进T细胞活化,上调黏附分子ICAM-1和VCAM-1的表达,从而加重哮喘气道炎症[11]。以上提示黄芪甲苷体内改善哮喘气道炎症,其作用可能与抑制Th2细胞IL-13及TNF-α水平相关。本实验中,地塞米松组IL-4、IL-5、IL-13及 TNF-α水平明显下降,但其作用可能与其明显抑制D10细胞活性相关。
为进一步分析黄芪甲苷对D10细胞的作用,本研究检测了gata-3表达的变化。gata-3是Th2淋巴细胞分化成熟的关键转录因子,对Th2型细胞因子水平具有重要影响。本研究发现,黄芪甲苷高剂量组可明显抑制gata-3表达。研究认为gata-3可调控IL-13基因的转录表达,与其蛋白表达水平密切相关[12]。因此,黄芪甲苷降低IL-13水平,可能与其抑制gata-3水平相关。gata-3表达水平对IL-4、IL-5细胞因子也具有重要影响,但本实验中黄芪高剂量组IL-4及IL-5水平与ConA组无明显差异。一方面,细胞因子的表达水平受细胞内、外环境的影响,本实验采用ConA为促有丝分裂原,可选择性刺激T细胞增殖,因此IL-4及IL-5水平升高与D10细胞增殖密切相关,而gata-3水平的变化并未影响ConA促进细胞因子(IL-4及IL-5)的表达。黄芪甲苷可抑制IL-13水平,推测除抑制gata-3外,可能存在其它作用机制,有待进一步研究证实。另一方面,gata-3对IL-4及IL-5的调节首先表现在转录水平,故而进一步实验可检测黄芪甲苷对IL-4及IL-5mRNA水平的影响。
综上,本研究证实黄芪甲苷体外具有抑制Th2反应的作用,这可能是黄芪甲苷治疗哮喘的作用基础。至于黄芪甲苷调节gata-3表达机制,有待进一步研究。
参考文献:
[1] Romagnani S.The role of lymphocytes in allergic disease[J].J Allergy Clin Immunol,2000,105(3):399-408.
[2] Jin H,Luo Q,Zheng Y,et al.CD4+CD25+Foxp3+T cells contribute to the antiasthmatic effects of Astragalus membranaceus extract in a rat model of asthma[J].Int Immunopharmacol,2013,15(1):42-9.
[3] 杜 强,张 倩,沈 立,等.黄芪甲苷对慢性哮喘模型小鼠气道重塑的影响[J].中国药理学通报,2011,27(10):1430-4.
[3] Du Q,Zhang Q,Shen L,et al.Effects of astragaloside IV on airway remodeling in a murine model of chronic asthma[J].Chin pharmacol Bull,2011,27(10):1430-4.
[4] 商 蕾,曲章义,宁莉莉,等.黄芪甲苷体外抗腺病毒作用研究[J].中国药理学通报,2013,29(6):854-8.
[4] Shang L,Qu Z Y,Ning L L,et al.The anti-adenovirus effect of astragaloside IV in vitro[J].Chin Pharmacol Bull,2013,29(6):854-8.
[5] 柴丽娟,钟佩茹,周志焕,等.黄芪甲苷对体外神经干细胞增殖作用影响的研究[J].中国药理学通报,2010,26(5):670-3.
[5] Cai L J,Zhong P R,Zhou Z H,et al.Proliferation effects of astragaloside on neural atem cells in vitro[J].Chin Pharmacol Bull,2010,26(5):670-3.
[6] Gu X,Jiang D,Wang Y,et al.Effects of astragaloside IV on eosinophil activation induced by house dust mite allergen[J].Mol Med Rep,2012,6(1):115-20.
[7] Wang Y P,Li X Y,Song CQ,et al.Effect of astragaloside IV on T,B lymphocyte proliferation and peritoneal macrophage function in mice[J].Acta Pharmacol Sin,2002,23(3):263-6.
[8] Xu Q,Chai S J,Qian Y Y,et al.Breast regression protein-39(BRP-39)promotes dendritic cell maturation in vitro and enhances Th2 inflammation in murine model of asthma[J].Acta Pharmacol Sin,2012,33(12):1525-32.
[9] Gu X,Jiang D,Wang Y,et al.Effects of astragaloside IV on eosinophil activation induced by house dust mite allergen[J].Mol Med Rep,2012,6(1):115-20.
[10]Lai H Y,Rogers D F.Mucus hypersecretion in asthma:intracellular signalling pathways as targets for pharmacotherapy[J].Curr Opin Allergy Clin Immunol,2010,10(1):67-76.
[11]Brightling C,Berry M,Amrani Y.Targeting TNF-alpha:a novel therapeutic approach for asthma[J].J Allergy Clin Immunol,2008,121(1):5-10.
[12]Kishikawa H,Sun J,Choi A,et al.The cell type-specific expression of the murine IL-13 gene is regulated by GATA-3[J].J Immunol,2001,167(8):4414-20.