姜黄素衍生物C085与Hsp90及其不同片段相互作用以及对Hsp90 ATPase活性的影响
范莹娟,张连茹,刘 洋,许建华
(1.福建医科大学药学院,2.福建省天然药物药理学重点实验室,福建福州 350004;3.厦门大学生命科学学院,福建 厦门 361005)
Hsp90作为新型抗癌治疗靶位受到人们关注,因Hsp90客户蛋白在信号转导、细胞周期调控和凋亡路径中起重要作用,即Hsp90通过其受体多环节、多途径影响癌细胞生长和(或)存活[1]。通过干扰Hsp90的功能可调控多种肿瘤信号通路或细胞代谢途径,从而抑制肿瘤的增殖、转移等过程达到抗癌效果[2]。Hsp90具有ATP酶的活性,对其伴侣功能的发挥起着重要的作用[1]。Hsp90构象可发生改变,其ATP/ADP结合部位起着构象转换区的作用。因此,通过抑制Hsp90的ATPase活性,从而可以影响Hsp90的功能。
姜黄素是从中药材姜黄中提取的酚类化合物,姜黄素因其具有抗肿瘤、抗氧化、抗炎、降血脂等作用而毒性又很低受到重视,其直接抗癌活性尤为突出;姜黄素有着重要的经济价值[3]。然而,姜黄素水溶性差,其水溶液易水解,不稳定,体内吸收差、代谢快且其代谢产物失去活性、消除快,生物利用度低。因此限制了其在临床应用方面的发展[4]。姜黄素的化学结构是其发挥生物学作用的基础,以姜黄素为先导物对其结构进行修饰,合成大量姜黄素衍生物及其类似物,以全面研究姜黄素的构效关系,并希望可以改善姜黄素的生物学活性,提高姜黄素生物利用度。本实验室通过化学结构修饰合成了姜黄素衍生物 C085[4-(4-羟基-3-甲氧基苯亚甲基)姜黄素],化学结构如Fig 1所示。
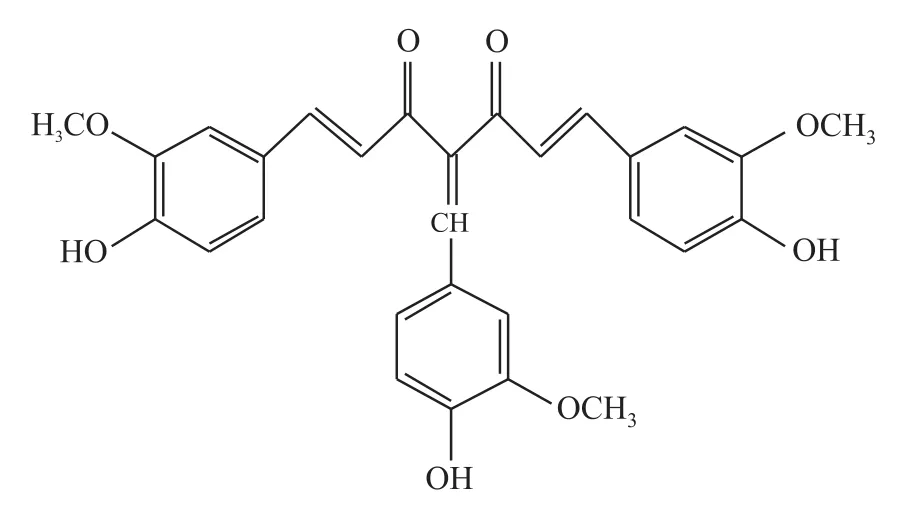
Fig 1 Structure of C085
本实验运用荧光光谱法,研究C085与Hsp90及其不同片段的相互作用,并且检测了C085对Hsp90 ATPase活性的影响。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 由厦门大学生命科学学院微生物药物实验室提供。
1.1.2 仪器与试剂 酶标仪(Varioskan Flash,美国Thermo Scientific公司);J2-21低温高速离心机(J2-HSCentrifuge,美国Beckman公司);电子分析天平(BN1385,上海民桥精密科学仪器有限公司);全温型多振幅轨道摇床(ZHWY-200H,上海智城分析仪器制造有限公司);立式压力蒸汽灭菌器(LDZX-50KBS,上海申安医疗器械厂);姜黄素衍生物C085由本实验室合成,经HPLC及薄层层析分析鉴定,纯度为95%以上。ATP(Sigma公司),二甲基亚砜(DMSO,国药集团化学试剂有限公司);硫酸卡那霉素,IPTG,钼酸铵四水,孔雀石绿,聚乙烯醇,咪唑等试剂购于上海生工生物工程有限公司。
1.2 方法
1.2.1 Hsp90的诱导表达及纯化 Hsp90融合蛋白全长,NHsp90,MHsp90和CHsp90的诱导、表达及纯化参见文献[5-6]。
1.2.2 荧光滴定 反应体系为5μmol·L-1Hsp90或其不同片段的PBS稀释液2 ml,置于荧光分光光度计中,滴加的方式,增加体系中抑制剂的含量,充分混匀后,并置于293K、303K、310K的环境下,激发波长为280 nm,记录290~510 nm的荧光光谱。抑制剂的溶度变化为 0、5、10、15、20、25、30、35、40、45、50μmol·L-1;同时记录△λ=15 nm和△λ=60 nm的同步荧光光谱,测定时荧光激发和发射狭缝均为 5 nm;重复测定 3次[7]。
1.2.3 Hsp90 ATPase活性抑制剂IC50确定 以已知的Hsp90抑制剂GA为阳性对照,2% (体积比)DMSO为阴性对照,空白对照为反应体系不加Hsp90。反应体系:不同浓度GA和C085溶于2%DMSO(体积比)中;Hsp90终浓度为 0.4μmol·L-1,ATP终浓度为 1 mmol·L-1,以上试剂均溶于Assay Buffer,反应体系为100μl。37℃,反应3 h,每组数据3次平行,加入80μl SolutionA[0.812 g·L-1的孔雀绿、23.2 g·L-1的聚乙烯醇、57.2 g·L-1的钼酸铵(含6mol·L-1HCl)和超纯水以体积比为2∶1∶1∶2比例混合],震荡反应后用酶标仪检测620 nm处的吸光度(OD620)值[5]。根据吸光度值计算各抑制剂的IC50值。

其中OD620是3组平行实验测定的OD620平均值;由软件计算出各抑制剂的IC50。
1.2.4 统计学分析 采用GraphPad Prism软件和Origin8.5软件进行实验数据分析,结果采用表示。
2 结果
2.1 C085与Hsp90的相互作用
2.1.1 C085对Hsp90内源荧光的淬灭作用 采用荧光光谱法分析C085对Hsp90内源荧光的淬灭作用,Hsp90的最大荧光发射峰在337 nm。随着C085的加入,Hsp90的内源性荧光强度发生有规律的减弱,意味着二者间可能发生相互作用。Hsp90的浓度为5μmol·L-1,Hsp90与药物的浓度比例从1∶1变化到1∶10。结果如Fig 2所示。
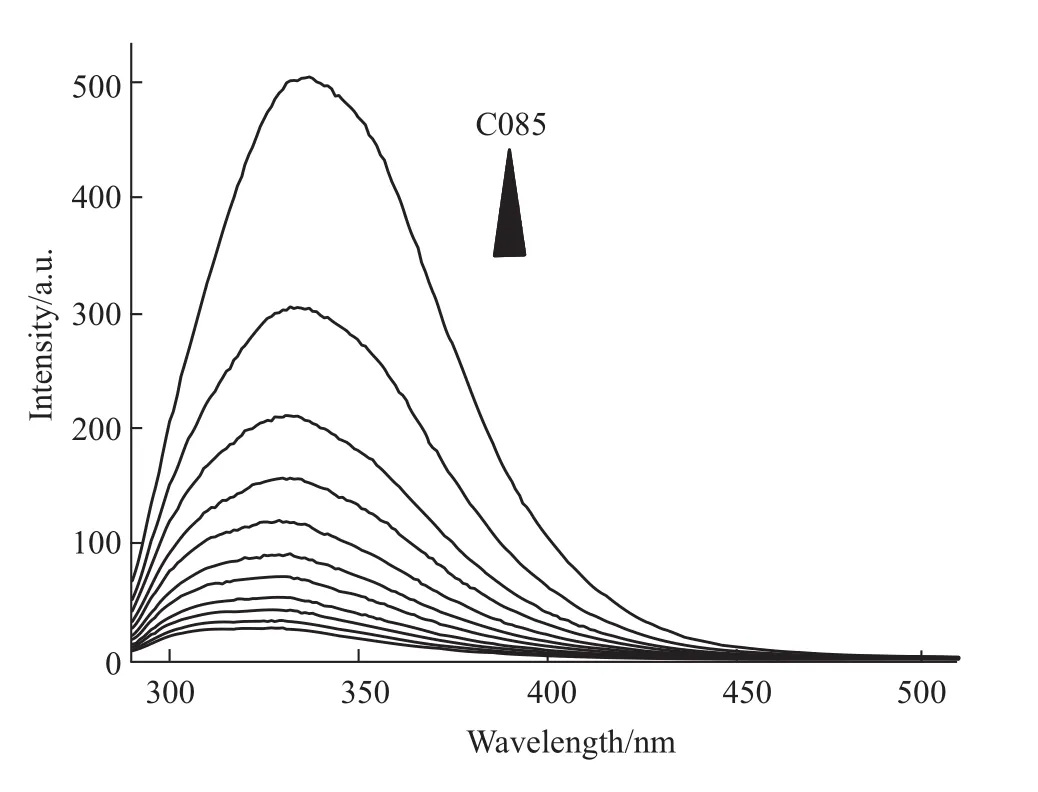
Fig 2 Quenching effect of C085 on Hsp90 endogenous fluorescent
假设Hsp90与C085以1∶1(摩尔比)的方式结合,则Hsp90荧光峰所在位置(337 nm)处荧光强度的改变值ΔF与游离的C085浓度[Q]有如下关系:ΔF=F0-F=△Fmax[Q]/KD+[Q];式中△Fmax为理想状态下,Hsp90被C085饱和后在337 nm处的荧光强度最大改变值,F0和F分别是不存在和存在C085时Hsp90溶液的荧光强度,[Q]是体系中C085的总浓度代替游离浓度,KD为解离常数。由Origin8.5软件对数据进行非线性拟合,结果如Fig 3。相关参数见Tab 1。
结果可知,C085与Hsp90间具有较强的相互作用。
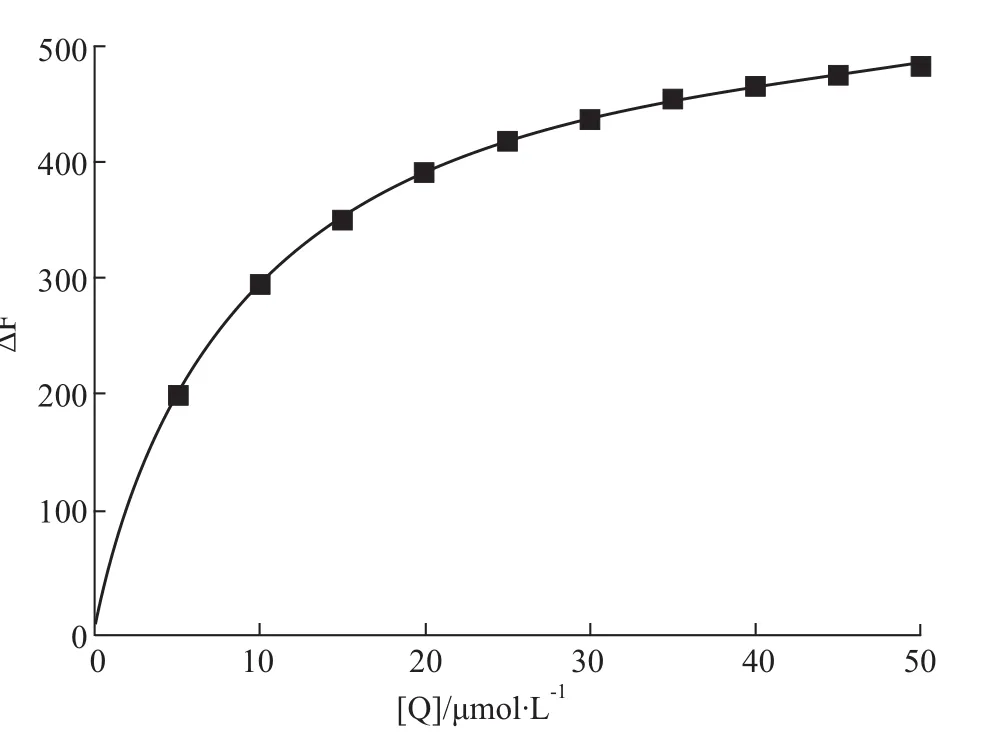
Fig 3 337nm,the change trend of Hsp90 fluorescence intensity w ith C085 concentration
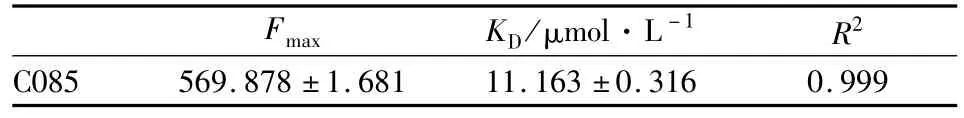
Tab 1 Dissociation constant K D value of C085
2.1.2 C085对Hsp90的淬灭常数 荧光淬灭通常分为动态淬灭和静态淬灭,可以运用Stern-Volmer方程:F0/F=1+KSV[Q]进行判断,式中 F0,F,[Q]如“2.1.1”表述,KSV是 Stern-Volmer淬灭常数,由下式定义:Ksv=Kq·τ0,Kq是双分子淬灭过程速率常数。τ0是生物大分子内源性荧光寿命值,为10-8s。由Origin8.5软件对数据进行拟合结果如Fig 4,相关参数见Tab 2。

Fig 4 Stern-Volmer plot for binding of C085 w ith Hsp90
各类淬灭剂对生物大分子的最大动态猝灭速率常数 Kq为 2.0×1010L·mol-1·s-1,而 C085对Hsp90的Kq数量级在1013,说明C085对 Hsp90的猝灭过程是由于形成复合物引起的静态猝灭。
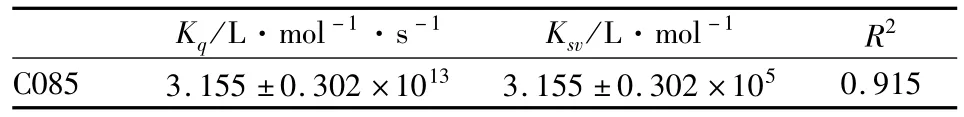
Tab 2 Stern-Volmer quenching constant KSV value and bimolecular quenching constant K q value of C085
2.1.3 C085与Hsp90结合常数与结合位点数 静态淬灭过程符合Lineweaver-Burk双倒数方程:lg F0-F/F=lg KA+n lg[Q],式中 F0,F,[Q]如“2.1.1”表述,KA是结合常数,n是结合位点数。数据用Origin8.5软件进行分析。结果如Fig 5,相关参数见Tab 3。
由C085与Hsp90的结合常数KA和结合位点数n,可知C085与Hsp90之间具有较强的结合作用。
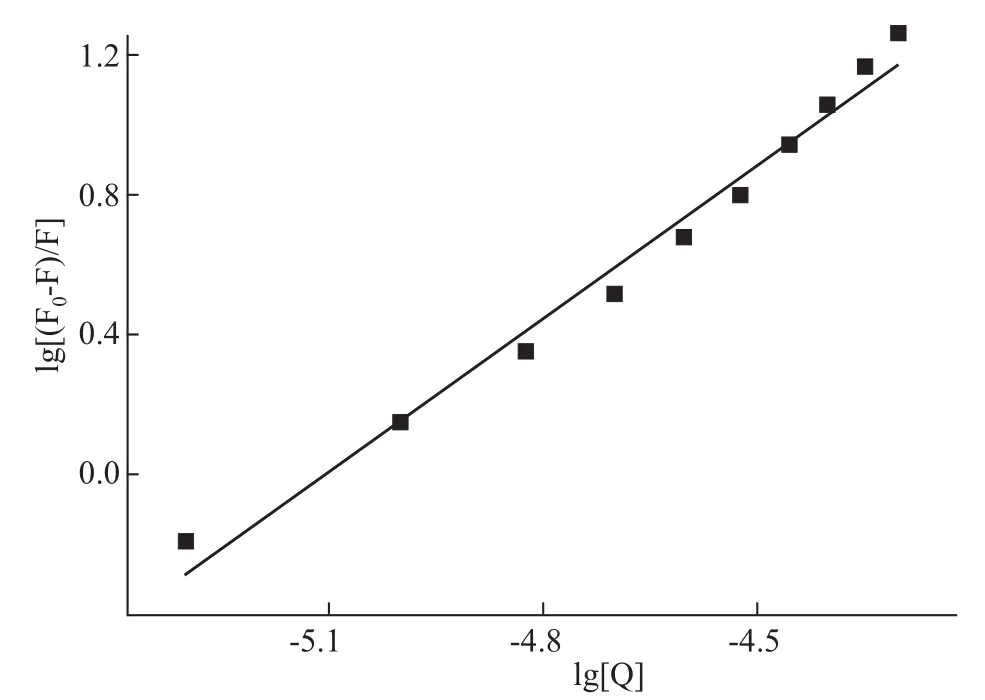
Fig 5 Lineweaver-Burk plot for binding of C085 with Hsp90

Tab 3 Binding constant K A value andbinding numbers n value of C085
2.1.4 C085与Hsp90作用力类型的确定 药物小分子与蛋白质等生物大分子之间的相互作用力包括氢键、范德华力、静电作用力、疏水作用力等。药物不同,与蛋白质作用力类型也不同,主要作用力可以通过体系的焓变与熵变来判断。当温度变化不大时,反应的焓变与可以看作一个常数,有公式:ln KD1/KD2=ΔHθ(1/T1-1/T2)/R;其中 R是热力学气体常数,取值为8.314 J·是热力学温度;KD是不同温度下对应的解离常数;ΔGθ是吉布斯自由能。根据两个温度下的热力学常数值可以计算出C085与Hsp90相互作用的热力学函数值,结果见Fig 6,相关参数见Tab 4。
根据反应前后热力学焓变ΔHθ和熵变 ΔSθ的相对大小,可以判断药物与蛋白质之间的主要作用力的类型[8]。据 Ross等提出的理论,当 ΔHθ<0,ΔSθ>0时生物大分子与生物小分子的结合性质表现为静电作用力,由结果可知,该体系中C085与Hsp90之间的主要作用力是静电作用力。为了进一步确定两者的作用力类型,运用同步荧光法研究C085对Hsp90构象的影响。
2.1.5 C085对Hsp90构象的影响 蛋白质的荧光主要来自酪氨酸、色氨酸残基,因此常用于同步荧光的研究。当Δλ=15 nm时,表现的是Hsp90中酪氨酸残基的同步荧光的光谱特性;当Δλ=60 nm时,表现的是Hsp90中色氨酸残基的同步荧光的光谱特性。结果如Fig 7。
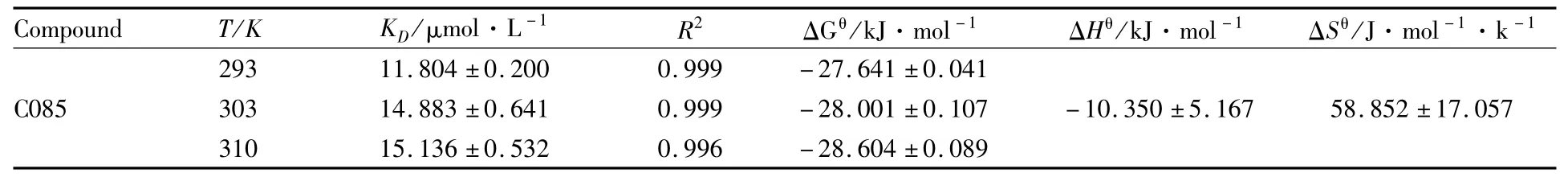
Tab 4 Dissociation constant KD values and thermodynam ic parameters of C085 at different tem peratures
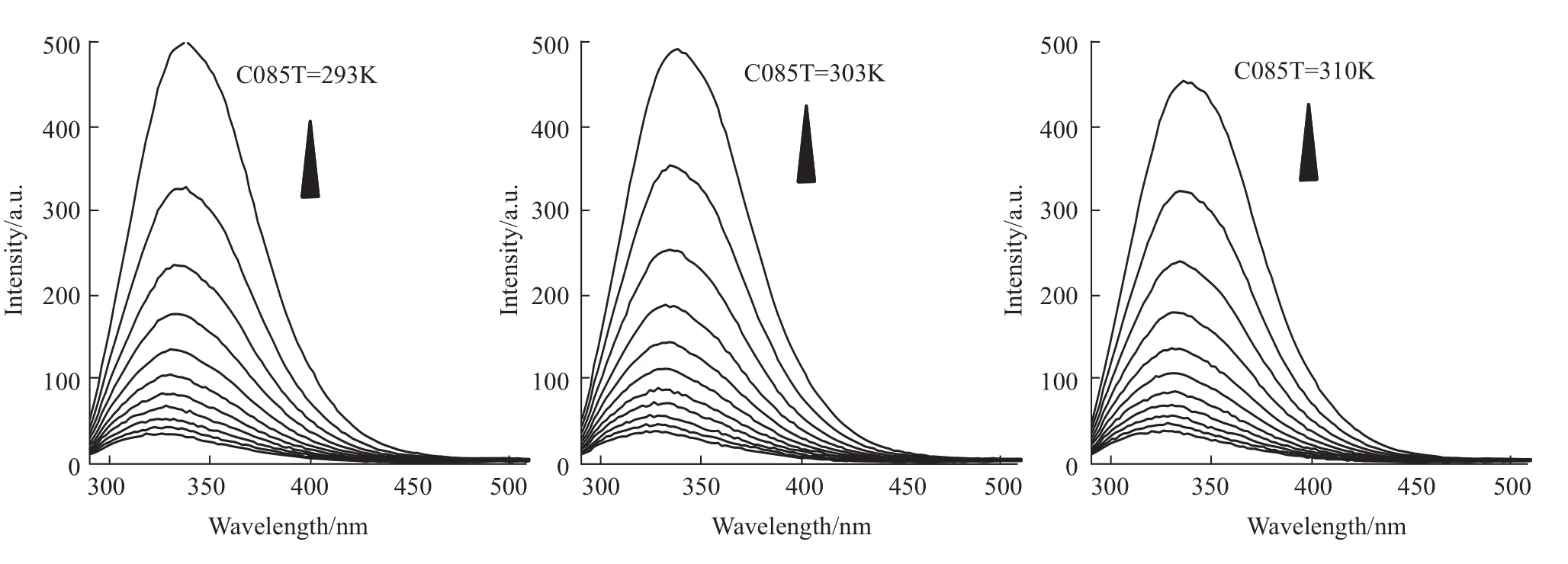
Fig 6 293K,303K,310K,quenching effect of C085 on Hsp90 endogenous fluorescent
蛋白质中酪氨酸残基和色氨酸残基的最大发射波长与其所处环境的极性有关,因此,根据最大发射波长的改变可以判断蛋白质构象的变化。由图可知,随着C085的加入,Hsp90中酪氨酸残基、色氨酸残基的同步荧光最大荧光发射波长基本不变,说明酪氨酸残基和色氨酸残基周围微环境没有发生明显改变,且未明显降低其所处的微环境疏水性,没有明显改变肽链伸展程度。这表明随着C085浓度的增加并没有使Hsp90中的酪氨酸、色氨酸残基的构象发生变化。这也就进一步确定了C085与Hsp90之间的主要作用力为静电作用力。
2.1.6 C085与Hsp90蛋白不同片段的相互作用为确定C085与Hsp90的结合区域,通过荧光滴定实验分析 C085与3个功能域(NHsp90、MHsp90、CHsp90)的结合情况,通过Origin8.5软件对数据进行拟合,结果如Fig 8,相关参数见Tab 5。

Tab 5 Dissociation constant K D values of C085
结果表明,相同实验条件下,C085与Hsp90的C端片段结合能力最强。
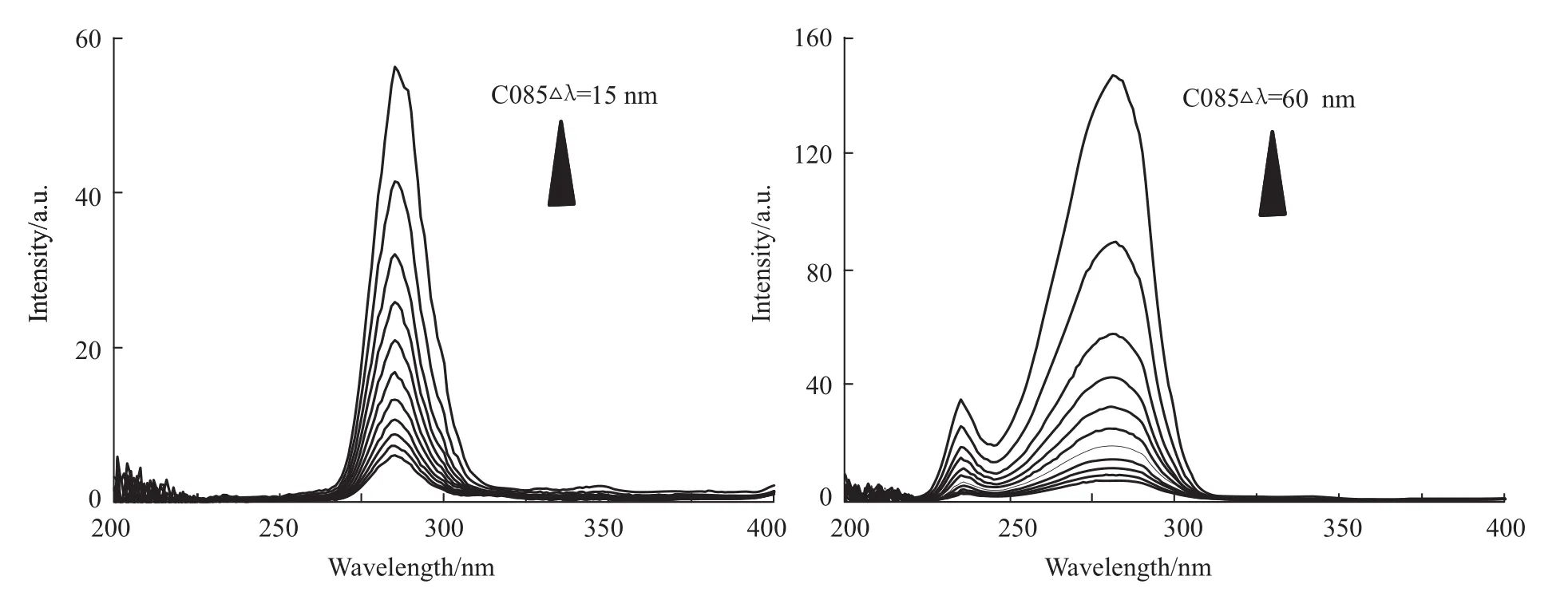
Fig 7 Synchronous fluorescence spectra of C085 with Hsp90
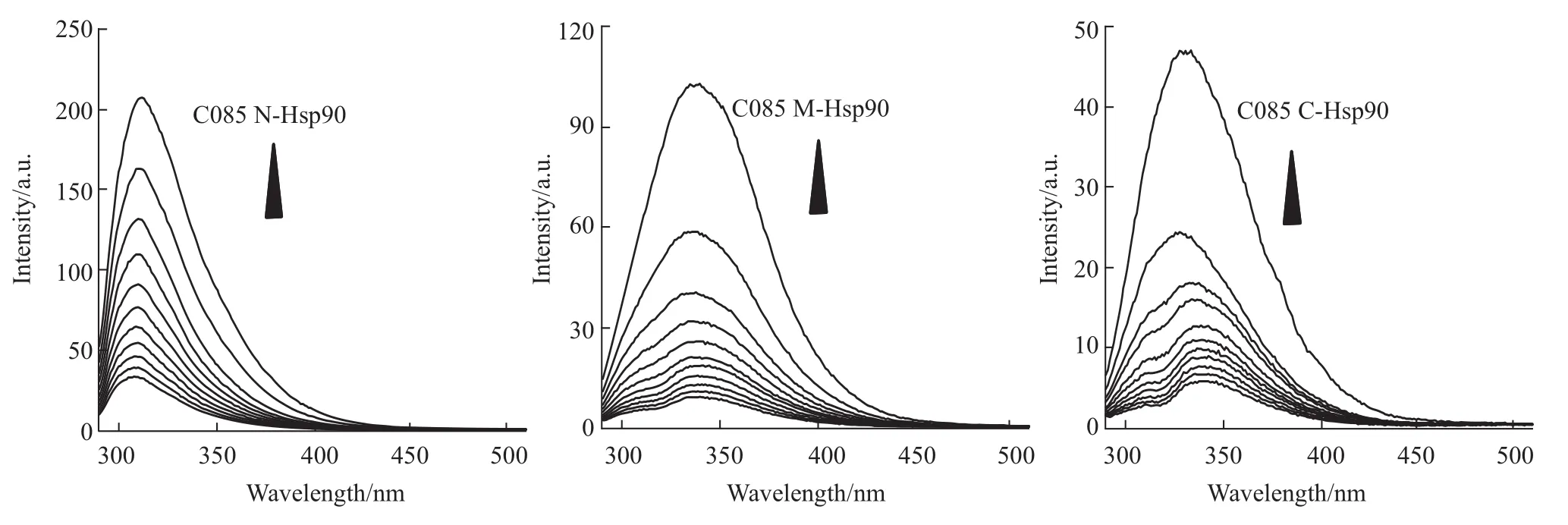
Fig 8 Quenching effect of C085 on NHsp90,MHsp90,CHsp90 endogenous fluorescent
2.2 Hsp90 ATPase活性抑制剂C085的IC50孔雀绿·磷钼酸铵无机磷检测法检测C085对Hsp90作用的量效关系,IC50值为6.04μmol·L-1,如 Fig 9所示。

Fig 9 Inhibitory rate of Hsp90 ATPase activity under different concentrations of C085
3 讨论
荧光淬灭指导致特定荧光物质分子的荧光强度降低和寿命减少的现象。在能量转移、配合物形成等过程中会发生荧光猝灭。因此,利用荧光光谱分析法可以求取解离常数,判定小分子有机化合物与蛋白质底物的亲和力大小,并可以进一步研究二者相互作用的机制。我们的研究结果表明,C085与Hsp90存在相互作用,分析其与Hsp90相互作用的机制;热力学常数和同步荧光表明,稳定 C085-Hsp90静态复合物的主要作用力为静电作用力。为进一步了解其在细胞内的作用机制以及药物开发奠定了基础。
Hsp90单体分成3个主要的结构域:N-末端结构、中间域(M)、C-末端结构。N端是 ATP/ADP的结合位点;M端主要是与客户蛋白或辅分子伴侣等底物多肽相结合,并且Hsp90 ATPase活性的产生依赖于与中间区域的接触;C端是Hsp90自身二聚化位点,钙调蛋白结合位点和靶蛋白结合位点[9]。运用荧光滴定的方法,研究C085与Hsp90、N-Hsp90,M-Hsp90和C-Hsp90之间的结合作用,通过解离常数,我们推断C085为Hsp90抑制剂且与C端片段结合能力更强。
Hsp90具有分子伴侣的功能,该功能的发挥受Hsp90与辅伴侣相互作用和Hsp90与ATP结合/水解所调节[10-12]。Hsp90的N端和C端都能与辅伴侣或ATP相互作用,从而调节其伴侣的功能[13-14]。在Hsp90的分子伴侣循环中,Hsp90通过结合和水解ATP而调节自身构象和功能。C085抑制Hsp90-ATPase活性,抑制其对ATP的水解作用。
Hsp90作为抗癌药物的分子靶点越来越受到人们的关注。大量的研究表明,抗癌药可以以Hsp90的多个位点作为进攻的靶点,而且对Hsp90功能的抑制的形式也可以是多样的。因此,以Hp90为靶点,寻找高效低毒的抗肿瘤药物,为肿瘤的治疗带来新的思路。对于Hsp90抑制剂干扰复杂的癌症过程机制的研究,已经成为癌症靶向性治疗的希望。我们的研究结果表明,C085可能是Hsp90抑制剂候选药物,与Hsp90之间具有较强的亲和力,抑制Hsp90-ATPase活性,从而抑制Hsp90的功能,达到抗肿瘤的作用。
参考文献:
[1] 王 绯,杨永平.HspP90抑制剂靶向治疗癌症研究进展[J].解放军医学杂志,2006,31(3):274-5.
[1] Wang F,Yang Y P.Research progress on Hsp90 inhibitors targeted cancer treatment[J].Med JChin PLA,2006,31(3):274-5.
[2] Jhaveri K,Taldone T,Modi S,etal.Advances in the clinical development of heat shock protein 90(Hsp90)inhibitorsin cancers[J].Biochim Biophys Act,2012,1823(3):742.
[3] Anand P,Thomas SG Kunnumakkara A B.Biological activities of curcumin and its analogues(Congeners)made byman and Mother Nature[J].Biochem Pharmacol,2008,76(11):1590-611.
[4] Aggarwal B B,Harikumar K B.Potential therapeutic effects of curcumin,the anti-inflammatory agent,againstneurodegenerative,cardiovascular,pulmonary,metabolic,autoimmune and neoplastic diseases[J].Int JBiochem Cell Biol,2009,41(1):40-59.
[5] 陈俊杰,郭秋菊,贺晓萌,等.基于Hsp90ATPase活性的抑制剂筛选模型研究[J].厦门大学学报(自然科学版),2010,9(5):711-6.
[5] Chen J J,Guo Q J,He X M,et al.Study on a screeningmodel for inhibitor of Hsp90 ATPase activity[J].J Xiamen Univ,2010,9(5):711-6.
[6] 范莹娟,许建华.姜黄素与 Hsp90相互作用以及对Hsp90ATPase活性的影响[J].中国药理学通报,2013,29(10):1426-31.
[6] Fan Y J,Xu JH.Interactions between curcumin and Hsp90 and effects of curcumin on Hsp90 ATPase activity[J].Chin Pharmacol Bull,2013,29(10):1426-31.
[7] 高平章,吴 洪,郭 婧,许亚妹.荧光光谱法研究灯盏花素与牛血清白蛋白相互作用[J].中国现代应用药学,2012,29(2):106-9.
[7] Gao P Z,Wu H,Guo J,Xu Y M.Study on the interaction between breviscapinum and bovine serum albumin by fluorescence spectrometry[J].Chin JMAP,2012,29(2):106-9.
[8] Ross PD,Subramaning S.Thermodynamics of protein association reactions:forces contributing to stability[J].Biochemistry,1981,20(11):3096-102.
[9] 孟 帅,山广志,李卓荣.Hsp90抑制剂的研究进展[J].中国抗生素杂志,2011,36(4):241-8.
[9] Meng S,Shan G Z,Li Z R.Recent progress in the study of Hsp90 inhibitors[J].Chin JAntibiot,2011,36(4):241-8.
[10]Wilhelmsson A,Cuthill S,Denis M,et al.The specific DNA binding activity of the dioxin receptor ismodulated by the 90 kd heat shock protein[J].EMBO J,1990,9(2):69-76.
[11]CatelliM G,Binart N,Jung-Testas I,etal.The common 90-kd protein componentof non-transformed steroid receptors is a heat-shock protein[J].EMBO J,1985,4(2):3131-5.
[12]Sanchez E R,Toft D O,Schlesinger M J,et al.Evidence that the 90-kD a phosphoprotein associated with the untransformed L-cell glucocorticoid receptor is a murine heat shock protein[J].J Biol Chem,1985,260(23):12398-401.
[13]Marcu M G,Schult TW,Neckers L M.Novobiocin and related coumarins and depletion of heat shock protein 90-dependent signaling proteins[J].JNat Cancer Instit,2000,92(3):242-8.
[14]Pratt W B.The Hsp90-based chaperone system:involvement in signal transduction from a variety of hormone and growth factor receptors[J].Proc Soc Exp Biol Med,1998,217(4):420-31.

