氧诱导新生小鼠视网膜病变中血管新生和氧应激相关基因表达的变化
余增洋,龚陈媛,张国庆,季莉莉
(1.上海中医药大学中药研究所中药标准化教育部重点实验室,中药新资源与质量标准综合评价国家中医药管理局重点研究室,上海市复方中药重点实验室,上海 201203;2.上海儿童医学中心,上海 200127)
随着新生儿护理条件的改善,早产儿存活率明显增加,然而这也导致了较高的早产儿视网膜病变(retinopathy of prematurity,ROP)的发病率。目前,ROP已成为严重威胁新生儿视力健康的一种疾病,由Smith等[1]建立的氧诱导新生小鼠视网膜病变模型(oxygen-induced retinopathy,OIR)成功复制了ROP的特点,在ROP研究中得到广泛应用。
OIR病理机制目前尚未明确,有诸多细胞因子和通路可能都参与其病变过程。目前认为,缺血、缺氧诱导视网膜血管异常增生是导致ROP的根本原因[2-4]。由缺氧诱导因子(hypoxia-inducible factor-1,HIF-1)介导表达的血管内皮生长因子(vascular endothelial growth factor,VEGF)是公认的具有明显促进微血管新生功能的生长因子[5];血小板衍生生长因子 (platelet-derived growth factor,PDGF)也具有促进微血管新生的功能[6-7]。然而,OIR过程中血管新生相关基因表达的变化缺乏较为系统的研究,同时OIR过程中VEGF及PDGF受体变化的研究相对较少。血管新生过程还涉及血管基底膜和细胞外基质的崩解,已知基质金属蛋白酶(matrixmetalloproteinases,MMPs)在其中发挥重要作用[8],本文中我们选取了MMPs的两个重要成员MMP2和MMP9,分别检测了其在OIR过程中的基因表达变化。此外,有研究发现缺氧诱导产生的氧化应激也参与ROP的发展过程中,高氧-复氧过程引起视网膜相对缺氧,增加ROS的产生,引起视网膜血管氧化损伤[9-10]。Nrf2是参与调控抵抗氧化应激的主要核转录因子。因此本论文在建立的新生小鼠OIR模型基础上,运用Real-time PCR技术观察了促血管新生相关的VEGF及其受体、PDGF及其受体,以及在降解细胞外基质起作用的MMP家族相关基因的表达情况;同时还检测了氧应激相关Nrf2及其调控的GCLC、GCLM基因的表达情况。
1 材料与试剂
1.1 实验动物 SPF级C57BL小鼠,♀♂各5只,8周龄,购自中国科学院上海实验动物中心[合格证号:SCXK(沪)2012-0002]。饲养于上海中医药大学动物实验中心,♀♂随机组合为5对进行繁殖,温度(22±1)℃,湿度(55±5)%,饲料与水消毒后自由摄取,12 h光暗循环。实验严格按照国家和上海中医药大学动物中心动物使用管理条例进行。
1.2 试剂 多聚甲醛、Triton X-100、Gelatin均购自国药试剂;CD31抗体、FITC conjugated anti-Rat IgG均购自 BD(Franklin Lakes,NJ);PrimeScript RTMaster Mix Perfect Real Time、SYBR Premix Ex Taq(Tli RNaseH Plus)(TaKaRa);用于 Real-Time PCR特异性引物序列见Tab 1,购自上海捷瑞公司。

Tab 1 Sequences of primers used for real-time RT-PCR
1.3 仪器 DYC-I型常压动物实验舱(中国船舶重工集团公司第七○一研究所);冷冻层析柜(北京德天佑公司);水平摇床(基因公司);解剖显微镜、倒置荧光显微镜(Olympus)、移液器、涡旋振荡仪、低温离心机(Eppendorf);Real-Time PCR仪(ABIStepone Plus)。
2 方法
2.1 OIR模型建立 C57BL小鼠出生后d 7(P7),随机分为正常组与缺氧组,每组10只。正常组小鼠饲养于正常氧环境中;缺氧组小鼠饲养于75.5%氧分压氧舱中,高氧环境5 d后,即d 12返回至正常氧环境中,继续饲养5 d,至17 d(P17)。
2.2 视网膜免疫荧光铺片 取P17小鼠处死,摘取眼球,于4%多聚甲醛(in PBS)中4℃固定过夜,于解剖显微镜下,用虹膜剪沿角膜边缘剪开,移除晶状体和玻璃体,取出完整视网膜,PBS洗2~3次,Blocking Buffer(5%BSA,0.5%Trixton X-100 in PBS)封闭2 h,与 CD31抗体于4℃ 孵育2 d,Wash Buffer(0.5%Trixton X-100 in PBS)洗6次,与二抗避光孵育2 h,Wash Buffer洗6次,剪视网膜成花瓣状,平铺于载玻片上,明胶(2 g·ml-1)固定并封片,于荧光显微镜下观察并拍照。
2.3 Real-Time PCR检测 P17小鼠脱颈椎法处死,摘取眼球,放置于 DEPC-treated Water中,于解剖显微镜下取出视网膜组织(若不立即进行后续实验,样本组织存放于-80℃)。运用TRIzol试剂(Invitrogen),提取视网膜组织总mRNA,总mRNA溶解于RNase-free H2O中,1μg总 mRNA按照试剂盒(TaKaRa)方法逆转录合成cDNA,Real-Time PCR扩增按照试剂盒(TaKaRa)方法,相对基因表达分析采用 2-ΔΔCt法。
2.4 数据分析 数据结果均用表示。实验数据采用SPASS 16.0软件统计,两两比较采用独立样本t检验。
3 结果
3.1 视网膜血管免疫荧光铺片 结果显示,P17正常组小鼠视网膜血管网以视盘为中心呈放射状向周围排列,血管密度分布均匀,走形自然,无血管闭塞(Fig 1 A、C、E)。OIR组小鼠视网膜视盘周围呈现大量无灌注区(Fig 1B);在无灌注区沿视网膜放射状动脉,箭头指示处可见明显新生血管芽(Fig 1D);视网膜周边区域血管密度明显增加,血管迂曲、扩张、变形、不规则,并可见微血管瘤(Fig 1F)。
3.2 VEGF及其受体的基因表达情况 结果显示,与正常组相比,OIR小鼠视网膜组织中 VEGFA、VEGFD的基因表达上调,VEGFB、VEGFC的基因表达未见变化;其相应受体家族中,VEGFR1、VEGFR2的基因表达上调,VEGFR3表达未见变化。见Fig 2。
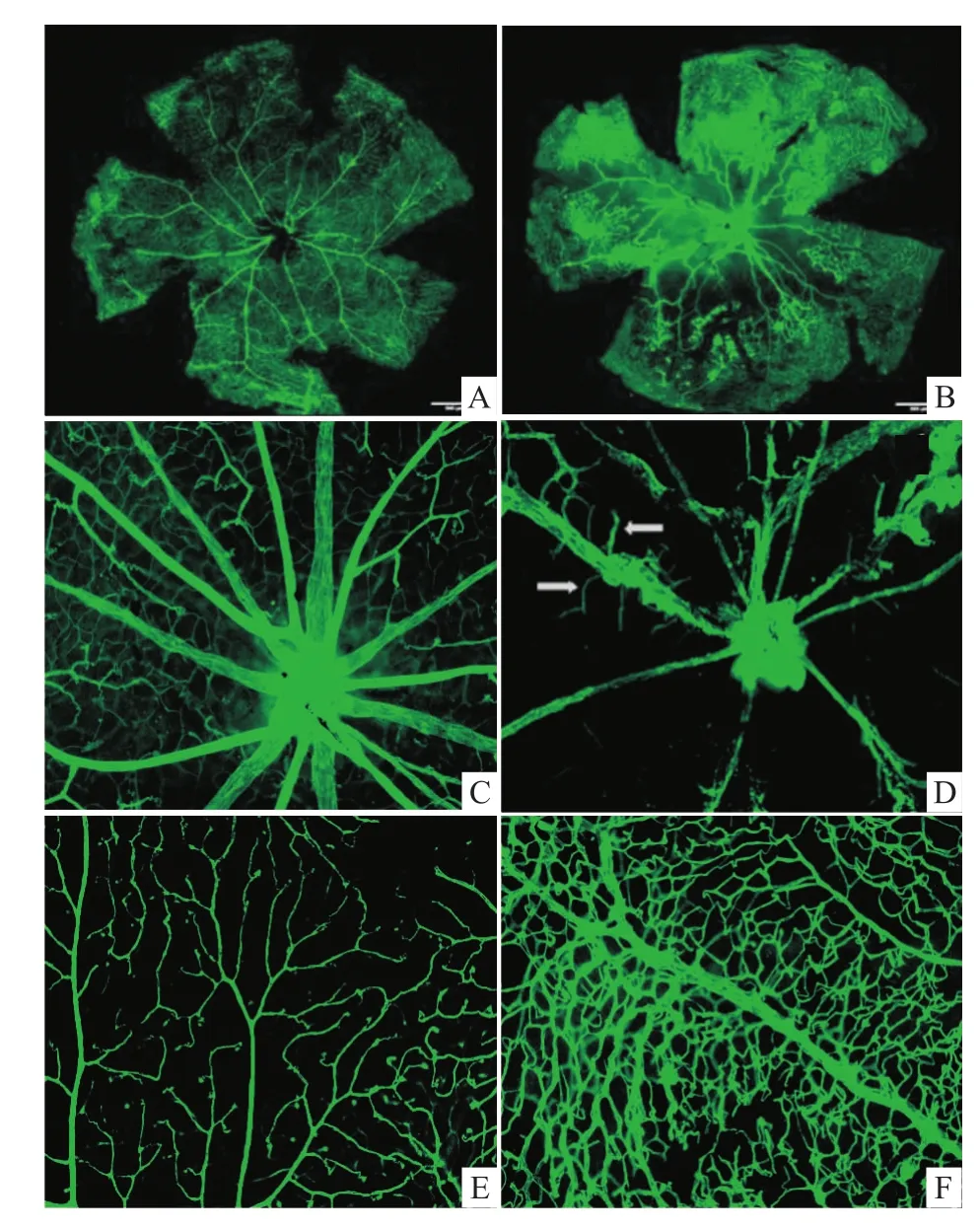
Fig 1 CD31 immunofluorescence staining of the retinasA:Whole retinas of control,B:Whole retinas of OIR model(4×magnification);C:The central region in retinas of control;D:The central region in retinas of OIR model.(Arrows indicate the new vessels)(10×magnification);E:The peripheral region in retinas of control;F:The peripheral region in retinas of OIRmodel(10×magnification).
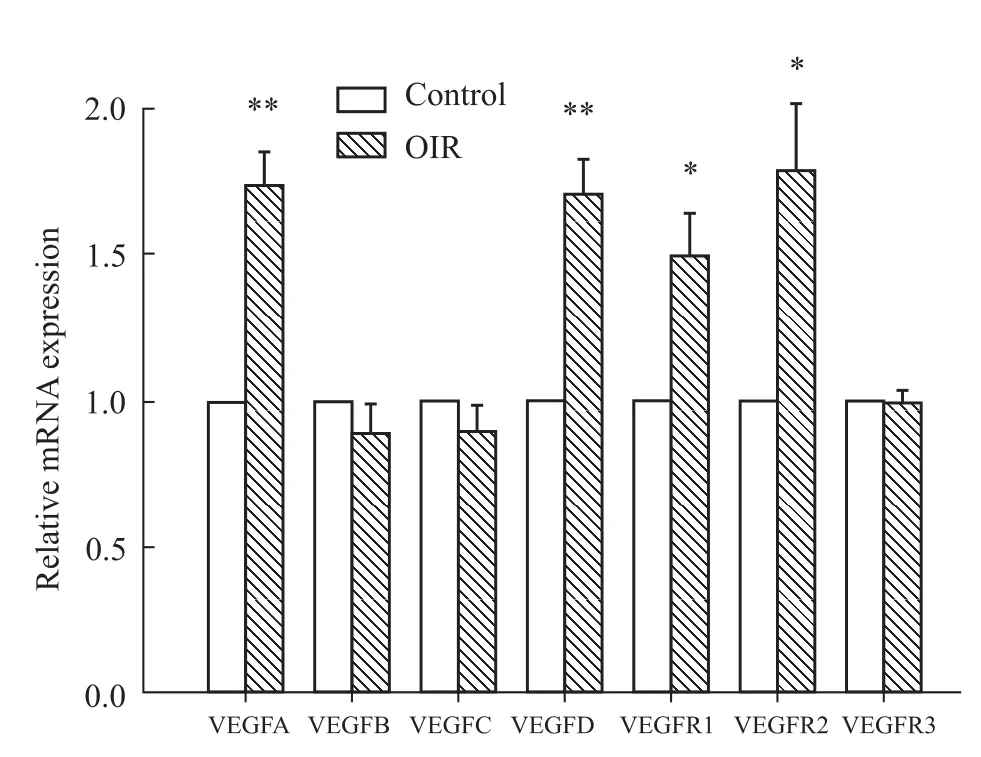
Fig 2 Retinal gene expression of VEGFs and VEGFRs in control and OIR m ice*P<0.05,**P<0.01 vs control.
3.3 PDGFs及其受体基因表达情况 PDGF是另一个重要的促进血管新生因子家族,我们的结果显示,与正常组相比,OIR小鼠视网膜组织PDGFA、PDGFB及其受体PDGFRa、PDGFRb的基因表达均呈现上调,尤其是PDGFB上调更为明显,显示出PDGFB可能在OIR模型中发挥促进血管新生的重要作用。见Fig 3。
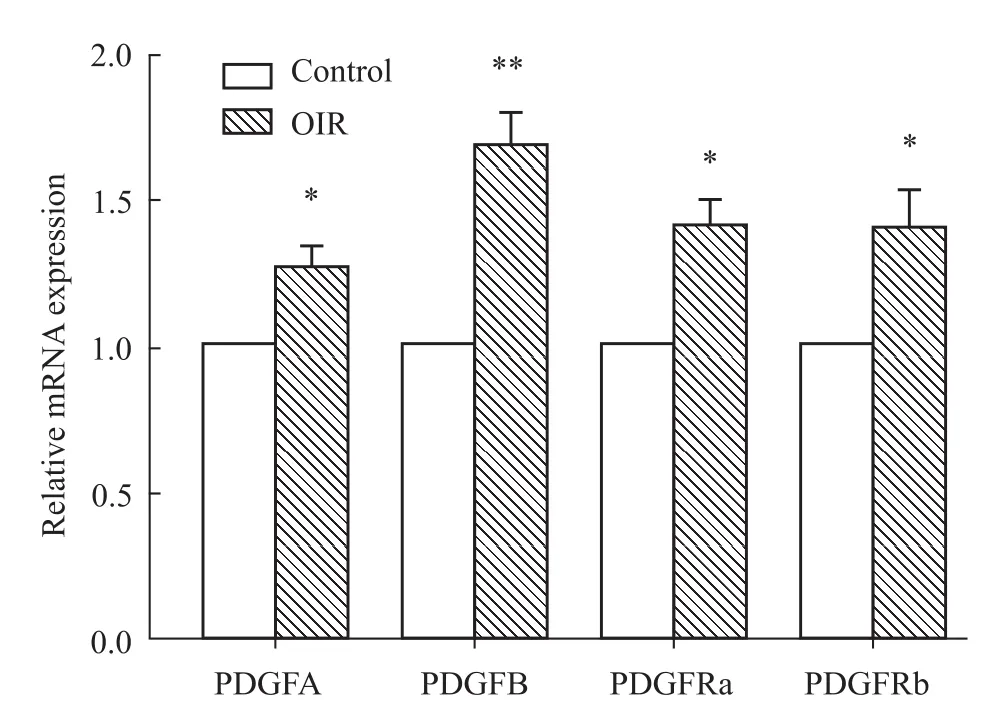
Fig 3 Retinal gene expression of PDGFs and PDGFRs in control and OIR m ic*P<0.05,**P<0.01 vs control.
3.4 MMP2与MMP9基因表达情况 MMPs调节细胞外基质降解,以促进血管内皮细胞迁移和新生血管形成。我们的结果显示,与正常组相比,OIR小鼠视网膜组织MMP2基因表达上调,但MMP9基因表达下调。说明MMP2可能在OIR小鼠视网膜降解血管基底膜,促进内皮细胞迁移和新生血管形成方面起重要作用。见Fig 4。

Fig 4 Retinal gene expression of MMP2 and MMP9 in control and OIR m ice*P<0.05,**P<0.01 vs control.
3.5 抗氧化相关基因表达情况 我们检测了在氧应激中具有重要调控作用的核转录因子Nrf2及其所调控的下游基因GCLC和GCLM的表达情况。结果显示,OIR小鼠视网膜组织中 Nrf2、GCLC及GCLM的基因表达均下调。见Fig 5。
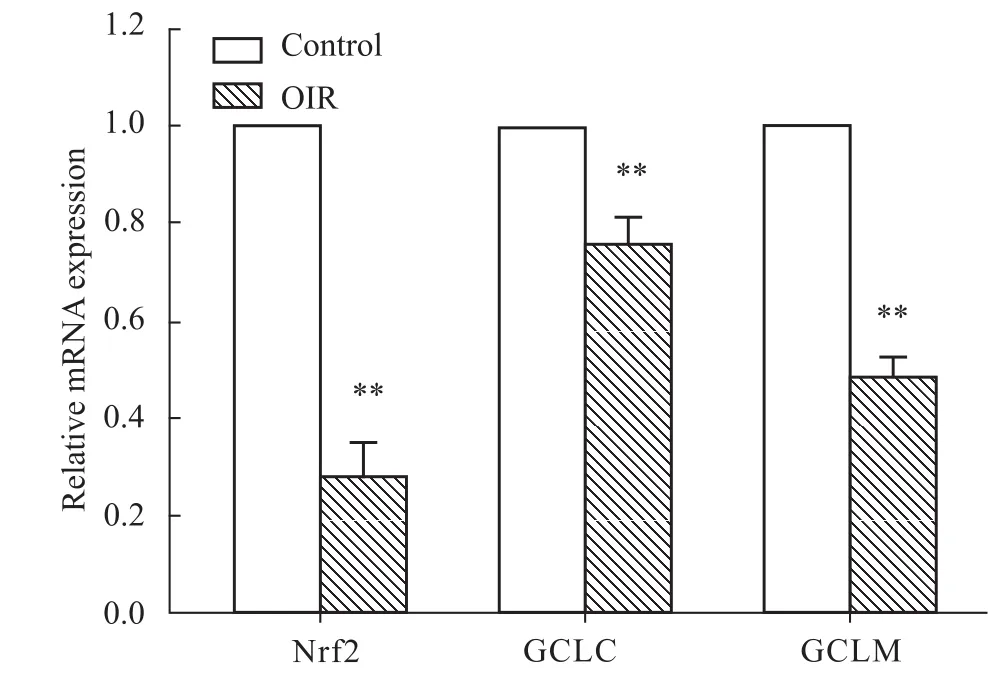
Fig 5 Retinal gene expression of Nrf2,GCLC andGCLM in control and OIR m ice**P<0.01 vs control.
4 讨论
ROP已成为导致婴儿失明的主要原因,占中等发达国家儿童致盲原因的6%-18%[11],临床上尚无理想的治疗方法和药物。我们采用由Smith等[1]所建立的方法,新生小鼠由于视网膜血管床未发育完全,放入高氧环境中血管停止生长,再返回正常氧环境后,相对缺氧状态诱导视网膜血管异常新生。在本实验中,我们成功制备了OIR模型,为治疗ROP的药物筛选建立了平台。并对参与引起微血管新生的一些关键信号分子的基因表达情况进行了检测,这些为我们后期药物靶向治疗及相应药理研究奠定了前期基础。
VEGF家族包括 VEGFA、VEGFB、VEGFC、VEGFD;VEGF受体包括 VEGFR1、VEGFR2、VEGFR3;VEGFs通过与VEGFRs结合发挥作用。VEGFA即一般所指的VEGF,是机体内最重要的促血管生成因子,可与VEGFR1及VEGFR2结合。现在认为,VEGFA主要通过与VEGFR2结合来发挥促血管新生的作用;相反,VEGFR1与VEGFA结合后可抑制VEGFR2对VEGFA的激活作用[12]。VEGFR1的作用可能不是表现在直接促进血管新生,而是通过特异性促进血管组织释放生长因子,间接促进血管新生[13]。我们的实验结果发现在OIR模型中视网膜中VEGFA和其受体VEGFR1、VEGFR2的表达均明显增加,说明它们在ROP病变过程中具有一定的作用。VEGFD是重要的促进淋巴内皮细胞增殖的生长因子,它主要和淋巴管内皮细胞上VEGFR3结合发挥作用[14-15]。我们的实验结果发现,VEGFD表达有所增加,但是其受体的表达并未见明显增加,因此VEGFD在ROP中的作用有待进一步深入研究。有研究表明,缺氧刺激下,VEGFB、VEGFC基因表达并未增加[16],我们的结果印证了这一点。
血小板衍生生长因子家族PDGFs同VEGF有较大同源性,是另一种重要的促血管生成因子[6-7],主要包括 PDGFA和 PDGFB,其受体是 PDGFRa、PDGFRb。我们的结果显示,缺氧刺激下,PDGFA、PDGFB、PDGFRa、PDGFRb基因表达均上调,说明PDGFA和PDGFB在ROP病变中起重要作用。
MMPs在调节视网膜血管细胞外基质降解,促进内皮细胞迁移中起重要作用[8]。我们的结果显示,相对缺氧刺激下,MMP2基因表达上调,而MMP9基因表达下调。体外实验上,有报道显示,猴视网膜内皮细胞RF/6A在缺氧刺激下,MMP2基因表达上调,而MMP9基因表达下调,这与我们体内实验的结果一致[17]。说明缺氧刺激通过上调MMP2而非MMP9表达,进而发挥降解细胞外基质的作用。
已有研究发现氧化应激在缺氧诱导视网膜微血管增殖性病变中起重要作用[9-10]。核转录因子Nrf2是细胞防御过氧化应激的重要调节因子。Nrf2结合到基因抗氧化应激反应元件(antioxidant responsive element,ARE)的启动子序列上,可启动一系列抗氧化基因的表达,其中主要包括 GCLC,GCLM。我们的结果显示,与正常组相比,OIR小鼠视网膜组织中Nrf2、GCLC、GCLM的基因表达均下调。说明缺氧刺激下,OIR小鼠视网膜组织抗氧化能力下调,提示氧化应激参与了缺氧诱导小鼠视网膜病变的过程。
综上所述,正常机制状态下,视网膜组织内部维持动态的平衡,包括促血管生成与抑制血管生成之间、氧化应激的产生与抵抗氧化应激之间等等。通过我们建立的OIR模型的研究,我们发现当受到外界缺氧刺激,打破了视网膜组织内部这些平衡,就会导致其朝向促进血管新生、降低抵抗氧应激能力的方面发展。
参考文献:
[1] Smith L E,Wesolowski E,McLellan A,et al.Oxygen induced retinopathy in themouse[J].InvestOphthalmol Vis Sci,1994,35(1):101-11.
[2] Heckmann M.Pathogenesis of retinopathy of prematurity[J].Ophthalmologe,2008,105(12):1101-7.
[3] Chen J,Smith L E.Retinopathy of prematurity[J].Angiogenesis,2007,10(2):133-40.
[4] Chen J,Michan S,Juan A M,et al.Neuronal sirtuin1 mediates retinal vascular regeneration in oxygen-induced ischemic retinopathy[J].Angiogenesis,2013,16(4):985-92.
[5] Ferrara N.Vascular endothelial growth factor:basic science and clinical progress[J].Endocr Rev,2004,25(4):581-611.
[6] Edqvist PH,Niklasson M,Vidal-Sanz M,et al.Platelet-derived growth factor over-expression in retinal progenitors results in abnormal retinal vessel formation[J].PLoS One,2012,7(8):e42488.
[7] Wilkinson-Berka JL,Babic S,De Gooyer T,et al.Inhibition of platelet-derived growth factor promotes pericyte loss and angiogenesis in ischemic retinopathy[J].Am J Pathol,2004,164(4):1263-73.
[8] Noda K,Ishida S,Shinoda H,et al.Hypoxia induces the expression of membrane-type 1 matrix metalloproteinase in retinal glial cells[J].InvestOphthalmol Vis Sci,2005,46(10):3817-24.
[9] Li SY,Fu Z J,Lo A C.Hypoxia-induced oxidative stress in ischemic retinopathy[J].Oxid Med Cell Longev,2012,2012:426769.
[10]Dong A L,Xie B,Shen JK,etal.Oxidative stress promotes ocular neovascularization[J].JCell Physiol,2009,219(3):544-52.
[11]Gilbert C,Rahi J,Eckstein M.Retinopathy of prematurity inmiddle income countries[J].Lancet,1997,350(9070):12-4.
[12]Kendall R L,Thomas K A.Inhibition of vascular endothelial cell growth factor activity by an endogenously encoded soluble receptor[J].Proc Natl Acad Sci,1993,90(22):10705-9.
[13]LeCouter J,Moritz D R,Li B,et al.Angiogenesis-independent endothelial protection of liver:role of VEGFR-1[J].Science,2003,299(5608):890-3.
[14]Bahram F,Claesson-Welsh L.VEGF-mediated signal transduction in lymphatic endothelial cells[J].Pathophysiology,2010,17(4):253-61.
[15]Choi JH,Oh Y H,Park YW,etal.Correlation of vascular endothelial growth factor-D expression and VEGFR-3-positive vessel density with lymph nodemetastasis in gastric carcinoma[J].JKorean Med Sci,2008,23(4):592-7.
[16] Enholm B,Paavonen K,Ristim ki A,et al.Comparison of VEGF,VEGF-B,VEGF-C and Ang-1 mRNA regulation by serum,growth factors,oncoproteins and hypoxia[J].Oncogene,1997,14(20):2475-83.
[17]Ottino P,Finley J,Rojo E,etal.Hypoxia activatesmatrixmetalloproteinase expression and the VEGF system in monkey choroidretinal endothelial cells:Involvement of cytosolic phospholipase A2 activity[J].Mol Vis,2004,10:341-50.

