BIX-01294对M olt-4细胞增殖、凋亡及组蛋白甲基化的影响
黄小红,马旭东,黄轶群,许云禄
(1.福建医科大学附属漳州市医院药学部,福建漳州 363000;2.福建医科大学药学院,福建福州 350004)
组蛋白甲基化是由特异的组蛋白甲基转移酶及去甲基化酶协同催化完成,是一个可逆的动态修饰过程。G9a是常染色质主要的 H3K9甲基转移酶[1]。G9a基因被破坏后常染色质区的H3K9甲基化水平明显降低[2],而H3K9甲基化在异染色质形成、基因印记、X染色体失活和转录调控等方面发挥重要作用[3],近年来研究发现,G9a的异常表达所致的H3K9甲基化失平衡在肿瘤的发生发展中起着重要的作用[4]。
BIX-01294是一种人工合成的选择性G9a抑制剂,研究表明BIX-01294抑制G9a活性,使组蛋白H3K9二甲基化水平降低,染色质空间结构发生变化,抑癌基因的重新表达,诱导肿瘤细胞凋亡及周期阻滞[5]。本研究以急性T淋巴细胞性白血病Molt-4细胞株为模型,研究BIX-01294诱导急性淋巴细胞白血病凋亡及抑制增殖的作用及其机制,为急性淋巴细胞性白血病的治疗提供新的思路。
1 材料与方法
1.1 主要试剂 BIX-01294购自美国Gene公司,以DMSO溶解配制10 mmol·L-1,0.22μm微孔滤膜正压过滤后-20℃保存。
1.2 材料 胎牛血清购自杭州四季青生物制品公司,Annexin V/PI双染试剂盒购自美国 BD公司;MTT(浓度为5 g·L-1)及DMSO均购自美国Sigma公司;Bcl-2、Caspase-3、Bax、组 蛋 白 H3K9me1、H3K9me2、H3K9me3、H3K27me1、H3K27me2、Act-H3、P15、DNMT1、β-actin鼠抗人单克隆抗体购自美国Upstate公司;Goat anti-mouse with HRP conjugate二抗及Western blot化学发光工作液均购自美国Santa Cruz公司。
1.3 细胞系、细胞培养 人类急性T淋巴细胞性白血病Molt-4细胞株,购自中科院上海细胞库,用含15%胎牛血清、2 mmol·L-1左旋谷氨酰胺的 RPMI 1640培养液置 37℃、饱和湿度、5%CO2培养箱培养,细胞呈悬浮生长,每2~3 d传代1次,实验前经台盼蓝拒染法检测细胞活力。
1.4 绘制生长曲线 取对数生长期细胞,将其浓度调整为1.0×108·L-1,接种于96孔细胞培养板,每孔100μl,实验组分别加入BIX-01294,使终浓度为0、1、2、4、8μmol·L-1,每组设 6个平行孔,37℃、饱和湿度、5%CO2培养箱培养24、48、72 h后,加5 g·L-1MTT(Sigma)10μl,继续培养 4 h,离心后小心吸去上清,每孔加100μl DMSO(Sigma),充分震荡混匀,在酶标仪上用双波长492 nm和630 nm测吸光度(A值),以0μmol·L-1为对照计算细胞增殖率。细胞增殖率/%=(A实验-A空白)/(A对照-A空白)×100%,试验重复3次。
1.5 流式细胞仪分析细胞凋亡 用含15%胎牛血清的RPMI 1640培养基接种于75 ml培养瓶,每瓶接种2×106细胞,细胞浓度为2×108·L-1,经不同浓度的BIX-01294处理24 h后,室温离心(1 000 r·min-1×5 min)收集细胞。按照BD公司Annexin V和PI双染试剂盒说明书处理后,立即行流式细胞术检测。
1.6 W estern blot检测细胞凋亡、组蛋白调控相关蛋白 收集经药物处理后的细胞,TBS洗涤后,吸干洗涤液,按1×106细胞/100μl裂解液+1μl酶抑制剂的比例裂解细胞;低温(4℃)1 200 r·min-1离心10 min,吸取中间清亮层,Bradford法进行蛋白定量。取备用蛋白,以12%SDSPAGE电泳分离,电转移法转膜,室温下摇床封闭1 h;加入用TBS(根据目的蛋白调整稀释倍数)稀释的一抗,Bcl-2、pro-Caspase-3、Bax、P15、DNMT稀释倍数为1∶400;组蛋白 甲 基 化 H3K9me1、H3K9me2、H3K9me3、H3K27me1、H3K27me2、Act-H3稀释 倍数 均 为1∶1 000;4℃孵育过夜,TBS洗涤液洗膜后分别加入辣根过氧化物酶标记的二抗(1∶2 000),室温下孵育1 h;TBS洗膜后加入化学发光工作液,在X射线胶片 (KODAK)上曝光,以 β-αctin为内参,用AlphaDigiDoc图像分析软件进行分析比较。
1.7 统计学分析 采用 SPSS 17.0统计处理软件分析。常规进行方差齐性检验,正态性检验。计量资料实验数据以表示。单变量两组资料之间的比较采用t检验,多组资料之间的比较采用单因素方差分析;方差不齐采用非参数检验。
2 结果
2.1 BIX-01294抑制急性T淋巴细胞白血病M olt-4细胞增殖 1、2、4、8μmol·L-1BIX-01294处理 24 h后,Molt-4细胞的增殖率分别为(86.06±4.35)%、(65.43±4.21)%、(46.23±3.17)%、(12.56±1.34)%,随药物浓度的增加增殖率下降,与对照组比较(99.15±3.23)%有统计学意义(P<0.05)。经 4μmol·L-1BIX-01294作用 0、24、48、72 h后,Molt-4细胞的增殖率分别为(99.06±2.83)%、(46.23±3.17)%、(40.45±3.24)%、(21.06±2.54)%,即随药物作用时间的延长增殖率也逐渐下降,P<0.05,差异有统计学意义(见Fig 1)。
2.2 BIX-01294诱导急性T淋巴细胞白血病M olt-4细胞凋亡 0、1、2、4μmol·L-1BIX-01294作用Molt-4细胞24h后,凋亡率分别为(5.54±1.35)%、(10.24±2.26)%、(32.28±3.26)%、(47.52±4.37)%,随药物浓度的增加,凋亡率逐渐上升,F=23.74,P<0.05,差异有统计学意义(Fig 2)。

Fig 1 Proliferation inhibition rates of M olt-4 cells treated w ith various concentrations of BIX-01294*P<0.05 vs0μmol·L-1
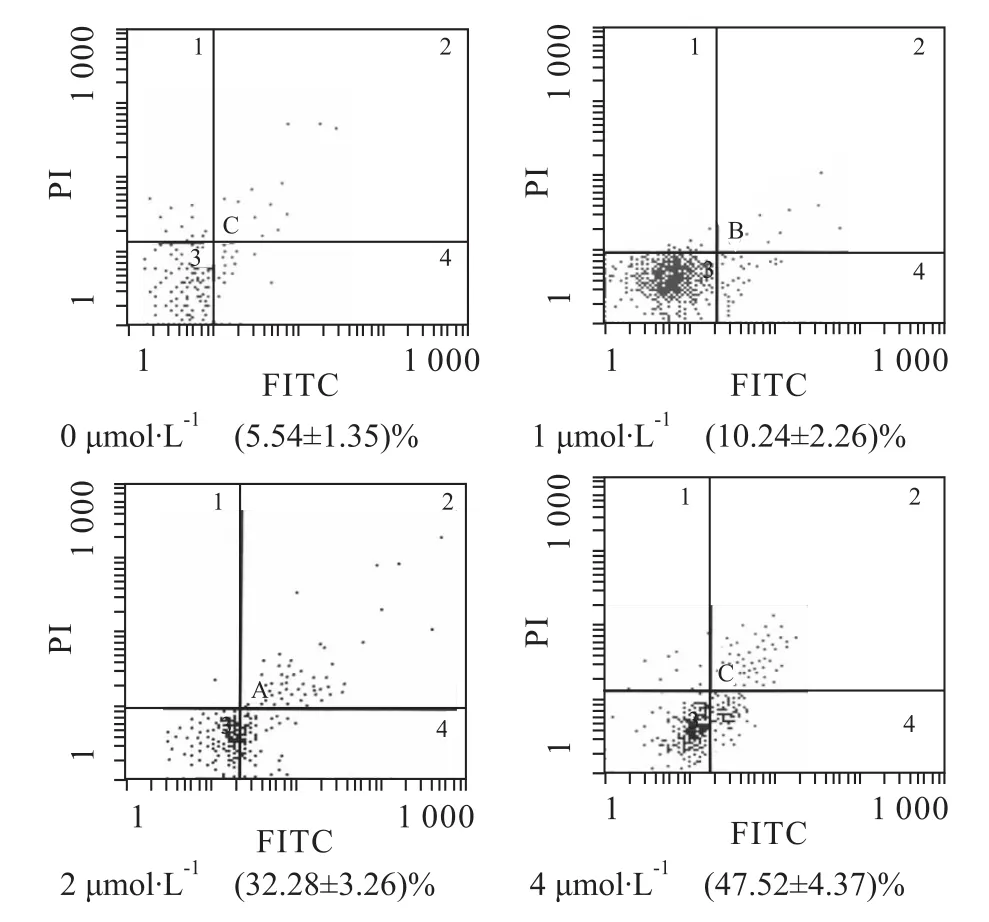
Fig 2 Apoptosis rates of Molt-4 cells treated with various concentrations of BIX-01294
2.3 BIX-01294对Molt-4细胞凋亡相关蛋白的影响
上述不同浓度BIX-01294处理Molt-4细胞24h后,提取总蛋白经过Western blot检测和Alpha Digi Doc图像分析软件进行分析比较,凋亡抑制蛋白Bcl-2的表达下调,促凋亡蛋白Bax及凋亡执行蛋白Caspase-3的表达上调,各组条带灰度值与β-actin比值与对照组比较,P<0.05,差异有统计学意义(Fig 3)。
2.4 BIX-01294对Molt-4细胞P15、DNMT1表达的影响 BIX-01294处理Molt-4细胞24 h后,P15蛋白呈浓度依赖性表达上调,P<0.05,差异有统计学意义。进一步研究发现DNMT1表达呈浓度依赖性逐渐减弱,P<0.05,差异有统计学意义(Fig 4)。
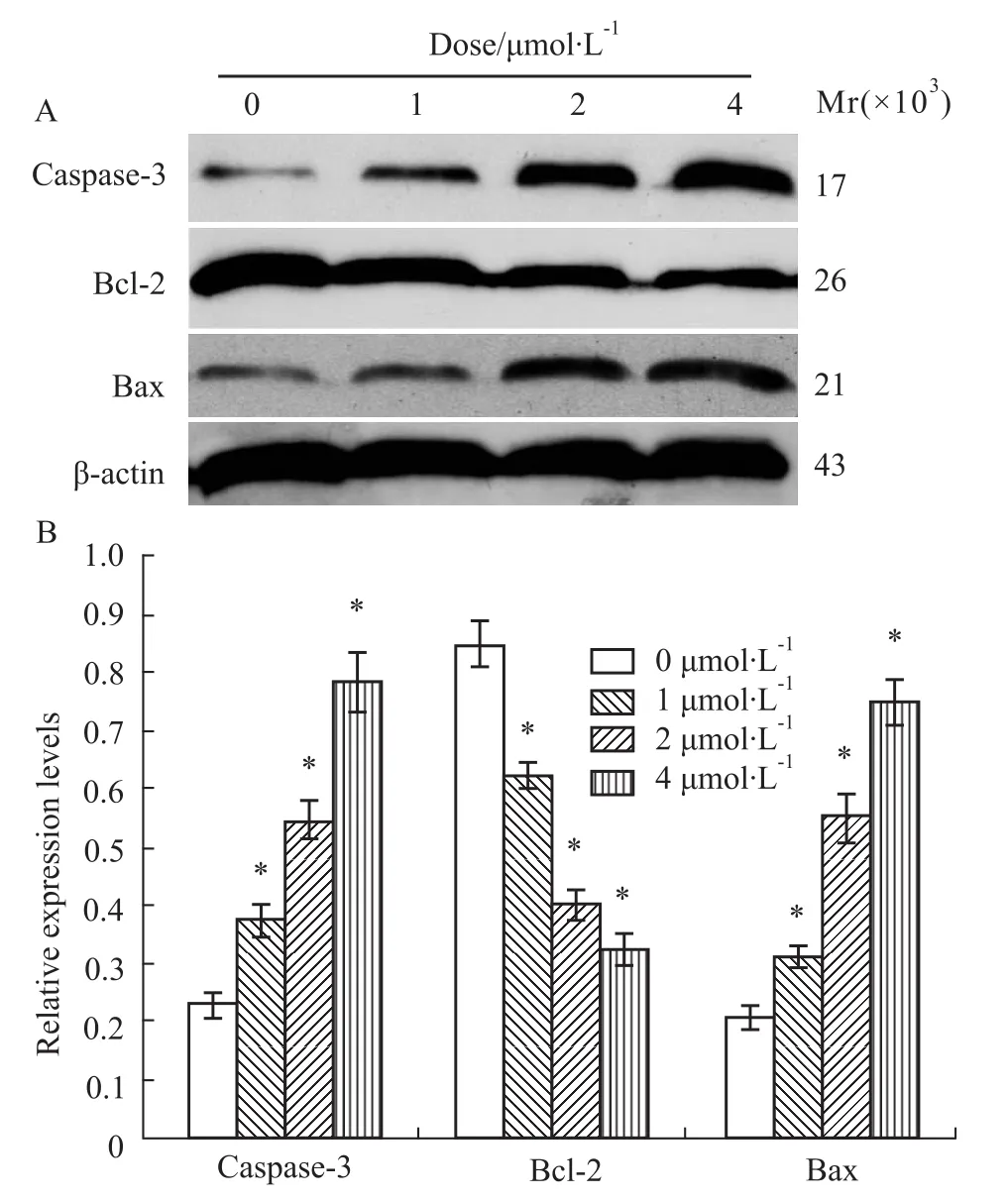
Fig 3 Apoptosis-related proteins in M olt-4 cells treated w ith BIX-01294 for 24 hourA:Protein electrophoresis;B:Proteins relative density.*P<0.05 vs0μmol·L-1.
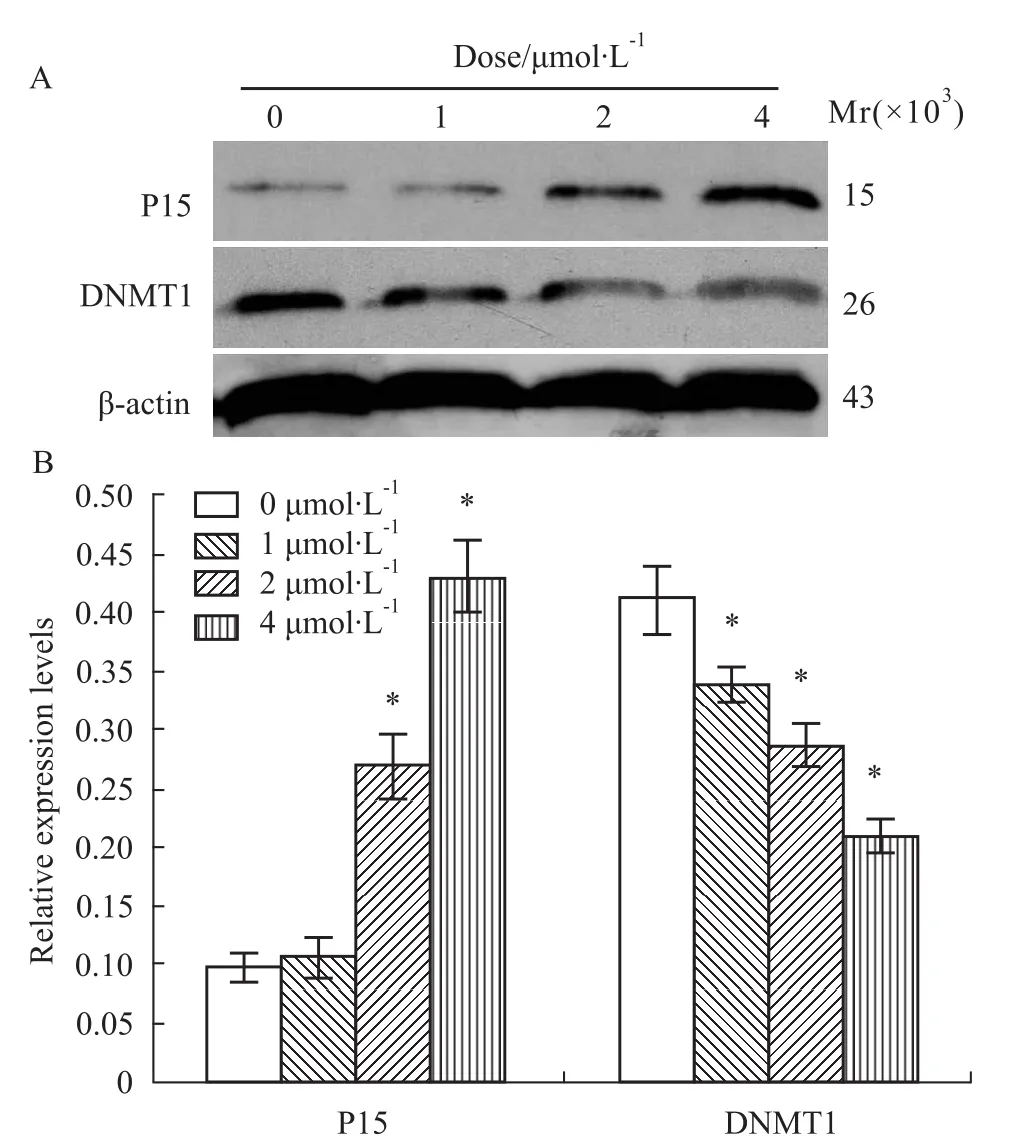
Fig 4 P15,DMNT1 protein in Molt-4 cells treated with BIX-01294 for 24 hourA:Protein electrophoresis;B:Proteins relative density.*P<0.05 vs0μmol·L-1.
2.5 BIX-01294可调控组蛋白甲基化、乙酰化 不同浓度BIX-01294处理Molt-4细胞24h后组蛋白H3K9me1、H3K9me2、H3K27me1、H3K27me2水平表达均下降,P<0.05,差异有统计学意义;而H3K9三甲基化及组蛋白H3乙酰化水平无明显变化,P>0.05,差异无统计学意义(Fig 5)。

Fig 5 Histone-related proteins in Molt-4 cells treated w ith BIX-01294 for 24 hourA:Protein electrophoresis;B:Proteins relative density.*P<0.05 vs0μmol·L-1.
3 讨论
G9a是常染色质主要的H3K9甲基转移酶,在常染色质区催化H3K9的单甲基化和二甲基化,体外实验中 G9a还可以甲基化 H3K27[6]。Kondo等[7]发现肝癌病人中抑癌基因p16的沉默与DNA甲基化和H3K9甲基化状态失常有关,与此相对应,G9a在肿瘤组织中的表达水平也远远高于邻近的非肿瘤组织。G9a敲除可以明显抑制前列腺癌细胞PC3的生长,并造成其端粒酶活性下降,端粒缩短。也有研究证实G9a敲低抑制了细胞的迁移和侵袭,相反,G9a的异位表达可以促进低侵袭性肺癌细胞株的进展和迁移[8],RNAi技术敲除G9a基因后,可明显抑制EVI1阳性的白血细胞克隆增殖,组蛋白甲基转移酶位点有望成为治疗的靶标[9]。
BIX-01294是一种人工合成的选择性G9a抑制剂,其抑制G9a活性使组蛋白H3K9甲基化水平降低,染色质空间结构发生变化,抑癌基因的重新表达,诱导肿瘤细胞凋亡及周期阻滞[10]。本研究发现经过不同浓度BIX-01294作用后,Molt-4细胞的增殖率下降,有明显的浓度及时间依赖性,P<0.05,差异有统计学意义。进一步研究发现BIX-01294可抑制DNMT1,抑癌蛋白P15重新表达。Dong等[11]研究发现,G9a可以通过它的锚定重复序列ANK招募DNA甲基转移酶,促进或维持目的DNA的甲基化状态,G9a缺陷的胚胎干细胞DNA甲基化水平明显下降。研究也证实在染色质复制时,DNMT1、G9a与增殖细胞核抗原PCNA形成三元复合体,DNMT1敲减降低DNA甲基化水平、G9a和H3K9me2的富集量也随之下降[12]。有研究证实抑制H3K9甲基化转移酶活性后,p15基因启动子区组蛋白H3K9甲基化水平降低,p15基因可重新表达[13],这可能与BIX-01294导致肿瘤细胞周期阻滞有关。本研究发现BIX-01294可诱导Molt-4细胞凋亡,且随药物浓度的增加凋亡率增加,呈明显浓度依赖性,研究还发现其诱导凋亡是通过对凋亡抑制蛋白Bcl-2的表达下调,促凋亡蛋白Bax及凋亡执行蛋白Caspase-3表达增高发挥作用的。
本研究显示,BIX-01294可下调 Molt-4细胞H3K9me1、H3K9me2、H3K27me1、H3K27me2的甲基化水平,H3K9me3水平变化不明显。在体内H3K9可被一甲基化、二甲基化、三甲基化,BIX-01294可选择性抑制G9a,体外试验G9a主要使H3K9一甲基化、二甲基化,长时间孵育才有少量的三甲基化[14]。单、双和三甲基形式的H3K9为触发修饰核小体转移到核膜提供了信号。单甲基和双甲基核小体并没有转录沉默,但却是三甲基化标记物的必要条件,三甲基化标记物随后关闭了表达,将结合物密封在核边缘[15]。基因编码区 H3K9me3与HP1结合与基因转录激活有关。G9a以及它的同源蛋白GLP能够在体外催化核小体上H3K27的单甲基化和双甲基化反应是近年来研究的成果,研究发现G9a缺失的ES细胞系中,H3第27位赖氨酸的单甲基化水平明显降低,PRC2(polycomb repreesive complex)在其中起重要作用[16]。本研究结果 BIX-01294未改变H3K9me3组蛋白甲基化,可能是由于体外实验或作用的时间不够所致。而组蛋白乙酰化不发生改变,说明G9a是高选择性的。
本研究证实BIX-01294处理后在Molt-4细胞同时出现DMNT1抑制,沉默的P15蛋白重新表达,H3K9me1、H3K9me2、H3K27me1、H3K27me2甲基化水平明显降低,也说明了G9a除了是组蛋白H3K9甲基化转移酶外,对H3K27及DNA也有较强的去甲基化作用。BIX-01294可能是潜在的抗白血病药物。
参考文献:
[1] Shinkai Y,Tachibana M.H3K9 methyltransferase G9a and the related molecule GLP[J].Genes Dev,2011,25:781-8.
[2] Tachibana M,Sugimoto K,Nozaki M,et al.G9a histone methyltransferase plays adominant role in euchromatic histone H3 lysine 9 methylation and is essential for early embryogenesis[J].Genes Dev,2002,16:1779-91.
[3] Stewart M D,Li J,Wong J,et al.Relationship between histone H3 lysine 9 methylation,transcription repression,and heterochromatinprotein 1 recruitment[J].Mol Cell Biol,2005,25(7):2525-38.
[4] Ogawa M,Sakashita K,Zhao X Y,etal.Analysis of histonemodification around the CpG island region of the p15 gene in acutemyeloblastic leukemia[J].Leuk Res,2007,31:611-21.
[5] Cho H S,Kelly JD,Hayami S,et al.Enhanced expression of EHMT2 is involved in the proliferation of cancer cells through negative regulation of SIAH1[J].Neoplasia,2011,13(8):676-84.
[6] Wu H,Chen X,Xiong J,et al.Histonemethyltransferase G9a contributes to H3K27 methylation in vivo[J].Cell Res,2011,21:365-7.
[7] Kondo Y,Shen L,Ahmed S,et al.Downregulation of histone H3 lysine 9 methyltransferase G9a induces centrosome disruption and chromosome instability in cancer cells[J].PLoS One,2008,3:e2037.
[8] Chen M W,Hua K T,Kao H J,et al.H3K9 histonemethyltransferase G9a promotes lung cancer invasion and metastasis by silencing the cell adhesion molecule Ep-CAM[J].Cancer Res,2010,70:7830-40.
[9] Goyama S,Nitta E,Yoshino T,etal.EVI-1 interactswith histonemethyltransferases SUV39H1 and G9a for transcriptional repression and bonemarrow immortalization[J].Leukemia,2010,24(1):81-8.
[10]张 玲,盛树力,秦 川.表观遗传学药物的研究进展[J].中国药理学通报,2013,29(3):297-302.
[10]Zhang L,Sheng S L,Qin C.Research progress in the epigenetic drug[J].Chin Pharmacol Bull,2013,29(3):297-302.
[11]Dong K B,Maksakova IA,Mohn F,et al.DNA methylation in ES cells requires the lysinemethyltransferase G9a but not its catalytic activity[J].EMBO J,2008,27:2691-701.
[12]Estève PO,Chin H G,Smallwood A,et al.Direct interaction between DNMT1 and G9a coordinates DNA and histone methylation during replication[J].Genes Dev,2006,20:3089-103.
[13]Lakshmikuttyamma A,Scott SA,DeCoteau JF,etal.Reexpression of epigeneti-cally silenced AML tumor suppressor genes by SUV39H1 inhibition[J].Oncogene,2010,29(4),576-88.
[14]Shinkai Y,Tachibana M.H3K9 methyltransferase G9a and the related molecule GLP[J].Genes Dev,2011,25(8):781-8.
[15]Benjamin D.Towbin,Cristina Gonzalez-Aguilera,et al.Step-Wise methylation of histone H3K9 positions heterochromatin at the nuclear periphery[J].Cell,2012,150:5(31):934-47.
[16]Wu H,Chen X Z,Xiong J,et al.Shaorong Gao and Bing Zhu histonemethyltransferase G9a contributes to H3K27methylation in vivo[J].Cell Research,2011,21:365-7.

