牛磺酸镁对缺氧/复氧致大鼠心室肌细胞钠离子通道异常的影响
丛恬鈔,张铭慧,何海燕,尹永强,吴 红,康 毅,娄建石
(天津医科大学基础医学院药理学教研室,天津 300070)
心律失常(cardiac arrhythmia)是心血管系统疾病中最为常见也最为严重的病症之一。据统计,中国每年约60万人死于心源性猝死,其中90%以上由室性心动过速、心室或心房颤动所致[1]。美国每年约39万人死于恶性心律失常[2]。心律失常不但会加重既有的心脏疾病,还可诱发心源性猝死,严重威胁人类健康。随着研究的深入,越来越多的心律失常被证实与心脏离子通道异常有关[3],而在心肌细胞离子通道中,钠通道作为Ⅰ类抗心律失常药物的作用靶点,可影响动作电位形态,与早期后除极密切相关,其异常将会导致心律失常的发生[4]。尽管我们对于心肌钠通道的临床、基因以及生理特征进行了广泛的探索,但经典的非选择性钠通道阻滞剂在临床上应用有限,以钠通道为靶点的治疗手段一直进展缓慢[5]。因此,揭示心律失常发生的深层机制,探索安全有效的治疗药物是该领域的重点与难点。
牛磺酸镁配合物(taurine-magnesium coordination compound,TMCC)是本研究室合成的配合物,既往的实验研究证实,其对多种因素诱发的实验性心律失常与触发活动有确切的防治效果[9]。细胞水平上的研究[10-15]亦证明,该配合物对正常状态下与药物诱发的异常钠、钾、钙电流均有作用,提示该配合物或具有广泛的抗心律失常作用,但其作用机制尚有待进一步阐明。本实验通过建立细胞水平上缺氧/复氧致心律失常模型,观察TMCC对钠离子通道电流的作用,旨在进一步探索其抗心律失常的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康成年Wistar大鼠,♂,体质量220~250 g,合格证号:SCXK(军)2007-0001。
1.1.2 药品与试剂 HEPES、EGTA、Mg-ATP、Na2ATP、胶原酶Ⅱ等购自Sigma公司。TMCC由天津医科大学化学教研室合成。
1.1.3 仪器 膜片钳仪,MultiClamp 700B,USA;数-模转换器,DigiData1440A,USA;倒置显微镜,IX51,Japan;三维操纵仪,MP-225,USA;微电极拉制仪,P-97,USA;恒流泵,Peri-Star,台湾;酸度计,PHS-3C,上海精密科学仪器有限公司;Millipore纯水系统,USA。
1.1.4 液体的制备 无钙台氏液(mmol·L-1):NaCl 136,KCl 5.4,MgCl21.0,NaH2PO40.33,HEPES 10,Glucose 10,用 NaOH调 pH至7.4。细胞保存液(KB液,mmol·L-1):L-谷氨酸 70,牛磺酸 15,KCl 30,KH2PO410,MgCl20.5,HEPES 10,EGTA 0.5,Glucose 10,用KOH调pH至7.4。记录钠通道电流(INa)的正常细胞外液(mmol·L-1):氯化胆碱 120,NaCl 25,CsOH 4,CaCl20.1,CoCl22,MgCl21,HEPES 10,Glucose 10,用 CsOH调 pH至7.35。记录钠通道电流的电极内液(mmol·L-1):CsOH 140,NaCl10,EGTA 5,HEPES 5,Na2ATP 5,用CsOH调pH至7.3。以上液体使用前通以纯氧20 min。记录钠通道电流的模拟缺氧细胞外液(mmol·L-1):去除 Glucose,其他成分同正常外液,用CsOH结合盐酸调pH至6.8,并通以100%氮气20 min以上。
1.2 方法
1.2.1 单个大鼠心肌细胞的分离 用25%乌拉坦将大鼠麻醉,仰卧位固定于鼠台上,迅速剪开胸腔暴露心脏,从主动脉根部离断取出心脏,放入4℃无钙台氏液中,去除脂肪及结缔组织。将主动脉逆行插管连接于Langendorff灌流装置上(恒温37℃),以无钙台氏液8 ml·min-1连续灌流5 min,洗去心脏残血后,改用50 m l含10 mg胶原酶Ⅱ与15 mg牛血清白蛋白的无钙台氏液进行循环灌流。随着灌流的进行,流出液体逐渐变得粘稠,心肌的颜色逐渐变浅、透明,心脏体积逐渐膨大、松软。此时将心脏自左心室分段剪去心肌组织,置于装有KB液的试管中,用吸管轻轻吹打使之分散成单个细胞,分装,置于4℃冰箱中稳定2 h待用。
1.2.2 钠通道电流INa的记录 应用全细胞膜片钳技术记录单细胞离子电流。所用微电极用两步拉制仪拉制而成,微电极充电极液后,电阻在2~4 MΩ之间。电流信号经MultiClamp 700B膜片钳放大器、DigiData1440A数-模转换器及Pclamp10.1采集、储存及分析。将细胞悬液置于倒置显微镜工作平台容积为1 ml的浴槽中,待细胞贴壁后,用钠外液进行灌流,流速1 ml·min-1。选用大小相近、纹理清晰的杆状细胞进行实验。待高阻封接后,进行电极电容补偿。负压或高压脉冲破膜,进行膜电容、串联电阻及漏电流补偿,平衡5 min,待电极内钠内液与细胞内液充分交换后,进行膜电流记录。膜电流的大小以电流密度及单位膜电容的膜电流表示。
1.2.3 实验分组与造模 实验分为正常对照组、缺氧/复氧模型组(H/R组)、H/R+100μmol·L-1TMCC组、H/R+200μmol·L-1TMCC组、H/R+400μmol·L-1TMCC组、H/R+24.24μmol·L-1胺碘酮组。将分离的细胞置于浴槽中,待贴壁后,先用记录钠电流(INa)的细胞外液进行灌流,封接形成全细胞记录模式后,平衡5 min,待电极内液与细胞内液充分交换后,进行膜电流记录,定义为正常细胞INa。然后用缺氧外液冲洗替换浴槽中的正常外液,15 min后再以正常有氧外液冲洗替换缺氧外液,5 min后记录为缺氧/复氧组INa。H/R+TMCC组及H/R+胺碘酮组则分别在有氧外液中加入不同浓度的TMCC或胺碘酮进行记录。形成全细胞构型后,在电压钳模式下记录电流。将钳制电位固定于-120 mV,指令电压从-120 mV以10 mV为步阶逐步跃至+30 mV,脉冲持续时间100 ms,可记录到大鼠心室肌细胞的INa电流。细胞外液中加入2 mmol·L-1的CoCl2以阻断钙电流,细胞内液中用Cs+代替K+,以去除钾电流的影响。
1.2.4 稳态激活曲线 以不同电压水平的INa峰值与相应的膜电位作图,绘制INa电流I-V曲线,将I-V曲线的结果转化为膜电导(G),对条件刺激电压作图,然后采用 Boltzman方程 G/Gmax=1/{1+exp[(V-V1/2)/K]}进行拟合,得到 INa稳态激活曲线。式中Gmax为最大膜电导,V1/2为半数激活电压,K为斜率参数。
1.2.5 稳态失活曲线 采用双脉冲刺激法测定稳态失活曲线。保持电位-80 mV施予50 ms,步阶10 mV,-150 mV~+30 mV系列条件脉冲刺激,每一条件脉冲后紧跟一固定去极化至-30 mV,25 ms的测试脉冲。以电流的相对值(I/Imax)对条件脉冲电压作图,得出INa的失活曲线。用Boltzman方程I/Imax=1/{1+exp[(V-V1/2)/K]}进行拟合,得出半数失活电压V1/2和失活曲线斜率K,式中I和Imax分别为不同测试脉冲电压下电流大小和最大电流。
1.2.6 统计学分析 在Clampfit10.0软件中将记录的原始数据进行处理分析,结果以表示。运用SPSS 17.0软件进行单因素方差分析,组间差异用LSD检验。
2 结果
2.1 TMCC,胺碘酮对大鼠心肌细胞缺氧/复氧损伤模型INa峰值的影响 形成全细胞构型后,在电压钳模式下记录电流(Fig 2a-2f)。缺氧/复氧、各浓度TMCC及胺碘酮作用后,钠电流峰值的变化见Fig 1。以去极化的电位为横坐标,相应的最大电流密度为纵坐标绘制钠电流的I-V曲线(Fig 2g)。结果表明,缺氧/复氧使 INa峰值从(56.89±2.07)pA/pF减小至(35.05±1.52)pA/pF(n=6,P<0.01),I-V曲线上移,模型制备成功。200、400μmol·L-1TMCC可使 INa峰值部分恢复(n=6,P<0.01),I-V曲线下移,INa电流恢复,其作用呈浓度依赖性,且强于24.24μmol·L-1胺碘酮。
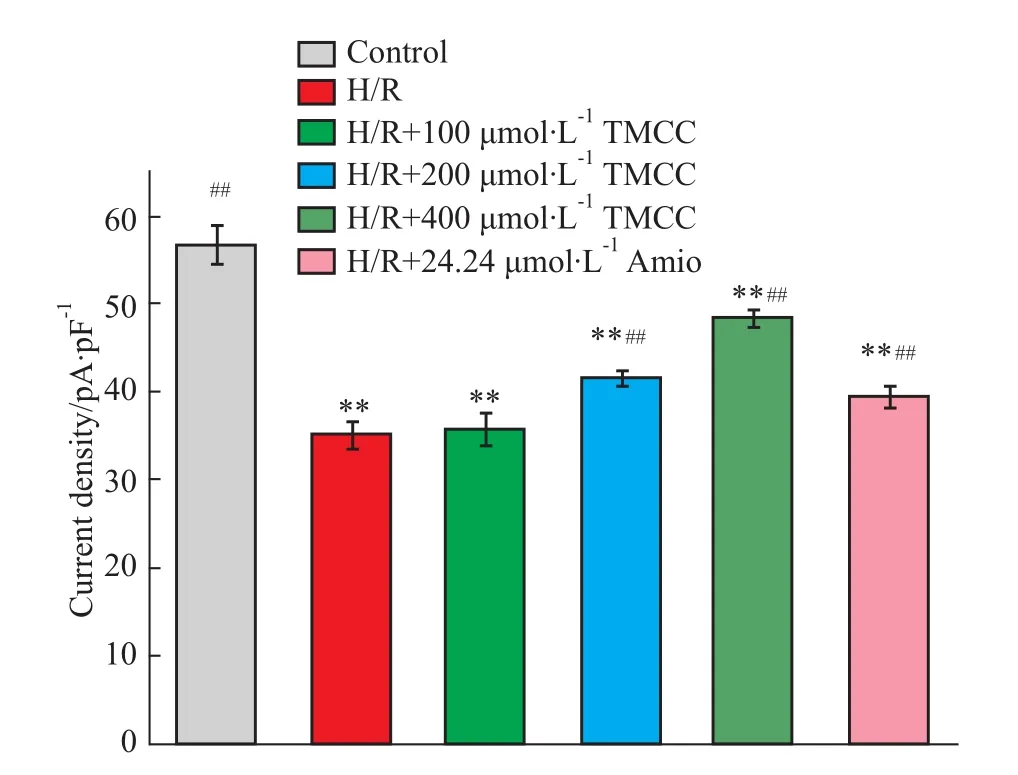
Fig 1 Effects of TMCC and am iodarone on peak I Na in rat ventricular m yocytes subjected to hypoxia/reoxygenation**P<0.01 vs control group;##P<0.01 vs H/R group.
2.2 TMCC,胺碘酮对大鼠心肌细胞缺氧/复氧损伤模型INa稳态激活曲线的影响 与正常对照组相比,缺氧/复氧使半数激活电压 V1/2减小(Fig 3a,n=6,P<0.05),激活曲线(Fig 3c)右移,激活减慢。各浓度TMCC组及胺碘酮组与模型组相比,V1/2和激活曲线斜率K值差异均无显著性,给药组间差异也无显著性。
2.3 TMCC,胺碘酮对大鼠心肌细胞缺氧/复氧损伤模型INa稳态失活曲线的影响 与正常组相比,缺氧/复氧模型组使半数失活电压 V1/2增大(Fig 3b,n=6,P<0.05),失活曲线(Fig 3d)左移,失活加快。200、400μmol·L-1TMCC和 24.24μmol·L-1胺碘酮可使增大的半数失活电位降低(Fig 3b),对抗缺氧/复氧所致的失活提前,使左移的曲线部分恢复。
3 讨论
钠通道在生理学的发展史中占据着特殊重要的地位。1952年,Hodgkin和Huxley在乌贼神经轴突阐明了钠通道的基本特性,由此引发现代离子通道病理论[16]。在心肌细胞中,钠通道主要存在于细胞膜上,是心肌细胞兴奋时第一个被激活的离子通道,是快速反应的基础,也是其他通道开放或离子流动的前提。在哺乳动物心肌细胞中,钠通道的密度最大,大密度钠通道的存在对动作电位的快速去激化(即0相)有重要意义,保证了心肌细胞的正常电活动。心肌细胞的钠通道由核心α亚基与辅助性β1、β2亚基共同构成。Nav1.5是形成电压门控的心肌钠通道α亚基孔隙的膜内在蛋白,是人类心脏主要的钠离子通道类型,由SCN5A基因编码。钠通道数量上的减少、SCN5A基因的突变引起的分子结构异常及失活不完全与多种心律失常疾病相关,包括长QT综合征、Brugada综合征、病窦综合征以及进行性心脏传导阻碍和心房阻滞[16]。可见,对钠离子通道研究的意义重大。目前,已有学者将SCN5A导入HEK细胞(人胚胎肾细胞),得到纯Nav1.5离子流(INa)的各项参数[18],而随着研究的深入,Nav1.5的结构与功能也越来越清晰[19],以便更深层次的探索。
缺血/再灌注损伤可以刺激心室结构与功能重塑,引起心肌细胞各种离子通道和离子交换体的激活,导致心肌细胞离子和能量失衡[21],从而影响正常心肌细胞的功能。本实验采用缺氧液和复氧液灌注,制备缺氧/复氧模型,旨在模拟缺血/再灌注这一过程。实验选用缺氧15 min后复氧,结果显示缺氧时钠电流减少,复氧后钠电流进一步降低。有研究表明[22-25],随着模拟缺氧液灌流时间延长(灌流10 min与20 min),INa减少,通道激活和失活时间延长,随再灌注激活时间恢复较快,但INa失活时间并不立即恢复。这与本实验研究结果一致。
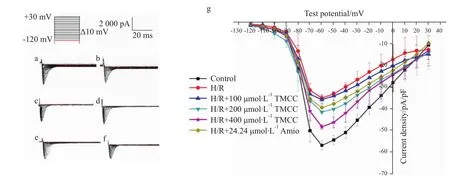
Fig 2 Effects of TMCC and am iodarone on I Na in rat ventricular m yocytes subjected to hypoxia/reoxygenationa:Control;b:H/R;c:H/R+100μmol·L-1;d:H/R+200μmol·L-1;e:H/R+400μmol·L-1;f:H/R+24.24μmol·L-1 Amiodarone;g:I-V curve.
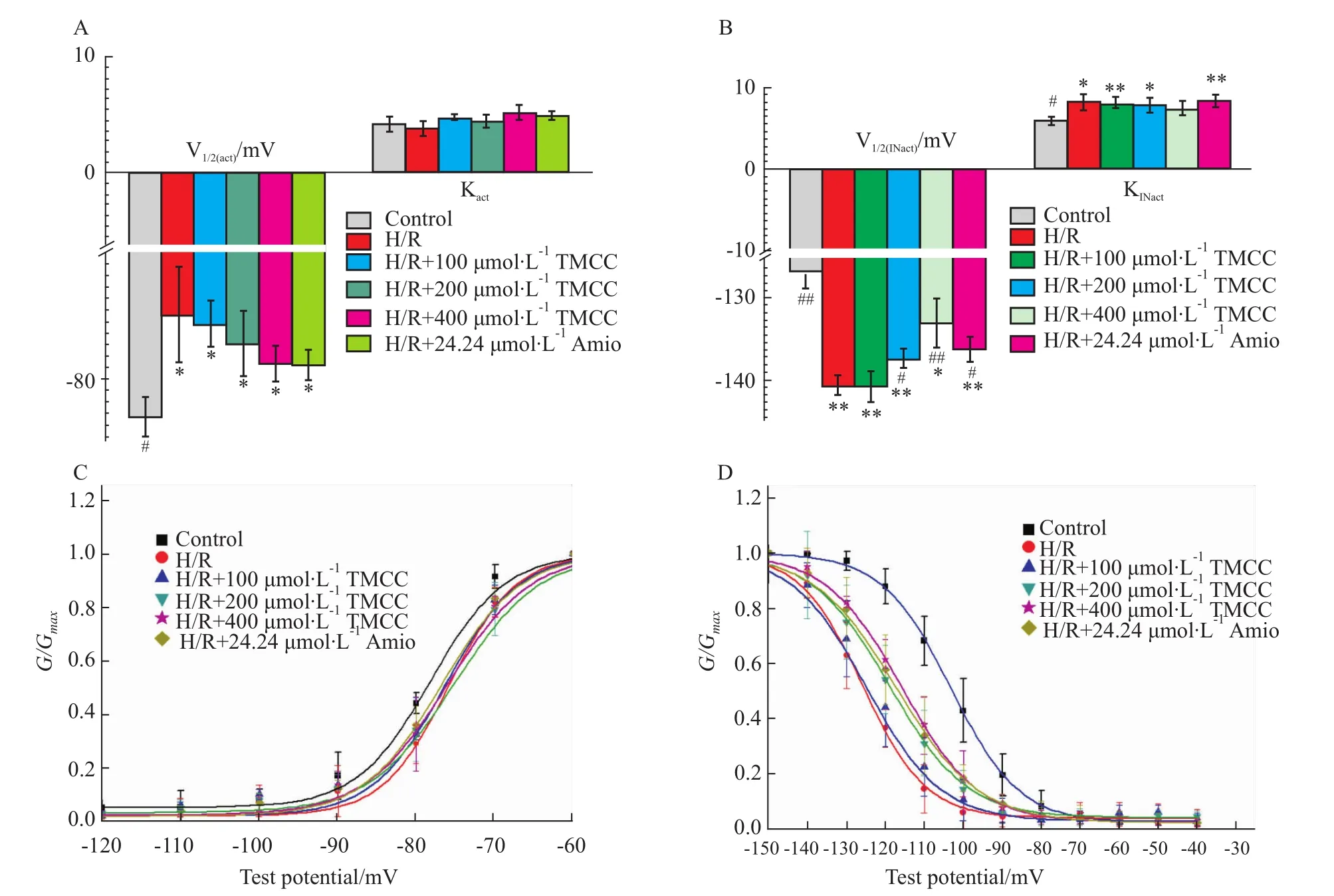
Fig 3 Effects of TMCC(100,200,400μmol·L-1),am iodarone(24.24μmol·L-1)on I Na steady-state activation and inactivation in rat ventricular m yocardiocytes subjected to hypoxia/reoxygenationA:V1/2 and K act of steady-state activation;B:V1/2 and K inact of steady-state inactivation;C:steady-state activation curve;D:steady-state inactivation curve.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs H/R group.
本实验结果表明,缺氧/复氧使INa峰值减小,IV曲线上移,TMCC(200、400μmol·L-1)能浓度依赖性地恢复由缺氧/复氧损伤引起的INa减小,使I-V曲线下移,且无平行移动,基本不改变曲线形状,仍保持原有的电压依赖性关系,提示TMCC在不同膜电位水平对INa的作用是一致的。INa的动力学研究结果显示,缺氧/复氧使激活曲线右移,激活减慢;使失活曲线左移,失活加快。TMCC(200、400μmol·L-1)和胺碘酮(24.24μmol·L-1)对激活的影响差异无显著性,但可恢复左移的失活曲线,使钠通道的稳态失活过程减慢。由此可推断,TMCC对抗缺氧/复氧钠抑制的作用或与减慢失活有关。此前有研究发现TMCC对正常细胞的钠通道有阻滞作用[10],然而在缺氧/复氧模型中,TMCC并未加剧损伤对钠通道的抑制,反而在一定程度上恢复了钠电流,提示TMCC对钠通道的作用可能与钠通道的状态有关,即在钠通道正常开放时呈抑制作用,而钠通道过度抑制时则表现为兴奋作用,使失衡的钠通道恢复或接近原有的平衡状态。
胺碘酮是目前被认为疗效较好的广谱抗心律失常药物,但其复杂的毒副作用在一定程度上限制了其应用[26]。本实验中,胺碘酮与TMCC作用一致,可对抗缺氧/复氧引起的钠电流减少,作用与200 μmol·L-1的TMCC相当。然而本室前期的实验发现,胺碘酮会加重哇巴因对钠通道的抑制,而TMCC则可以恢复过度抑制的钠通道[15]。根据“最佳靶点学说”,一个好的抗心律失常药物应对至少3种以上的心律失常靶点有效,且对单一通道的作用不过强,以减少致心律失常效应。TMCC对心肌钠、钾、钙离子通道均有一定的作用,能够使病理条件下的细胞重获平衡,利于心律失常的治疗且降低致心律失常的风险,符合“最佳靶点学说”的要求。
在心肌细胞中,除了主要的快速INa,还存在其他较弱的钠离子流成分,即Na+晚电流(INaL)。近年来研究显示,在某些病理情况下,由于钠通道快速开放后更加不能失活,即引起INaL的增强、心肌复极储备能力下降,易引发早后除极(EAD),导致心律失常。此外,INaL的增强还可通过钠-钙交换,使Ca2+内流持续增多,易导致钙超载,使心脏功能受损。由于INaL对心律失常的发生以及药物抗心律失常作用都有重要意义,抑制INaL已成为心律失常治疗的新方向,因而也愈加受到重视[27]。但是,TMCC对这种晚钠通道是否有影响及其机制还亟待探索。
参考文献:
[1] 杨宝峰,蔡本志.心律失常发病机制研究进展[J].国际药学研究杂志,2010,37(2):81-8.
[1] Yang B F,Cai B Z.Advances in the study of arrhythmogenic mechanisms[J].J Int Pharm Res,2010,37(2):81-8.
[2] Go A S,Mozaffarian D,Roger V L,et al.Heart disease and stroke statistics-2014 update:A report from the American Heart Association[J].Circulation,2014,129(3):e28-e292.
[3] Eduardo M.Cardiac channelopathies[J].Nature,2002,415:213-8.
[4] Goldin A L,Barchi R L,Caldwell JH,et al.Nomenclature of voltage-gated sodium channels[J].Neuron,2000,28(2):365-8.
[5] Remme C A,Wilde A A.Targeting sodium channels in cardiac arrhythmia[J].Curr Opin Pharmacol,2014,15:53-60.
[6] Heijman J,Voiqt N,Dobrey D.New directions in antiarrhythmic drug therapy for arterial fibrillation[J].Future Cardial,2013,9(1):71-88.
[7] 钱慕仪.抗心律失常药研究新进展[J].当代医学,2010,16(4):22-4.
[7] Qian M Y.Progress of researches in antiarrhythmic drugs[J].Contemporary Med,2010,16(4):22-4.
[8] 李晔蕾.抗心律失常药物治疗新进展[J].中国医学创新,2013,10(31):159-61.
[8] Li Y L.Progress of antiarrhythmic drug therapy[J].Med Innov China,2013,10(31):159-61.
[9] 孙 涛,康 毅,娄建石,等.牛磺酸镁的合成及对乌头碱诱发心律失常的作用[J].中国心血管杂志,2003,8(4):238-9.
[9] Sun T,Kang Y,Lou JS,etal.Synthesisand effectof arrhythmia induced by aconitine on Taurine-Magnesium coordination compound[J].Chin JCardiovasc Med,2003,8(4):238-9.
[10]汪玲芳,尹永强,赵 临,等.牛磺酸镁对乌头碱致大鼠心肌细胞心律失常模型钠离子通道的影响[J].中国药理学通报,2010,26(5):611-4.
[10]Wang L F,Yin Y Q,Zhao L,etal.Effectsof taurine-maganesium coordination compound on sodium channel in rat cardiomyocytes of arrhythmia induced by aconitine[J].Chin Pharmacol Bull,2010,26(5):611-4.
[11]汪玲芳,尹永强,赵 临,等.牛磺酸镁配合物对乌头碱诱发心律失常大鼠心肌细胞钙通道的影响[J].中国新药与临床杂志,2011,30(1):39-42.
[11]Wang L F,Yin Y Q,Zhao L,etal.Effectsof taurine-maganesium coordination compound on calcium channel in rat cardiomyocytes of arrhythmia induced by aconitine[J].Chin JNew Drugs Clin Rem,2011,30(1):39-42.
[12]李宏杰,尹永强,张铭慧,等.牛磺酸镁配合物对缺氧复氧致大鼠心肌细胞瞬时外向钾离子通道异常的影响[J].中国新药与临床杂志,2012,31(5):276-80.
[12]Li H J,Yin Y Q,Zhang M H,et al.Effects of taurine-maganesium coordination compound on abnormal transientoutward potassium channel current induced by hypoxia-reoxygenation in cardiomyocytes of rats[J].Chin JNew Drugs Clin Rem,2012,31(5):276-80.
[13]何海燕,尹永强,李宏杰,等.牛磺酸镁对缺氧/复氧致大鼠心肌细胞内向整流钾通道异常的影响[J].中国药理学通报,2012,28(12):1751-6.
[13]He H Y,Yin Y Q,Li H J,et al.Effects of taurine-maganesium coordination compound on abnormal inward rectifier potassium channel current induced by hypoxia-reoxygenation in cardiomyocytes of rats[J].Chin Pharmacol Bull,2012,28(12):1751-6.
[14]Yin Y,Wen K,Wu Y,etal.Inhibition of sodium currentby taurinemagnesium coordination compound prevents Cesium Chlorideinduced arrhythmias[J].Biol Trace Elem Res,2012,146(2):192-8.
[15]Zhao L,Lou J,Wu H,etal.Effects of taurine-magnesium coordination compound on ionic channels in rat ventricular myocytes of arrhythmia induced by ouabain[J].Biol Trace Elem Res,2012,147(1-3):275-84.
[16]CatterallW A.From ionic currents tomolecularmechanisms:The structure and function of voltage-gated sodium channels[J].Neuron,2000,26(1):13-25.
[17]Rook M B,Evers M M,Vos M A,Bierhuizen M F.Biology of cardiac sodium channel Nav1.5 expression[J].Cardiovasc Res,2012,93(1):12-23.
[18]Berecki G,Wilders R,de Jonge B,etal.Re-evaluation of the action potential upstroke velocity as ameasure of the Na+current in cardiac myocytes at physiological conditions[J].PLosOne,2010,5(12):e15772.
[19]Payandeh J,Scheuer T,Zheng N,Catterall W A.The crystal structure of a voltage-gated sodium channel[J].Nature,2011,475(7356):353-8.
[20]王天成.心肌离子通道与抗心律失常药研究进展[J].心血管病学进展,2004,增刊:94-7.
[20]Wang TC.Advance in research ofmyocardial ion channel and anti-arrhythmia drug[J].Adv Cardiovasc Dis,2004,supplement:94-7.
[21]孙 亮,龙 村,黑飞龙,等.缺血/再灌注处理对乳鼠心肌细胞钠电流的影响[J].中国体外循环杂志,2011,9(1):28-31.
[21]Sun L,Long C,Hei F L,et al.Effects of ischemia/reperfusion management on sodium current of the cardiocytes from the newborn rats[J].Chin JE C C,2011,9(1):28-31.
[22]邹路芸,蒋文平.缺血/再灌注对心室肌细胞膜离子通道的影响[J].中国心脏起搏与心电生理杂志,1999,13(4):230-3.
[22]Zou L Y,JiangW P.Effectof ischemia/reperfusion onmembrane ionic channels of guinea pig ventricularmyocytes[J].Chin JCard Pac Electrophysiol,1999,13(4):230-3.
[23]刘晓云,丁 超,张 霞.缺血/再灌注对大鼠心室肌细胞钠离子电流的影响[J].中国临床康复,2005,9(47):28-9.
[23]Liu X Y,Ding C,Zhang X.Effect of ischemic-reperfusion on sodium channel current of cardiomyocytes in rats[J].Chin J Clin Rehabit,2005,9(47):28-9.
[24]Fröhlich GM,Meier P,White SK,etal.Myocardial reperfusion injury:looking beyond primary PCI[J].Eur Heart J,2013,34(23):1714-22.
[25]Goegelein H,Gautier P,Roccon A,et al.Effects of the novel Amiodarone-like compound SAR114646A on cardiac ion channels and ventricular arrhythmias in rats[J].Naunyn Schmiedeberg’s Arch Pharmacol,2011,384(3):231-44.
[26]Mason JW.Amiodarone[J].N Engl JMed,1987,316(8):455-66.
[27]卫晓红,吴 林.阻滞延迟钠电流:治疗心律失常的新曙光[J].心血管病学进展,2013,34(1):18-22.
[27]Wei X H,Wu L.Inhibition of late sodium current:a novel target to treat cardiac arrhythmias[J].Adv Cardiovasc Dis,2013,34(1):18-22.

