葡萄籽原花青素对顺铂所致小鼠肾毒性作用的影响
高兆丽,刘广义,李星,胡昭,杨向东,江蓓,李宪花
(山东大学齐鲁医院泌尿内科,山东济南 250012)
葡萄籽原花青素对顺铂所致小鼠肾毒性作用的影响
高兆丽,刘广义,李星,胡昭,杨向东,江蓓,李宪花△
(山东大学齐鲁医院泌尿内科,山东济南 250012)
目的:探讨葡萄籽原花青素(GSP)对顺铂(CP)肾毒性作用的防护及可能机制。方法:雄性C57小鼠分为4组:正常对照组(N组,n=10)、CP组(腹腔注射20 mg/kg CP,n=20)、GSP组(第1天及第3天灌胃GSP 500 mg/kg,n=15)和CP+GSP组(腹腔注射CP 30 min前给予500 mg/kg GSP灌胃,第3天灌胃等量的GSP,n= 20)。给药后第5天取血,肾组织病理HE染色,应用蛋白印迹法和免疫组化法检测小鼠葡萄糖调节蛋白78 (GRP78)和磷酸化细胞外信号调节激酶(p-ERK)的蛋白表达。结果:与N组比较,CP组肾脏指数升高,血尿素氮和血清肌酐水平升高(P<0.05),肾病理损伤明显,肾组织GRP78和p-ERK蛋白表达增加(P<0.05)。与CP组相比,CP+GSP组肾脏指数降低,血尿素氮和血清肌酐水平下降(P<0.05),肾病理损伤减轻,GRP78和p-ERK蛋白表达明显降低(P<0.05)。结论:GSP能明显降低CP所致的肾毒性,其机制与GSP下调CP导致的内质网应激有关。
顺铂;葡萄籽原花青素;肾毒性;内质网应激
顺铂(cisplatin,CP)是临床化疗最常用的药物之一。它是一种广谱抗肿瘤药,对实体肿瘤的疗效尤为明显,其疗效与剂量成正比[1],而顺铂的肾毒性是限制其大量使用的最常见原因,亦是其最明显的副作用[2-4]。顺铂主要导致肾小管受损,顺铂致肾小管细胞损伤包括多种机制:直接毒性作用,线粒体介导的损伤,以及氧化应激介导的损伤[1]。如何预防及减轻顺铂的肾毒性一直是研究的热点。尽管国内外进行了大量研究,目前为止,仍没有理想的方法。葡萄籽原花青素(grape seed proanthocyanidin,GSP)是从葡萄籽中提取的一种天然植物多酚物质,国内也有人称之为葡多酚[5-6],具有强大的抗氧化活性,有研究证明,其抗氧化活性是维生素E的50倍,维生素C的20倍。本研究通过观察GSP对肾功能相关指标及内质网应激相关蛋白葡萄糖调节蛋白78 (glucose-regulated protein 78,GRP78)和磷酸化细胞外信号调节激酶(phosphorylated extracellular signalregulated kinase,p-ERK)的影响,探讨其对顺铂所致肾毒性的保护作用及可能机制,旨在为GSP应用于顺铂肾损害防治提供依据。
材料和方法
1 动物
健康雄性C57小鼠65只,鼠龄6~8周,体重20 ~30 g,由北京维通利华公司提供。
2 主要试剂
顺铂购自Sigma,GSP(纯度96%)购自天津尖峰公司。GRP78抗体购自Abcam,p-ERK和ERK抗体购自Cell Signaling Technology,β-actin抗体购自Santa Cruz Biotechnology。山羊抗鼠和山羊抗兔Ⅱ抗购自Jackson ImmunoResearch Laboratories。
3 主要方法
3.1 顺铂小鼠动物模型的建立健康雄性C57小鼠65只,喂养2 d后,随机选取10只作为对照组,另55只作为模型组及治疗组。正常对照组(N组,n= 10):一次性腹腔注射等容积生理盐水(NS,10 mL/ kg);CP组(n=20):一次性腹腔注射20 mg/kg CP(溶于生理盐水,浓度2.0 g/L);GSP组(n=15):第1天及第3天灌胃GSP 500 mg/kg(溶于生理盐水,浓度50 g/L);CP+GSP组(n=20):腹腔注射CP 30 min前给予500 mg/kg GSP灌胃,第3天灌胃等量的GSP(溶于生理盐水,浓度50 g/L)。给药后第5天内眦取血,处死动物。
3.2 标本采集及测定5 d后各组存活小鼠分别为:N组8只,CP组15只,GSP组13只,CP+GSP组16只。处死前取血,用BT-224型半自动生化分析仪检测血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,SCr)。处死动物后取出双侧肾脏,去包膜后称重并计算肾脏指数。肾脏指数(renal index,RI)=双侧肾脏重(g)/体重(g)×100。部分肾脏-80℃保存,常规行蛋白印迹实验,部分放入4%多聚甲醛,制备石蜡切片,常规行免疫组化,病理染色,光镜下观察病理变化。
3.3 蛋白质的提取采用Trizol法提蛋白,每50~100 mg组织加入1 mL Trizol,加入Trizol的样品在15~30℃放置5 min,加入氯仿0.2 mL每1 mL Trizol,剧烈振荡后静置2~3 min,4℃12 000×g离心15 min。提蛋白:移出上清,加入1.5 mL异丙醇每1 mL Trizol,室温下摇床上放置10~20 min,4℃、12 000×g离心10min。倒掉液体,加入2 mL、0.3 mol盐酸胍每1 mL Trizol,室温下摇床上放置20 min,4℃、7 500×g离心5 min,重复3次,用2 mL乙醇振荡起蛋白沉淀,室温下摇床上放置20 min,7 500 ×g离心5 min,真空干燥沉淀5~10 min,用1%SDS吹打混匀,50℃孵育30 min,1 000×g离心10 min,去除不溶物质,转移上清至另一EP管,-80℃保存。
3.4 HE染色及免疫组化新鲜组织4%多聚甲醛固定(8~12 h)然后移至0.5%多聚甲醛长期放置,组织包埋后每张切4 μm厚度,常规行HE染色。在光镜下就HE染色标本对肾小管坏死程度进行评分。评分标准:每张切片×100倍镜下取15个视野,取受损肾小管占视野的百分比,0分:正常;1分:受损肾小管<5%;2分:受损肾小管5%~25%;3分:受损肾小管25%~75%;4分:受损肾小管>75%,作半定量分析并计算其均值,作为肾小管坏死的评分指数。免疫组化:石蜡切片放入梯度乙醇脱蜡后水化,然后放入0.01%柠檬酸-柠檬酸钠缓冲液(pH 6.0),92~93℃左右微波热修复10 min后室温冷却,加入0.1%Triton X-100浸泡15 min后加3%双氧水避光10 min,10%山羊血清封闭在37℃放置60 min,滴加Ⅰ抗(GRP78 1∶200,p-ERK 1∶50,阴性对照加PBS)4℃过夜,PBS洗3次,滴加Ⅱ抗(山羊抗兔),DAB显色,苏木素染核,二甲苯透明后中性树胶封片。棕褐色为阳性着色。对免疫组化结果进行半定量分析,每组随机选取2个标本,每个标本随机选取10个视野在光镜下观察,根据每个标本的染色强度及染色面积进行评分,着色的强度可分为0分:无颜色;1 分:浅黄色;2分:浅褐色;3分:棕色。阳性染色区被评定为0分:<5%;1分:5%~25%;2分:25%~50%;3分:51%~75%;4分:>75%。这2个评分加在一起作为最后评分。
3.5 蛋白免疫印迹提取的组织使用BCA法测蛋白浓度,12%的分离胶80V电压至marker条带分开后改为140V,至溴酚蓝跑至底部时,转至硝酸纤维素膜,5%脱脂奶粉(TBST稀释)室温封闭1 h,Ⅰ抗(GRP78 1∶250,p-ERK 1∶1 000,ERK 1∶2 000,β-actin 1∶2 000)4℃孵育过夜,PBS洗3次,加Ⅱ抗(山羊抗兔1∶10 000,山羊抗鼠1∶5 000),ECL发光液黑暗中5 min,暗室曝光。使用ImageJ软件(National Institutes of Health)对蛋白免疫印迹结果进行半定量分析,对每一个确定的蛋白条带的亮度进行量化。以每组与N组的比值做柱状图。
4 统计学处理
数据以均数±标准差(mean±SD)表示,统计分析用SPSS 11.5软件处理。多组间总体均数比较采用单因素方差分析,两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1 肾功能相关指标的变化
CP组RI、BUN和Cr与N组相比明显升高,差异有统计学意义(P<0.05)。而CP+GSP组RI、BUN和Cr与CP组相比显著降低(P<0.05)。GSP 组RI、BUN和Cr与N组相比差异无统计学意义,见图1。

Figure 1.Parameters of renal function.N:control group(n=8);C:CP group(n=15);G:GSP group(n=13);C+G:CP+GSP group(n=16).Mean±SD.*P<0.05 vs N group;#P<0.05 vs C group.图1 肾功能相关指标的变化
2 肾脏的病理变化
光镜下HE染色显示,与N组比较,CP组可见肾小管上皮细胞肿胀,空泡样变性,细胞核裸露,坏死脱落,大量管型形成,肾小管损伤明显;经GSP治疗后上述改变明显减轻。半定量分析显示;CP组损伤评分为3.1分,肾小管受损明显;CP+GSP组肾损伤评分为1.7分,GSP治疗后上述损伤明显减轻,差异显著(P<0.05),见图2。这表明GSP能够减轻顺铂引起的肾损伤。
3 蛋白免疫印迹检测肾组织GRP78和p-ERK蛋白的表达
蛋白免疫印迹显示,与N组比较,GRP78和p-ERK蛋白的表达在CP组明显升高,CP+GSP组与CP组相比GRP78和p-ERK蛋白的表达明显降低,差异显著(P<0.05);GSP组与N组相比无明显差异,见图3。
4 免疫组化检测肾组织GRP78和p-ERK蛋白的表达
与N组比较,CP组可见高表达的GRP78和p-ERK蛋白,而CP+GSP组GRP78和p-ERK蛋白表达水平明显降低。半定量分析结果显示,与N组比较,GRP78和p-ERK蛋白的表达在CP组明显升高(P<0.05);CP+GSP与CP组相比GRP78和p-ERK的蛋白表达水平明显下降,差异有统计学意义(P<0.05),见图4。这表明GSP对顺铂所致的肾损伤有保护作用,GSP降低了顺铂导致的肾脏内质网应激标记蛋白的表达。
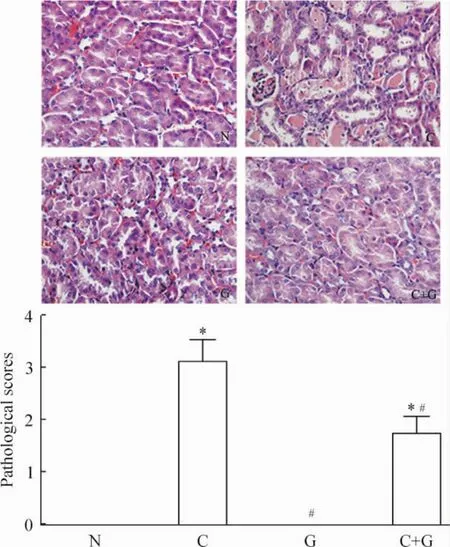
Figure 2.Renal pathology(HE staining,×400).N:control group(n=8);C:CP group(n=15);G:GSP group (n=13);C+G:CP+GSP group(n=16).Mean± SD.*P<0.05 vs N group;#P<0.05 vs C group.图2 肾脏的病理变化
讨论
CP是广泛用于临床的抗肿瘤药物,其治疗效果是明显的,尤其是在治疗实体器官肿瘤,其疗效与剂量成正比,而CP的肾毒性限制了其大剂量使用[2]。CP引起肾毒性的发病机制与以下几个因素有关,包括氧化应激、DNA损伤、线粒体功能障碍等[1]。

Figure 3.Expression of GRP78(A)and p-ERK(B)in renal tissues detected by Western blotting.Mean±SD.*P<0.05 vs N group;#P<0.05 vs C group.图3 蛋白印迹分析肾组织GRP78和p-ERK蛋白的表达

Figure 4.Expression of GRP78 and p-ERK proteins in renal tissues detected by immunohistochemical staining(×400).Mean±SD.*P<0.05 vs N group;#P<0.05 vs C group.图4 免疫组化分析肾组织GRP78和p-ERK蛋白的表达
本研究中,CP组小鼠BUN、Cr和RI的水平与N组相比明显升高,肾组织病理学检查结果显示肾小管有明显的结构性损坏,这与以往的研究报道一致[7-8],CP主要损伤肾小管。而与CP组相比,CP+ GSP组小鼠的BUN、Cr和RI水平呈显著下降,肾组织病理学检查显示CP+GSP组肾小管结构性破坏很轻微,表明GSP能够减轻CP导致的肾小管上皮细胞损伤,减少肾毒性,改善肾功能。GSP是一种从葡萄籽中提取的高效天然抗氧化剂,具有超强的清除自由基能力,为强效自由基清除剂。GSP已被广泛用于抗衰老、肿瘤患者,其亦能够预防一些疾病,如动脉粥样硬化、胃溃疡、白内障、糖尿病等[9-12]。
近年来一些研究发现内质网应激在CP诱导的肾损害中起着重要的作用[7],CP可通过激活内质网应激介导肾小管上皮细胞损伤。内质网对影响细胞内能量水平、氧化状态或钙离子浓度异常的应激极度敏感。当细胞受到某些打击,如缺氧、药物毒性等后,内质网腔内氧化环境被破坏,钙代谢失调,内质网功能发生紊乱,突变蛋白质产生或者蛋白质二硫键不能形成,引起未折叠蛋白或错误折叠蛋白在内质网腔内积聚以及钙平衡失调的状态,即内质网应激。缺血、缺氧、高血糖、热休克等因素可诱导内质网应激[13]。早期的内质网应激是机体自身代偿的过程,对细胞具有保护作用;如果这种失衡超过了机体自身调节的能力,最终的结局将是细胞死亡,组织器官受损。GRP78是定位于内质网的一个重要的分子伴侣,它已被广泛用于作为内质网应激的一个指标[14]。p-ERK是在内质网应激信号转导中起重要作用的跨膜蛋白,即使是轻微的应激,p-ERK都表现出最至关重要的保护作用[13]。在没有应激的情况下,p-ERK和其它2个内质网应力传感器[肌醇需求酶1 (inositol-requiring enzyme 1,IRE-1)和激活转录因子6(activating transcription factor 6,ATF6)]与GRP78形成稳定的复合物。而当蛋白错误折叠或未折叠蛋白增多时促使GRP78与其解离,刺激下游信号的激活[15]。GRP78和p-ERK是与内质网应激相关的重要蛋白,是内质网应激的标记。
为了探求GSP对CP引起肾小管细胞损伤保护作用的机制,本研究应用蛋白印迹及免疫组化方法测定内质网应激相关蛋白GRP78和p-ERK在各组小鼠肾组织中的表达。结果表明,GRP78和p-ERK 在CP组表达明显升高,说明CP组存在内质网应激的上调,内质网应激导致肾小管受损,肾功能下降,与既往报道一致[7]。而经过GSP处理后,GRP78和p-ERK表达明显下降,肾小管受损减轻,肾功能改善,表明GSP通过下调内质网应激而减轻CP诱导的肾损害。国内外尚未见报道。
本研究结果证实,GSP作为一种天然强效抗氧化剂,对CP导致的肾损害有一定的保护作用,其机制可能与下调了CP引起的内质网应激有关。对于GSP在CP导致肾损害中更深层的作用机制,我们将在今后的工作中进一步深入研究。
[1]罗明,劳山.顺铂肾损伤机制的研究及进展[J].蛇志,2008,20(2):135-138.
[2]Miller RP,Tadagavadi RK,Ramesh G,et al.Mechanisms of cisplatin nephrotoxicity[J].Toxins,2010,2(11): 2490-2518.
[3]李春媚,阮颖新,刘素雁,等.卡维地洛减轻顺铂的肾损害[J].中国病理生理杂志,2008,24(1):179-181.
[4]Yao X,Panichpisal K,Kurtzman N,et al.Cisplatin nephrotoxicity:a review[J].Am J Med Sci,2007,334(2): 115-124.
[5]栗世如,钟进义.葡多酚对雄性小鼠生殖细胞辐射损伤的影响[J].卫生毒理学杂志,2000,14(4):204-206.
[6]高海青,李保应.葡萄多酚基础与临床[M].第1版.北京:人民卫生出版社,2012:29-37.
[7]Kong DY,Li Z,Gao CL,et al.Erythropoietin protects against cisplatin-induced nephrotoxicity by attenuating endoplasmic reticulum stress-induced apoptosis[J].J Nephrol,2013,26(1):219-227.
[8]Wei Q,Dong G,Franklin J,et al.The pathological role of Bax in cisplatin nephrotoxicity[J].Kidney Int,2007,72 (1):53-62.
[9]Cetin A,Kaynar L,Kocyigit I,et al.Role of grape seed extract on methotrexate-induced oxidative stress in rat liver [J].Am J Chin Med,2008,36(5):861-872.
[10]Sayed AA.Proanthocyanidin protects against cisplatin-induced nephrotoxicity[J].Phytother Res,2009,23(12): 1738-1741.
[11]Li BY,Cheng M,Gao HQ,et al.Back-regulation of six oxidative stress proteins with grape seed proanthocyanidin extracts in rat diabetic nephropathy[J].J Cell Biochem,2008,104(2):668-679.
[12]Li X,Xiao Y,Gao H,et al.Grape seed proanthocyanidins ameliorate diabetic nephropathy via modulation of levels of AGE,RAGE and CTGF[J].Nephron Exp Nephrol,2009,111(2):e31-e41.
[13]Szegezdi E,Logue SE,Gorman AM,et al.Mediators of endoplasmic reticulum stress-induced apoptosis[J].EMBO Rep,2006,7(9):880-885.
[14]Lakshmanan AP,Thandavarayan RA,Palaniyandi SS,et al.Modulation of AT-1R/CHOP-JNK-Caspase12 pathway by olmesartan treatment attenuates ER stress-induced renal apoptosis in streptozotocin-induced diabetic mice[J].Eur J Pharm Sci,2011,44(5):627-634.
[15]Van der Kallen CJ,van Greevenbroek MM,Stehouwer CD,et al.Endoplasmic reticulum stress-induced apoptosis in the development of diabetes:is there a role for adipose tissue and liver?[J].Apoptosis,2009,14(12):1424-1434.
Effect of grape seed proanthocyanidin on cisplatin-induced nephrotoxicity in mice
GAO Zhao-li,LIU Guang-yi,LI Xing,HU Zhao,YANG Xiang-dong,JIANG Bei,LI Xian-hua
(Department of Nephrology,Qilu Hospital of Shandong University,Jinan 250012,China.E-mail:lixianhua@medmail.com.cn)
AIM:To study the protective effect of grape seed proanthocyanidin(GSP)on nephrotoxicity induced by cisplatin(CP)in mice.METHODS:Male C57 mice were randomly divided into 4 groups:control group(N group,n=10),CP group(intraperitoneal injection of CP at dose of 20 mg/kg,n=20),GSP group(intragastric administration of GSP at dose of 500 mg/kg,n=15)and CP+GSP group(intragastric administration of GSP 30 min prior to intraperitoneal injection of CP and intragastric administration of the same dose of GSP 72 h later,n=20).On the 5th day after CP treatment,blood and kidney samples were collected.The renal pathological changes were examined by HE staining.The protein expression of glucose-regulated protein 78(GRP78)and phosphorylated extracellular signal-regulated kinase (p-ERK)was examined by Western blotting and immunohistochemical staining.RESULTS:Renal index,blood urea nitrogen and serum creatinine were significantly higher in CP group than those in N group.The renal tissues were heavily damaged in CP group.The protein expression of GRP78 and p-ERK increased in CP group compared with N group.GSP treatment alleviated the increase in the renal index,blood urea nitrogen and serum creatinine.The damages of the renal tissues were attenuated.The protein expression of GRP78 and p-ERK was obviously reduced in CP+GSP group compared with CP group.CONCLUSION:GSP prevents kidney from CP-induced damage by suppression of endoplasmic reticulum stress.
Cisplatin;Grape seed proanthocyanidin;Nephrotoxicity;Endoplasmic reticulum stress
R595.4;R692.5
A
10.3969/j.issn.1000-4718.2014.02.021
1000-4718(2014)02-0313-05
2013-09-17
2013-12-10
△通讯作者Tel:0531-82169315;E-mail:lixianhua@medmail.com.cn
——疾病防治的新靶标

