伴HBV感染的血细胞减少性疾病581例临床分析
康成兰,国 巍,刘春水,白 欧
伴HBV感染的血细胞减少性疾病581例临床分析
康成兰,国 巍,刘春水,白 欧*
(吉林大学第一医院肿瘤中心,吉林长春130021)
粒细胞减少症、再生障碍性贫血(aplastic anemia,AA)、自身免疫性溶血性贫血(autoimmune hemolytic anemia,AIHA)、骨髓增生异常综合征(myelodysplastic syndromes,MDS)、免疫性血小板减少症(primary immune-thrombocytopenia,ITP),以及各种营养不良性贫血、阵发性睡眠性血红蛋白尿、原因不明的血细胞减少症等是临床常见的血细胞减少性疾病。其中AA,AIHA,MDS,ITP的发病机制均与免疫功能异常相关,尤其涉及T细胞免疫。HBV病毒感染后,刺激机体免疫功能异常,可导致免疫相关血细胞减少。其特点是病情进展缓慢,早期发现困难,疗效差。近年,HBV与AA、ITP发生有关的文献已见报道。但同时分析HBV感染与临床常见的血细胞减少性疾病相关性分析尚未见报道。本研究选择伴HBV感染的MDS、AA、ITP、AIHA、血细胞减少症患者为研究对象,分析其实验室检查特点,探索乙肝病毒感染不同时期与上述血液系统疾病的可能相关性。
1 对象与方法
1.1 研究对象
2008年1月1日至2012年5月1日期间于我院血液科及肝胆胰内科住院病例,首次确诊为AA,AIHA,MDS,ITP、其他血细胞减少症的成年患者(大于等于18岁)共计1414例。
1.2 研究方法
所有血液病及肝病诊断符合全国统一诊断标准:ITP、AIHA、AA、血细胞减少症的诊断,符合张之楠主编的《血液系统疾病诊断及疗效判定》[1]。MDS诊断符合2001年WHO骨髓增生异常综合征分类标准[2]。肝炎病毒感染的临床和病原学诊断符合2000年修订的《病毒性肝炎防治方案》有关标准[3]。
1.3 HBV临床检测指标
应用酶联免疫法检测血清HBsAg、HBsAb、HBcAb、HBeAg、HBeAb 5项指标。因HBV感染血清学异常代表不同感染阶段,本研究分为:1、5项均为阴性或仅HBsAb阳性,为正常结果。2、HB-sAg+,HBV感染早期。3、伴HBsAb+的组合,包括HBsAb+HBcAb+HBeAb+,HBsAb+HBcAb+,HBsAb+HBeAb+代表HBV感染恢复期。4、不伴HBsAb+的异常结果,包括HBcAb+HBeAb+,HBcAb+,HBeAb+代表HBV感染后病毒清除期。
1.4 统计学方法
组间年龄以_x±s表示,由于AA组患者年龄为非正态分布,因此采用Mann-Whitney U比较组间差异,性别差异采用χ2检验。HBV血清标记物阳性率比较采用χ2检验。比较检验水准α=0.05。所有统计分析采用SPSS17.0统计软件完成,P<0.05,差异有显著性意义。
2 结果
2009年1月1日至2013年5月1日我院血液科及肝病科住院病人,纳入1414例病例,行乙肝病毒检测者1139例,检查率80.55%,结果异常581例,异常检出率51.01%,HBsAg阳性者68例,阳性率5.97%。
2.1 血细胞减少性疾病患者HBsAg阳性率、年龄及性别比较
在1139例行HBV病原检测患者中,MDS、AA、ITP、AIHA/血细胞减少症患者分别166、216、586、189人;HBsAg阳性率分别12.05%,6.02%,4.75%,4.23%;男女比分别1∶0.8,1∶1.12,1∶2.12,1∶1.17;中位年龄分别49.5,52.5,28,46岁。MDS组HBsAg阳性率最高;ITP组女性比例最高,中位年龄最小;P值均<0.05,差异有显著性(见表1)。
2.2 581例HBV感染的血细胞减少性疾病患者乙肝血清标志物异常情况
HBV感染血清标记物异常情况中,HBsAg为标志性抗原,HBsAb为标志性抗体。581例HBV血清标记物检测异常的血细胞减少性疾病患者中,HBsAg阳性68例,HBsAg与HBsAb同时阴性71例,含有HBsAb阳性的异常结果442例(76%)。其中,MDS组HBsAg阳性率最高;ITP组含HB-sAb阳性的异常结果比例最高,差异均有显著性。(详见表2)
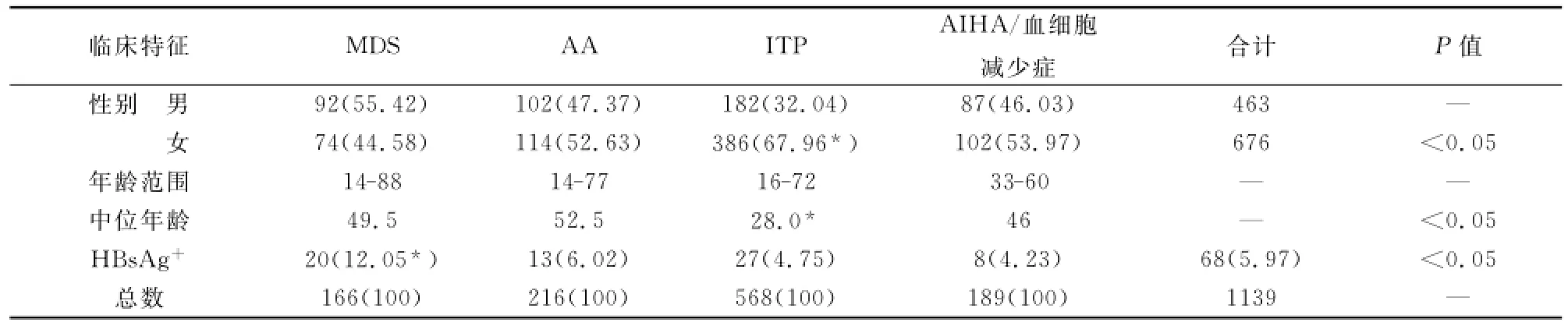
表1 血细胞减少性疾病患者HBsAg阳性率、年龄及性别比较[n(%)]
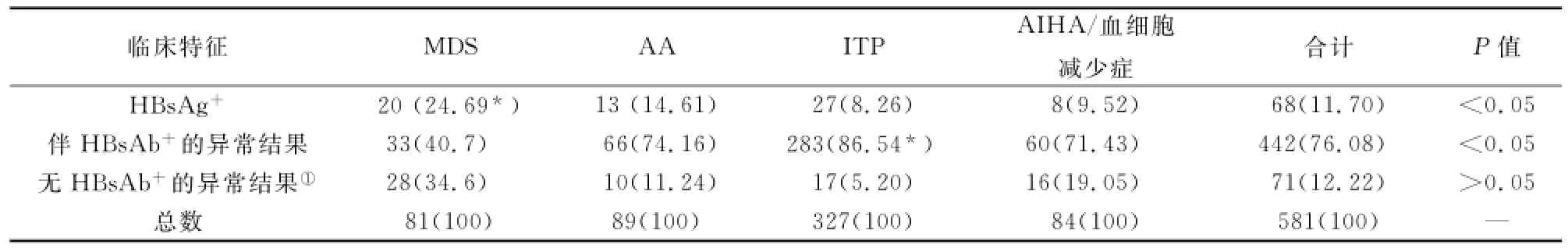
表2 伴HBV感染的血细胞减少性疾病标志性血清标记物阳性率比较[n(%)]
2.3 HBsAg阳性的MDS患者的WHO分型与遗传学特征
2.3.1 WHO分型特征 依据WHO标准分型:(1)20例HBsAg阳性MDS患者中RCMD/RCMDRS 70%(14/20),RAEB-1/2 20%(4/20),其他10%(2/20)。(2)81例HBV血清检测结果异常的MDS患者中RCMD/RCMD-RS 38例(46.9%),RAEB-1/2 29例(35.8%),其余(RA/RAS/MDS-U)14例(17.3%)。(3)219例同期住院诊断MDS患者(不论是否行HBV血清学检测)中,RCMD/RCMD-RS 109例(49.8%),RAEB-1/2 81例(37.0%),其余(RA/RAS/MDS-U)29例(13.2%)。比较结果,HBsAg阳性组RCMD/RCMD-RS所占比例最高,差异具有显著性(经χ2检验,χ2=5.079,P<0.05)(见表3)。
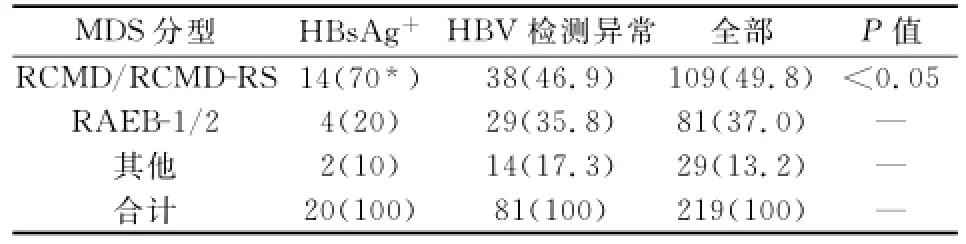
表3 HBsAg+、HBV血清标志物异常及全部MDS患者WHO分型比较[n(%)]
2.3.2 遗传学特征 20例HBsAg阳性MDS患者,13例能够并完成了染色体检查,均为正常核型,异常率为0。全部同期诊断的219例MDS患者,76例完成染色体检查(筛查率34.7%),异常25例(异常率32.9%)。
3 讨论
3.1 常见血细胞减少性疾病与HBV感染
本文行乙肝病毒检测的1139例血细胞减少性疾病患者中,HBV血清标志异常检出率51.01%,高于我国城市人群自然感染率43.51%[4]。HBsAg阳性率5.97%,MDS患者HBsAg阳性率12.05%,均高于我国一般人群HBsAg阳性率4.62%[5],差异具有显著性。HBV感染与外周血细胞减少有关,HBV感染人群应该监测血象,高度注意血液系统相关疾病并发症。
HBV感染后血清标记转换的意义已被广泛报道,各种标记物的出现分别对应着HBV感染的自然病程[6]:①病毒感染早期(病毒活跃期),HBsAg阳性。②随后,HBV作为抗原刺激免疫清除反应发生,HBsAg转阴但保护性抗体HBsAb尚未出现,是HBV清除阶段,可逐渐出现除HBsAb以外的HB-cAb、HBeAb[7]。③清除反应接近尾声时,HBsAb转为阳性,感染进入恢复期[8],机体对HBV产生抵抗力。因此临床认为HBV感染早期,病毒清除期,感染后恢复期,分别以HBsAg阳性,HbsAg与HBs-Ab同时阴性,HbsAg阴性而HBs-Ab阳性为代表性血清学标记。
本资料中,HBsAg阳性率,MDS患者12.05%,显著高于我国一般人群所统计的4.62%。ITP、AIHA、AA及血细胞减少症患者的HBV血清标记异常情况,以抗体异常为主(指HBsAg情况下的抗体异常),比例高达59.3%。依表2所示,76.1%的血细胞减少性疾病的患者处于HBV感染后恢复期,比例显著高于感染早期及清除期,差异具有显著性,意味着HBV感染后恢复期(慢性期)与血象所见的血细胞减少性改变的关系密切。同时,从我们的数据中发现,存在HBV感染的血细胞减少性疾病病例中,其所患疾病的种类与HBV感染不同阶段似乎有关,感染早期(HBsAg阳性),骨髓存在病态造血的MDS样改变比例最高。感染恢复期,免疫性血细胞减少疾病(ITP、AIHA)比例最高,见图1。
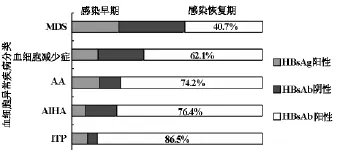
图1 各类疾病比例与HBV感染的自然病程关系
3.2 机制探讨
HBV感染后引起细胞-体液免疫异常,T细胞介导的病毒特异性细胞免疫最为重要[9-12]。骨髓增生异常综合征(MDS)是一种造血干细胞克隆性疾病,以骨髓病态造血及高转白风险为特征,属于骨髓衰竭性疾病[13]。综合细胞培养、遗传学、分子生物学的大量研究证实,MDS免疫机制中以T细胞介导的细胞免疫异常活化最为重要[14-16]。HBV感染后经过最初的免疫耐受期[17]。随着T细胞增殖分化成为特异性效应细胞,T细胞(Tc)开始发挥显著的清除功能,进入病毒清除期[18,19],此时HBsAg多为阳性,HBV-DNA滴度显著增高。这一阶段细胞免疫活性最强,骨髓受到打击后,虽然尚存在部分造血功能却无法保证正常造血的质量,便可能发生本研究显示的伴HBsAg+而不伴遗传学异常的“MDS”。当免疫耐受被完全打破后,Th与Tc细胞向Ⅰ型细胞极化,细胞毒性细胞激活凋亡途径或释放IFN-γ、IL-2、TNF-β等抑制性细胞因子,抑制骨髓正常造血,可能发生HBV相关性AA[20-23]。此后,抗原数量逐渐下降,免疫效应细胞数量和功能逐渐下调,机体进入免疫恢复阶段[24],Th细胞功能逐渐取代Tc细胞,进入病毒感染清除后期。HBsAg逐渐转阴,血清中可检测到HBcAb HBeAb。最后,进入恢复/慢性期,产生了保护性抗体HBsAb。当Th2细胞占绝对优势时,能够介导自身体液免疫产生抗血小板或红细胞的抗体,抗原抗体复合物在单核-巨噬细胞系统被破坏,外周血中血小板或红细胞数量减少[2526],可能导致ITP AIHA发生。因此,HBV感染引起的免疫反应是由非特异性免疫向特异性免疫过渡,Th1细胞功能为主的细胞免疫逐渐向Th2细胞介导的体液免疫过渡的过程。结合本研究,HBV相关的血细胞异常为“MDS”样改变,免疫性相关的ITP AIHA以及AA。
综上,ITP、MDS、AA、AIHA、血细胞减少症患者中HBV感染率比我国一般人群高,提示HBV感染与这几种血细胞减少性疾病发生有关。其中“MDS”表现为以RCDM为主的病态造血,而不伴有遗传学改变。随着感染HBV后免疫调节机制的转变,血清标记的转换,有可能发生各种血细胞异常疾病,其中,MDS样改变发生于最早期,随后是ITP AIHA以及AA。发生机制涉及HBV引起的T细胞免疫功能调节异常。
[1]张之南,沈 悌,主编.血液病诊断及疗效标准[M].第2版.北京:科学出版社,1998:279.
[2]Bennett J M.World Health Organization classification of the acute leukemia and myelodysplastic syndrome[J].Int J Hematol,2000,72:131.
[3]梅长林,李 石(主编).病毒性肝炎的诊断标准,中国内科年鉴[M],上海:第二军医大学出版社,2001:563.
[4]梁晓峰,陈园生,王晓军,等.中国3岁以上人群乙型病毒性肝炎血清流行病学研究[J].中华流行病学杂志,2005,26(9):655.
[5]全国人群乙肝血清流行病学调查结果[M/OL].中国疾病预防控制中心,2008[2008-04-23].http://www.chinacdc.net.cn/n272442/n272530/n3246177/23316.html
[6]中华医学会肝病学分会.中华医学会感染学分会.慢性乙型肝炎防治指南[J].中华肝脏病杂志,2005,13(12):881.
[7]Don Ganem,Alfred M.Prince.HBV感染的自然病程和临床结局[M/OL].检验通讯.厦门:英科新创科技有限公司,2008[2008-08].http://www.asintec.com/info.php page=0&id=72.
[8]Klaus-Peter Maier,郝连杰(主编).肝炎及其后果—急性与慢性肝病的诊断、治疗和预防[M].北京:人民卫生出版社,2001:18-43.
[9]Kim SK,Welsh RM.Comprehensive early and lasting loss of memory CD8Tcells and functional memory during acute and persistent viral infections[J].J Immunol,2004,172(5):3139.
[10]Barber DL,Wherry EJ,Masopust D,et al.Restoring function in exhausted CD8Tcell s during chronic viral infection[J].Nature,2006,439(7077):682.
[11]骆抗先(主编).乙型肝炎基础和临床[M].第2版.北京:人民卫生出版社,2001:188-189.
[12]Perrillo RP.Acute flares in chronic hepatitis B:the natural and unnatural history of an immunologically mediated liver disease[J].Gastroenterology,2001,120(4):1009.
[13]陶 思,孙汉英,刘文励.骨髓增生异常综合征免疫学发病机制新进展[J].临床血液学杂志,2008,21(9):504.
[14]Matsuda M,Maeda Y.Establishment of a myelodysplastic syndrome(MDS)/secondary AML-derived T lymphoid cell line K2-MDS[J].Leuk Res,2000,24:103.
[15]Melenhorst JJ,Eniafe R,Follmann D,et al.Molecular and flow cytometric characterization of the CD4and CD8T-cell repertoire in patients with myelodysplastic syndrome.[J].Br J Haematol,2002,119(1):97.
[16]Stucki A,Hayflick JS,Sandmaier BM,et al.Antibody engagement of intercellular adhesion molecule 3triggers apoptosis of normal and leukaemic myeloid marrow cells[J].Br J Haematol,2000,108(1):157.
[17]Bertoletti A,Ferrari C.Kinetics of the immune response during HBV and HCV infection[J].Hepatology,2003,38(1):4.
[18]Rehermann B.Immune responses in hepatitis B virus infection[J].Semin Liver Dis.2003,23(1):21.
[19]Nieters A,Yuan JM,Sun CL,et al.Effect of cytokine genotypes on the hepatitis B virus-hepatocellular carcinoma association[J].Cancer,2005,103(4):740.
[20]达万明,黄文荣.病毒感染与再生障碍性贫血[J].中国实用内科杂志,2002,22(3):133.
[21]Zeng W,Kajigaya S,Chen G,et al.Transcript profile of CD4+and CD8+T cells from the bone marrow of acquired aplastic anemia patients[J].Exp Hematol,2004,32(9):806.
[22]Hara T,Ando K,Tsurumi H,et al.Excessive production of tumor necrosis factor-alpha by bone marrow T lymphocytes is essential in causing bone marrow failure in patients with aplastic anemia[J].Eur J Haematol,2004,73(1):10.
[23]Giannakoulas NC,arakantza M,Theodorou GL,et al.Clinical relevance of balance between type 1and type 2immune responses of lymphocyte sub-populations in aplastic anaemia patients[J].Br J Haematol,2004,124(1):97.
[24]Thimme R,Wieland S,Steiger C,et al.CD8(+)T cells mediate viral clearance and disease pathogenesis during acute hepatitis B virus infection[J].J Virol,2003,77(1):68.
[25]Stasi R,EvangelistaML,Stipa E,et al.Idiopathic thrombocytopenic purpura:current concepts in pathophysiology and management[J].Thromb Haemost,2008,99(1):4213.
[26]McMillan R.The pathogenesis of chronic immune thrombocytopenic purpura[J].Semin Hematol,2007,44(4Suppl 5):S3.
2013-02-20)
1007-4287(2014)02-0269-04
*通讯作者

