紫杉醇热敏脂质体的制备与质量控制
李志平,赵希青,,赵诗情,,张慧,刘燕,肖若蕾
(1.军事医学科学院毒物药物研究所,北京 100850;2.湖北科技学院药学院,咸宁 437100)
紫杉醇热敏脂质体的制备与质量控制
李志平1,赵希青1,2,赵诗情1,2,张慧1,刘燕1,肖若蕾2
(1.军事医学科学院毒物药物研究所,北京 100850;2.湖北科技学院药学院,咸宁 437100)
目的 制备紫杉醇热敏脂质体,建立测定其含量、有关物质及溶血磷脂的方法,考察其含量、有关物质、溶血磷脂量以及体外溶血性。方法采用高效液相色谱(HPLC)-紫外法检测制剂含量及有关物质,HPLC-电雾式检测器检测制剂中溶血磷脂单棕榈酰磷脂酰胆碱的量,并对检测方法进行验证;分光光度法测定体外溶血百分率。结果紫杉醇在60.39~181.17 μg·mL-1范围内峰面积与浓度线性关系良好,回收率及精密度实验均符合要求;有关物质测定方法专属性、灵敏度和系统适用性均符合要求;溶血磷脂测定方法的专属性和灵敏度符合有关规定,在1.5~50.0 μg·mL-1范围内峰面积与浓度线性关系良好,回收率、重复性均符合要求;3批自制紫杉醇热敏脂质体的含量在90.0%~110.0%之间,单个杂质含量均<0.5%,总杂质含量均<2.0%,体外基本不引起溶血。结论含量、有关物质及溶血磷脂检测方法均可用于紫杉醇热敏脂质体的质量评价,自制紫杉醇热敏脂质体各项指标均符合要求,且质量稳定。
紫杉醇热敏脂质体;溶血性;色谱法,高效液相;质量控制
紫杉醇(paelitaxel)是目前应用于临床的一线广谱抗肿瘤药物[1-2],但市售制剂(如注射剂及注射用紫杉醇脂质体)可产生肝脏毒性、神经毒性和心血管毒性等多种严重不良反应,这不仅与药物自身性质有关,同时也与制剂中使用的辅料、溶媒如聚氧乙烯蓖麻油(cremophor EL)、无水乙醇,以及制剂形式有关[2-3]。为降低辅料及溶媒所产生的毒性和不良反应,增加病灶局部的药量,降低全身副作用,本实验室制备了紫杉醇热敏脂质体(long-circulating temperature-sensitive liposomes with paclitaxel,LTSLP)[4-5],该制剂经实验证实具有增效减毒效果,具有良好的应用前景。为保证所制备LTSLP的质量,笔者在本实验中对LTSLP进行了系统的质量研究。
1 仪器与试药
1.1 仪器 高效液相色谱仪(Hitachi公司,2130型), Corona电雾式检测器(美国ESA公司),色谱柱(Agilent,Vensuil XBP C8,4.6 mm×250 mm,5 μm)。
1.2 试药 紫杉醇原料(桂林晖昂生物制药有限公司,批号:JF20090303,纯度:99.9%)。二棕榈酰磷脂酰胆碱(dipalmitoyl phosphatidylcholine,DPPC,批号: A71289,纯度:99.8%)、溶血磷脂单棕榈酰磷脂酰胆碱(monostearoylphosphatidylcholine,MSPC,批号: B70309,纯度:99.1%)、甲氧基聚乙二醇磷脂酰乙醇胺(monomethoxypolyethyleneglycol-distearoyl phosphatidylethanlamine,mPEG-DSPE,批号:K0986,纯度:99.8%)、蛋黄卵磷脂(egg phosphatidylcholine, EPC,批号:108072-3,纯度:98.6%),二硬脂酰磷脂酰甘油(distearoyl phoaphatidyl glycerol,DSPG,批号: 1010902,纯度:99.0%)均购自Avanti polar lipids公司,紫杉醇对照品(批号:100382-200701,纯度: 99.6%)、三杉尖宁碱(杂质A,批号:100926-200701)、10-去乙酰基7-表紫杉醇(杂质B,批号:100925-200701)及7-表紫杉醇(杂质C,批号:100927-200701)对照品均购自中国食品药品检定研究院;甲醇为色谱纯,其余试剂为分析纯。
2 方法与结果
2.1 LTSLP的制备 采用薄膜分散法制备LTSLP。分别称取处方量的DPPC、MSPC、mPEG-DSPE、DSPG、EPC及紫杉醇置于茄形瓶中,加入适量三氯甲烷溶解,然后在抽真空条件下旋转蒸发除去有机溶剂,以形成磷脂膜;向磷脂膜中加入10 mmol·L-1磷酸盐缓冲溶液(pH7.0),在60℃条件下水化30 min,所形成的混悬液在氮气流下经200 nm聚碳酸酯膜均质挤出即得LTSLP[6]。
2.2 LTSLP质量研究
2.2.1 性状 所制备的3批样品均为略带蓝色乳光的半透明液体。
2.2.2 含量测定
2.2.2.1 检测方法 取LTSLP适量,置于50 mL量瓶,加甲醇-冰醋酸(400∶1)使溶解并稀释至刻度,摇匀,精密量取10 μL注入液相色谱仪,进行分析;另取紫杉醇对照品适量,精密称定,同法测定。按外标法以峰面积计算其中紫杉醇的含量[7]。
HPLC参数:流动相为乙腈-水(30∶70,V/V);流速1.0 mL·min-1;色谱柱:Venusil XBP-C8(4.6 mm× 250 mm,5 μm);检测波长227 nm;柱温25℃;进样量10 μL。
2.2.2.2 方法学验证 ①专属性:分别配制空白辅料及紫杉醇对照品的甲醇-冰醋酸(400∶1)溶液作为对照溶液,按照“2.2.2.1”项方法考察紫杉醇含量检测方法的专属性。结果表明,紫杉醇峰形良好,空白辅料不干扰其测定,说明本色谱方法的专属性良好。
②线性关系:取紫杉醇对照品适量,精密称定,用甲醇-冰醋酸(400∶1)溶解并稀释至刻度,配制成浓度约为0.4 mg·mL-1的标准储备液,然后分别稀释成浓度约为60,80,100,120,140,160,180 μg·mL-1的系列溶液,照“2.2.2.1”中方法检测,绘制标准曲线。结果表明,紫杉醇峰面积与浓度间的线性回归方程为:Y= 465 684X+878 444,r=0.999 8,说明紫杉醇在60.39~181.17 μg·mL-1范围内峰面积与浓度呈良好的线性关系。
③回收率:取紫杉醇对照品适量精密称定,用甲醇-冰醋酸(400∶1)溶解并稀释至刻度,制备浓度约为0.5 mg·mL-1的标准储备液;另取处方量的空白辅料置于量瓶中,精密加入标准储备液适量,配制成浓度分别为96 μg·mL-1(80%)、120 μg·mL-1(100%)、144 μg·mL-1(120%)的供试液,每个浓度平行配制3份;另平行配制浓度为120 μg·mL-1的对照溶液2份。照“2.2.2.1”项方法检测,计算回收率。结果表明,各样品的回收率均在98%~102%之间,高、中、低浓度的平均回收率分别为100.20%,98.45%, 98.88%,RSD为0.94%,均符合要求。
④重复性和精密度:精密量取LTSLP适量,加甲醇-冰醋酸(400∶1)溶解并稀释至刻度,配制成浓度约为120 μg·mL-1的供试液,平行制备6份,照“2.2.2.1”项方法检测,计算样品中主药含量及其RSD。结果表明,6份样品的含量在95.60%~99. 79%之间,RSD为1.69%,表明方法的重复性良好。
照重复性实验方法,改变检测时间、分析人员及检测仪器,测定LTSLP中紫杉醇的含量,计算重复性及中间精密度实验中共12份样品的含量及其RSD。结果表明,12份样品的含量在95.26%~99.79%之间, RSD为1.53%,表明方法的中间精密度良好。
⑤溶液稳定性实验:精密量取LTSLP适量,用甲醇-冰醋酸(400∶1)配制成浓度约为120 μg·mL-1的供试液,室温避光保存分别于0,0.5,1,1.5,2,4 h照“2.2.2.1”项方法检测。结果表明,放置不同时间后紫杉醇峰面积的RSD为1.08%,说明样品溶液在室温避光条件下放置4 h稳定。
综合以上结果,该含量测定方法准确可靠,可用于LTSLP中紫杉醇的含量测定。
2.2.2.3 自制样品中紫杉醇含量的检测 分别对3批LTSLP中紫杉醇的含量进行检测。结果表明,3批样品中紫杉醇的含量分别为100.5%,97.5%及104.0%,均在90.0%~110.0%之间。
2.2.3 有关物质检测
2.2.3.1 检测方法 取LTSLP适量,加入甲醇-冰醋酸-三氯甲烷(400∶1∶100)混合溶液适量破膜,涡旋使之溶解,定容后摇匀,用孔径0.45 μm有机膜滤过,制备成浓度约为0.5 mg·mL-1的供试液,按照含量测定方法进行有关物质检测[7]。
2.2.3.2 方法学验证 ①专属性:配制空白溶剂及空白辅料溶液,按照有关物质检测方法检测;另取LTSLP、空白辅料以及空白溶剂适量置10 mL量瓶,分别于0.5 mol·L-1盐酸(HCl)、0.5 mol·L-1氢氧化钠(NaOH)、30%过氧化氢(H2O2)、强光[(4 500± 500)lx]以及100℃条件下放置不同时间,使紫杉醇的降解程度为10%~30%,加入甲醇-冰醋酸-三氯甲烷(400∶1∶100)混合溶液溶解并定容,按照有关物质检测方法进行检测。结果显示,空白溶剂及空白辅料不干扰紫杉醇及其有关物质的测定;LTSLP经强酸、强碱、氧化、光照及高温破坏后,所产生的降解产物与主药以及降解产物之间均能良好分离,空白辅料及空白溶剂均不影响主药以及降解产物的测定,说明本方法专属性良好。
②系统适用性:取紫杉醇、杂质A、杂质B和杂质C对照品适量,用甲醇-冰醋酸-三氯甲烷(400∶1∶100)混合溶液溶解并稀释制成约含0.5 mg·mL-1紫杉醇、2.5 μg·mL-1杂质A、2.5 μg·mL-1杂质B和2.5 μg·mL-1杂质C的溶液,作为系统适用性供试溶液。照有关物质检测方法检测。结果表明,紫杉醇及各已知杂质峰之间的分离度均>2.51,理论板数均> 14 280,且重复进样6次,各峰面积的RSD均<0.52%,说明本方法的系统适用性良好。
③灵敏度:精密量取紫杉醇、杂质A、杂质B和杂质C对照品适量,用甲醇-冰醋酸-三氯甲烷(400∶1∶100)混合溶液溶解并稀释至不同浓度,照有关物质测定方法检测,测定紫杉醇及各已知杂质的检测限和定量限。结果表明,紫杉醇、杂质A、杂质B和杂质C的检测限分别为1.5,1.5,1.5,3 ng,定量限分别为4,4, 4,11 ng。
综合以上结果,该有关物质测定方法专属性好,灵敏度高,可用于LTSLP中紫杉醇的有关物质测定。
2.2.3.3 自制样品有关物质的检测 分别对3批自制LTSLP中的有关物质进行检测,结果表明,3批样品中杂质A的含量分别为0.22%,0.23%及0.21%,其他最大单个杂质的含量分别为0.29%,0.25%及0.26%,总杂质的含量分别为0.82%,0.71%及0.75%。《中华人民共和国药典》2010年版中收载了紫杉醇相关制剂,要求杂质Ⅰ(杂质Ⅰ峰面积乘以校正因子1.26)与其他单个杂质均不得超过0.5%,各杂质之和不得超过2.0%,因此自制LTSLP的有关物质符合《中华人民共和国药典》2010年版要求。
2.2.4 溶血磷脂MSPC的检测
2.2.4.1 检测方法 取LTSLP适量,置于50 mL量瓶中,加甲醇溶解并稀释至刻度,采用HPLC-CAD法测定溶血磷脂含量。HPLC参数:流动相A为甲醇,流动相B为0.1 moL·L-1醋酸胺缓冲液(pH4.8),流速1 mL·min-1,色谱柱为Vensuil XBP C8(4.6 mm× 250 mm,5 μm),柱温30℃,进样量10 μL,洗脱方法为梯度洗脱,洗脱程序见表1。Corona检测器参数:气源:氮气;工作气压:35 psi;滤波时间参数:低;满量程输出范围:200pA。

表1 溶血磷脂含量测定的梯度洗脱程序Tab.1 Gradientelutionprogramforcontent determination of MSPC
2.2.4.2 方法学验证 ①专属性:分别配制DPPC、MSPC、mPEG-DSPE、DSPG、EPC及紫杉醇对照品的甲醇溶液作为对照溶液,按照“2.2.4.1”项方法考察溶血磷脂的专属性。结果见图1。由图1可知,溶血磷脂(MSPC)的出峰时间合理,峰形良好,且MSPC与相邻峰的分离度均>3,其他物质不干扰MSPC的测定,说明本色谱方法的专属性良好。
②灵敏度:取一定浓度的MSPC标准溶液,用甲醇倍比稀释后,按照“2.2.4.1”方法检测,考察检测限和定量限,结果见图2。结果表明,MSPC的检测限和定量限分别为4和12 ng。
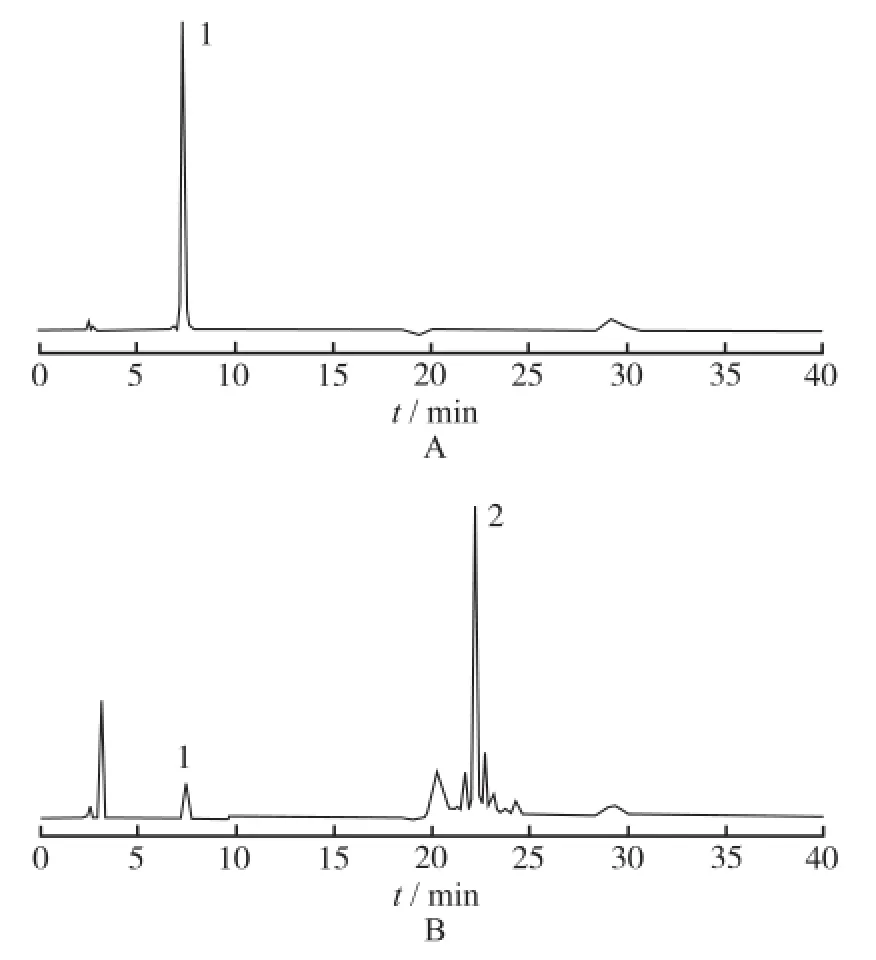
1.MSPC;2.紫杉醇图1 MSPC(A)及TSLP(B)的HPLC色谱图1.MSPC;2.paslitaxelFig.1 HPLC chromatagrams of MSPC(A)and TSLP (B)
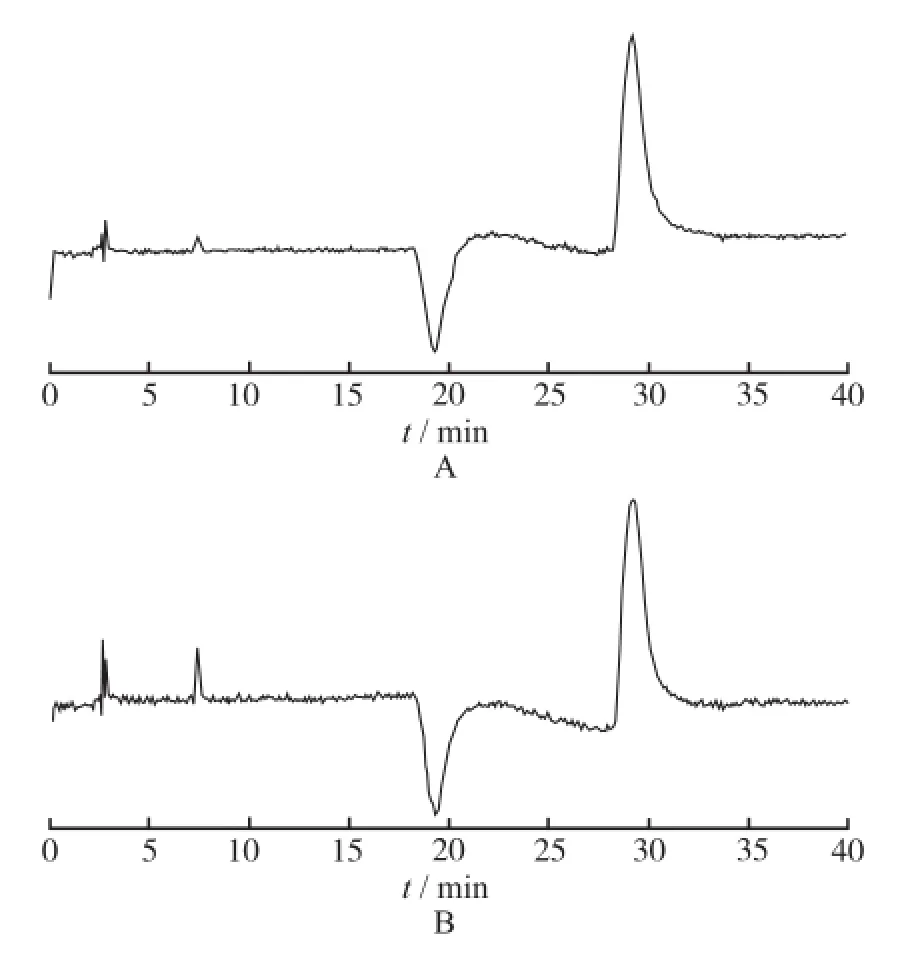
图2 MSPC的检测限(A)及定量(B)限色谱图Fig.2 Chromatagrams of MSPC at the limits of detection(A)and quantification(B)
③线性关系考察:精密称取MSPC适量置于量瓶中,以甲醇溶解定容后配制成浓度约为100 μg·mL-1的储备液,分别稀释成浓度为1.5,10,20,30及50 μg ·mL-1标准溶液,按照“2.2.4.1”方法检测,绘制标准曲线。结果MSPC峰面积与浓度的线性回归方程为Y=16 087X+10 895,r为0.999 8,说明MSPC在1.5~50.0 μg·mL-1范围内峰面积与浓度线性关系良好。
④重复性:精密吸取LTSLP适量至50 mL量瓶,用甲醇破膜溶解,配制成MSPC浓度约为30 μg·mL-1的溶液,平行配制6份,按照“2.2.4.1”项方法检测。结果表明,实测MSPC含量平均为1.73 mg·mL-1,6份样品测定结果的RSD为1.77%,说明方法的重复性良好。
⑤回收率:分别按处方比例精密称取除MSPC外的原辅料置100 mL量瓶,以甲醇溶解后定容,作为空白辅料溶液;精密吸取MSPC对照溶液至相应比例的空白辅料溶液中,配制浓度分别为24 μg·mL-1(80%)、30 μg·mL-1(100%)、36 μg·mL-1(120%)的供试液,每个浓度平行配制3份;另平行配制浓度为30 μg·mL-1的MSPC对照溶液2份;按照“2.2.4.1”项下方法检测,考察方法的回收率。结果各样品的回收率均在98%~102%,高、中、低浓度的平均回收率分别为101.63%,99.00%,101.04%,RSD<2%,符合要求。
综合以上结果,该溶血磷脂测定方法准确、可靠、灵敏度高,可用于LTSLP中溶血磷脂的检测。
2.2.3.3 自制样品中溶血磷脂的含量检测 分别对3批自制LTSLP中的溶血磷脂进行检测。结果表明,3批样品中的溶血磷脂MSPC的量分别为1.71,1.73及1.69 mg·mL-1。《英国药典》2010年版丙泊酚注射剂标准中规定溶血磷脂限度不得大于2 mg·mL-1[8],参照这一标准,本品中溶血磷脂量低于2 mg·mL-1,符合《英国药典》2010年版要求。
2.2.3.4 体外溶血性考察 取兔耳缘静脉血10 mL,加入玻璃珠振摇10 min后,加入10倍量5%葡萄糖溶液,摇匀,3 000 r·min-1离心5 min(r=5 cm),除去上清液,所得红细胞沉淀继续用5%葡萄糖溶液洗涤至上清液不显红色,离心,弃去上清液,得红细胞。取红细胞2 mL,用5%葡萄糖溶液配成2%混悬液100 mL,备用。
取洁净试管5只,1~3号管作为供试品管,4号管为阴性对照管,5号管为阳性对照管。根据LTSLP的临床应用方案,以稀释5倍后的LTSLP为样品溶液,即:1~3号管中加入用5%葡萄糖溶液稀释5倍后的LTSLP悬液2.5 mL,4号管中加入5%葡萄糖溶液2.5 mL,然后向1~4号管中分别加入2%红细胞混悬液2.5 mL,摇匀,备用。5号管中加入2%红细胞混悬液2.5 mL后,3 000 r·min-1离心5 min(r=5 cm),吸取上层无色溶液1.5 mL后,加入纯化水4 mL,摇匀,备用。将各试管置(37±0.5)℃水中温育3 h, 3 000 r·min-1离心5 min(r=5 cm)后,取适量上清液,稀释后于波长398 nm处测定吸光度,计算溶血百分率[9]。
结果3批样品溶血百分率分别为2.67%,3.12%和2.54%,说明本品基本不引起溶血作用。
3 讨论
溶血磷脂可以增加分子渗透、杀菌、溶血以及药物亲和性等[5],这使得溶血磷脂具有诱使细胞形状改变、促进细胞融合、引起溶血以及改变细胞渗透性等特点[10]。YEAGLE和MARTIN等[10-11]研究结果证明,仅在高浓度下溶血磷脂才会导致细胞溶血,低浓度的溶血磷脂能够抑制细胞膜融合,这可能与低浓度溶血磷脂可诱使磷脂脂质体呈交插脂双层结构而抑制膜融合有关。
本研究在LTSLP中加入了少量溶血磷脂MSPC,以实现在相变温度下药物迅速释放的目的。为进一步控制溶血磷脂的含量,避免在该热敏脂质体贮存及使用过程中溶血磷脂量超标,笔者在本实验中建立了检测溶血磷脂含量的方法。目前用于测定磷脂组成的方法中,HPLC法以操作简便、耗时少、成本低等特点成为磷脂分析的主流方法,所采用的检测器多为紫外检测器(ultraviolet detector,UV)、红外检测器(infrared detector,IR)、蒸发光散射检测器(evaporative light scattering detector,ELSD)和电雾检测器(charged aerosol detector,CAD)。采用UV及IR时,磷脂的检测灵敏度低,基线不稳定[12];ELSD和CAD属于新型检测器,两者均能消除梯度洗脱和流动相造成的分析检测方面的不良影响。CAD作为一种独特的通用检测技术,不同于ELSD检测器响应值与组分质量的对数关系,更便于计算,且具有更高的灵敏度和更好的重复性[13]。笔者在本实验中利用HPLC-CAD建立了一种检测LTSLP中溶血磷脂含量的方法,流动相采用了缓冲盐-有机溶剂体系,使得基线更为平稳,使其灵敏度提高了将近20倍[14-15]。
长循环热敏脂质体属于一种新型药物递送载体,目前尚无上市产品,其质量控制无成熟标准可供参考。尚需进一步完善有关质量控制指标,如脂质体电位、脂质体的包封体积、体外释放行为、渗透性以及光散射指数等。
[1] SINGLA A K,GARG A,AGGARWAL D.Paclitaxel and its formulation[J].Int J Pharm,2002,235(1-2):179-192.
[2] 庞丽云,王海,陈永霞,等.载紫杉醇聚乳酸聚乙醇酸共聚物纳米粒抑制人肝癌细胞HepG2的作用[J].中国组织工程研究,2013,17(3):412-418.
[3] 聂琰,林延鹏.静脉滴注紫杉醇致过敏反应三例[J].华北国防医药,2009,21(4):24-25.
[4] TERENCE T A,TYRONE M P.Thermosensitive liposomes for localized delivery and triggered release of chemotherapy [J].J Control Release,2013,169(1-2):112-125.
[5] 陆媛媛,符旭东,赵倩,等.热敏脂质体在肿瘤靶向治疗中的研究进展[J].中国医院药学杂志,2013,33(10): 810-813.
[6] LI L,TEN H,SCHIPPER D,et al.Triggered content release from optimized stealth thermosensitive liposomes using mild hyperthermia[J].J Control Release,2010,143(2):274-279.
[7] LUO F,LI Z P,GUO J S,et al.A simple and rapid HPLC assay of paclitaxel in thermo-sensitive liposomes[J].AJPS, 2011,6(2):76-81.
[8] British Pharmacopoeia Commission.9854,Propofol Injection [S].The Stationary Office,2010.
[9] 蔡伟惠,姚成丽,居敏俐,等.丙泊酚纳米注射液中溶血磷脂的含量测定及溶血性评价[J].中国药学杂志, 2013,48(3):212-215.
[10] 陆敬泽,陈建文,黄芬,等.溶血磷脂对磷脂脂质体行为和结构的影响[J].中国科学C辑:生命科学,1997,27 (6):503-508.
[11] YEAGLE P L,SMITH F T,YOUNG J E,et al.Inhibition of membrane fusion by lysophosphatidylcholine[J].Biochem, 1994,33(7):1820-1827.
[12] 张颖颖,杨亦文,吴彩娟,等.磷脂分析检测方法的研究进展[J].中国医药工业杂志,2006,37(1):58-62.
[13] 闫媛媛,张康逸,黄健花,等.磷脂分离、纯化和检测方法的研究进展[J].中国油脂,2012,37(5):61-65.
[14] 郭慧丽,魏瑞萍,梅兴国,等.高效液相色谱-电雾检测法测定两性霉素B脂质体中磷脂含量[J].中国医院药学杂志,2008,28(23):2053-2055.
[15] 孙浩洋,汪勇,欧仕益.HPLC-ELSD法测定大豆磷脂中磷脂酰胆碱和溶血磷脂酰胆碱含量[J].粮食与油脂, 2012,5(25):25-27.
DOI 10.3870/yydb.2014.11.024
Preparation and Quality Control of Thermo-sensitive Paclitaxel Liposomes
LI Zhi-ping1,ZHAO Xi-qing1,2,ZHAO Shi-qing1,2,ZHANG Hui1,LIU Yan1,XIAO Ruo-lei2
(1.Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China;2.Department of Pharmacy,Hubei University of Science and Technology,Xianning 437100,China)
ObjectiveTo prepare long-circulating temperature-sensitive liposomes with paclitaxel(LTSLP),develop methods for determination of paclitaxel,related substances and monostearoyl phosphatidylcholine(MSPC)in LTSLP,and the haemolysis of LTSLP invitro.MethodsHPLC-UV methods for paclitaxel content and related substances and HPLC-CAD method for MSPC in LTSLP were established and validated.Spectrophotometric method was used to determine hemolysisin vitro.ResultsThere was a good linear relationship between peak area and concentration within the range of 60.39-181.17 μg·mL-1.Recovery and precision of the method for determination of paclitaxel content met the requirements.Specificity,sensitivity,and system suitability for related substances were consistent with requirements.There was a good linear relationship between peak area and concentration within the range of 1.5-50.0 μg·mL-1for the determination of MSPC with good specificity,sensitivity and recovery. Paclitaxel contents in three batches of self-prepared LTSLP were between 90.0%and 110.0%,single related substances were below 0.5%and total impurities were below 2.0%.There was almost no hemolysis invitro.ConclusionThe methods for determining paclitaxel content,related substances and haemolysis can be used to assess the quality of LTSLP.Self-produced LTSLP consistently meet the quality standards.
Thermo-sensitive liposomes with paclitaxel;Haemolysis;HPLC;Quantity control
R97;TQ460.6
B
1004-0781(2014)11-1486-05
2013-11-02
2013-12-05
李志平(1980-),女,河南濮阳人,助理研究员,博士,研究方向:缓控释制剂。电话:010-66932654,E-mail:dearwood2010@126.com。
肖若蕾,女,副教授,硕士生导师,研究方向:缓控释制剂。电话:0715-8272135,E-mail:yxyxrl@163.com。

