C1q/TNFα相关蛋白-2球状功能区的表达、纯化及活性分析
李洪波,胡 兴,李 娜,吴东海
(1.怀化学院生命科学系,民族药用植物资源研究与利用湖南省重点实验室,湖南怀化 418008;2.中国科学院广州生物医药与健康研究院,广东广州 510530)
C1q/肿瘤坏死因子相关蛋白(C1q and tumor necrosis factor related protein,CTRP)是一类与脂联素在结构和功能上极为类似的蛋白。这些蛋白与脂联素非常相似,一般由4个不同结构域组成:N-末端的信号肽、短的可变结构域、胶原结构域和1个与补体蛋白C1q同源的C-末端的球形结构域,C-末端的球形区是其功能区[1]。在已发现的CTRPs中,CTRP2与脂联素的功能最为相似,CTRP2能快速激活AMPK、ACC及p44/42 MAPK的磷酸化信号通路;CTRP2球状结构域(gCTRP2)具有增加肝脏糖原合成、促进脂肪酸的氧化及胰岛素增敏作用。CTRPs作用机制的研究主要是利用其球状功能区蛋白[1-3]。重组全长hCTRP2蛋白已在大肠杆菌中和酵母中实现活性表达[4-5],本研究将以大肠杆菌为宿主菌,制备重组hCTRP2的球状功能区蛋白(gH2),并对其活性进行分析。
1 材料
表达菌株 BL21-codonplus(DE3)、表达载体pET32a(+)购自Invitrogen公司。镍亲和层析树脂购自Qiagen公司,分子筛Sephadex G-75购自于GE公司,抗体均购自于CST公司。8周龄的C57BL/6♂小鼠由中国科学院广州生物医药与健康研究院实验动物中心饲养。
2 方法
2.1 表达载体构建及表达产物的验证设计上游引物PF(5′-3′):5′-GCGGATCCGTGGCAGTGACCAAGAGCTA C-3′(GGATCC BamHI位 点);下 游 引 物 PR(5′-3′):5′-GCCTCGAGTCAGATTAGGAAGCCCGTAAA G-3′(CTCGAG XhoI位点);PCR扩增目标基因并构建重组载体pET32/gH2转化大肠杆菌BL21-codonplus(DE3)菌株。随机挑取数个转化子单菌落,接种至20ml含50 g·L-1Amp LB液体培养基的50 ml三角瓶中,37℃、250 r·min-1培养至 A600=0.6~0.8,加入IPTG至终浓度为0.2mmol·L-1,20℃诱导3 h,取菌液2 ml,离心得菌体,向菌体中加入含1%曲拉通X-100、3mmol·L-1PMSF的PBS溶液200μl,超声破碎,离心取上清80 μl,向其中加入20μl5×SDS-PAGE上样缓冲液,加热变性,SDS-PAGE分析目标蛋白的可溶性表达情况。
2.2 重组蛋白纯化取种子菌液1 ml,接种至200 m l抗性LB液体培养基中,37℃、250 r·min-1培养至 A600=0.6~0.8,于20℃诱导5 h,离心取菌体。镍亲合纯化参照精编分子生物学实验指南和文献进行[5-6]。将镍亲合纯化后的蛋白利用曲拉通X-114去除内毒素并浓缩,Superdex G-75分子筛纯化,具体步骤参照文献进行[7]。取不同咪唑浓度的蛋白洗脱液和经分子筛纯化收集的蛋白,加入5×SDS-PAGE上样缓冲液、经煮沸变性后,15%SDS-PAGE分析纯化情况,利用已制备的hCTRP2C-端特异体对蛋白进行Western blot验证[8]。Trx(硫氧还蛋白)的表达与纯化参照文献进行[4]。
2.3 重组蛋白活性分析C2C12于5%胎牛血清中培养至90%细胞密度,2%马血清的DMEM培养基分化培养6 d,无血清饥饿12 h,加入终浓度为1 mg·L-1Trx-gH2蛋白温育不同时间,RIPA裂解细胞,离心收集蛋白上清,12%SDSPAGE分离蛋白,转膜并利用相应抗体对相应信号通路蛋白进行Western blot分析。
C57BL/6小鼠实验操作严格按照动物委员会的相关规定开展。实验小鼠在实验前先测定其基础血糖浓度;之后,按2μg·g-1体重腹腔注射15只经12 h饥饿的8周龄♂小鼠,尾静脉取血10μl,测定注射后0-5 h的血糖浓度;同时,设注射Trx的对照实验小鼠15只(2μg·g-1体重)。
3 结果
3.1 载体构建及表达产物验证pET32/gH2重组载体测序表明质粒构建正确。重组大肠杆菌转化子经IPTG诱导前后的SDS-PAGE结果如Fig 1所示,可以看出,未经IPTG诱导重组载体BL21转化子(泳道6)在35 ku的位置没有出现明显的特异表达产物,而5株经IPTG诱导的重组载体的BL21转化子(泳道1-5)在35 ku有明显的蛋白表达(箭头所示),该蛋白的分子质量大小与预期分子质量相符。
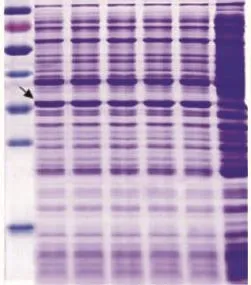
Fig 1 SDS-PAGE identification of the expression of Trx-gH2
3.2 重组蛋白的纯化SDS-PAGE分析结果表明,利用含40 mmol·L-1咪唑的漂洗缓冲液几乎不能将目标蛋白从镍亲合层析柱上洗下;当咪唑为100 mmol·L-1时,目标蛋白的纯度最高;当咪唑浓度为200和300 mmol·L-1时目标蛋白被大量洗脱但有少量杂蛋白(Fig 2-A)。将100 mmol·L-1咪唑洗脱的蛋白样品收集,曲拉通X-114除去内毒素后透析、超滤浓缩,再利用Sephadex G-75分子筛对重组蛋白进一步纯化,分子筛纯化蛋白的洗脱曲线如Fig 2-B所示。洗脱曲线第1个峰的1-5号蛋白样品经SDS-PAGE分析,结果如Fig 2-C所示,该蛋白在SDS-PAGE结果中看不到明显杂蛋白条带。利用hCTRP2的C-端特异性抗体对该蛋白进行了Western blot分析,结果如Fig 2-D所示,Western blot结果表明,蛋白洗脱曲线峰1的蛋白是Trx-gH2蛋白。
3.3 活性分析细胞信号转导的Western blot结果如Fig 3A所示,经2 mg·L-1的Trx-gH2刺激5 min,可以检测到磷酸化ACC较刺激前加强;刺激细胞10 min,ACC磷酸化程度有明显增强;当刺激细胞达30 min,ACC磷酸化的增加更为明显。由于Trx不能激活ACC的磷酸化[4],细胞刺激实验表明,大肠杆菌表达的融合蛋白Trx-gH2具有生物活性。降血糖活性测定结果表明:在注射前,两组小鼠的血糖水平没有明显差异;在注射1 h后,注射Trx-gH2小鼠的血糖要明显低于注射Trx的对照小鼠,在注射2 h后两者之间存在明显差异;在注射后的1~4 h内,注射Trx-gH2的实验组小鼠的血糖都要明显低于注射Trx的对照组小鼠,但注射后5 h,两实验组小鼠的血糖差异消失(Fig 3B)。动物实验结果证明,利用大肠杆菌表达系统生产的Trx-gH2蛋白具有降血糖活性。
4 讨论
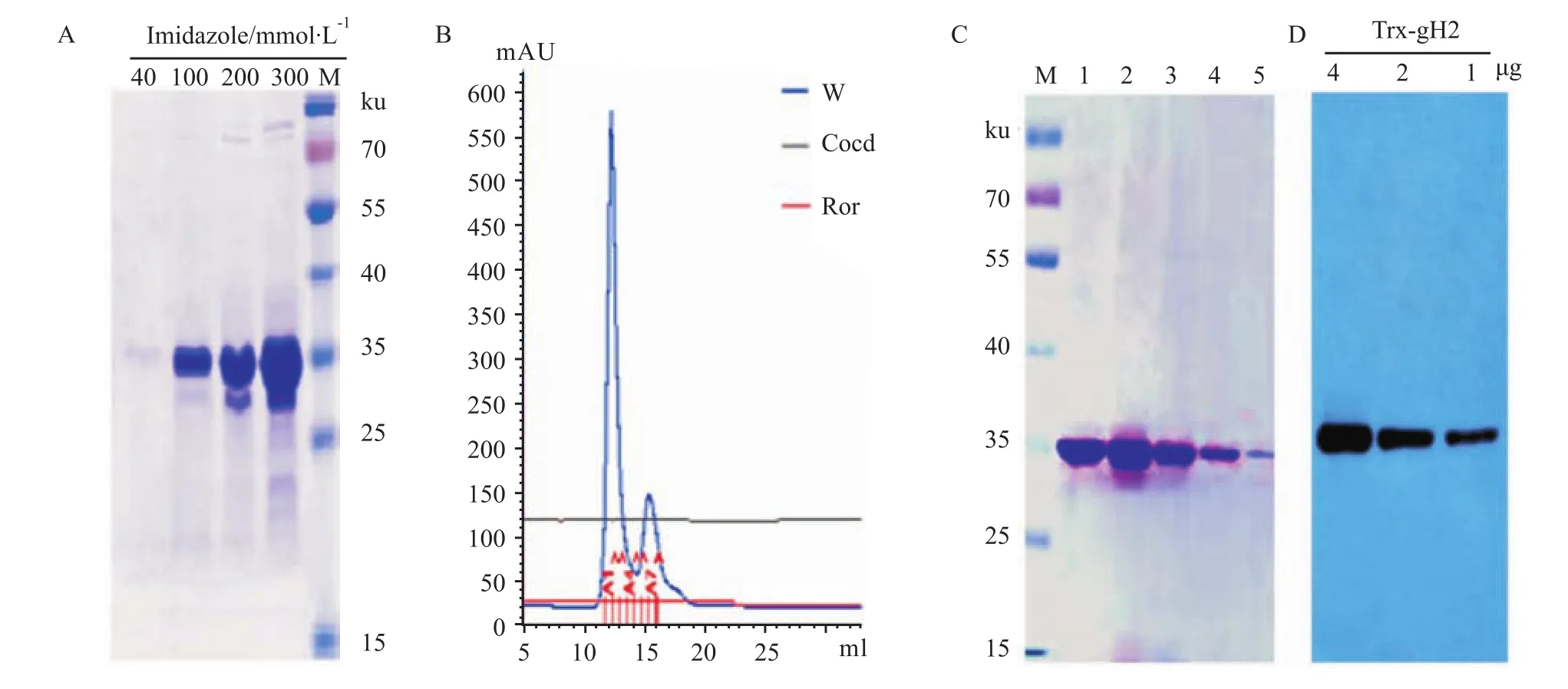
Fig 2 Purification and identification of fusion recombinant protein of Trx-gH2
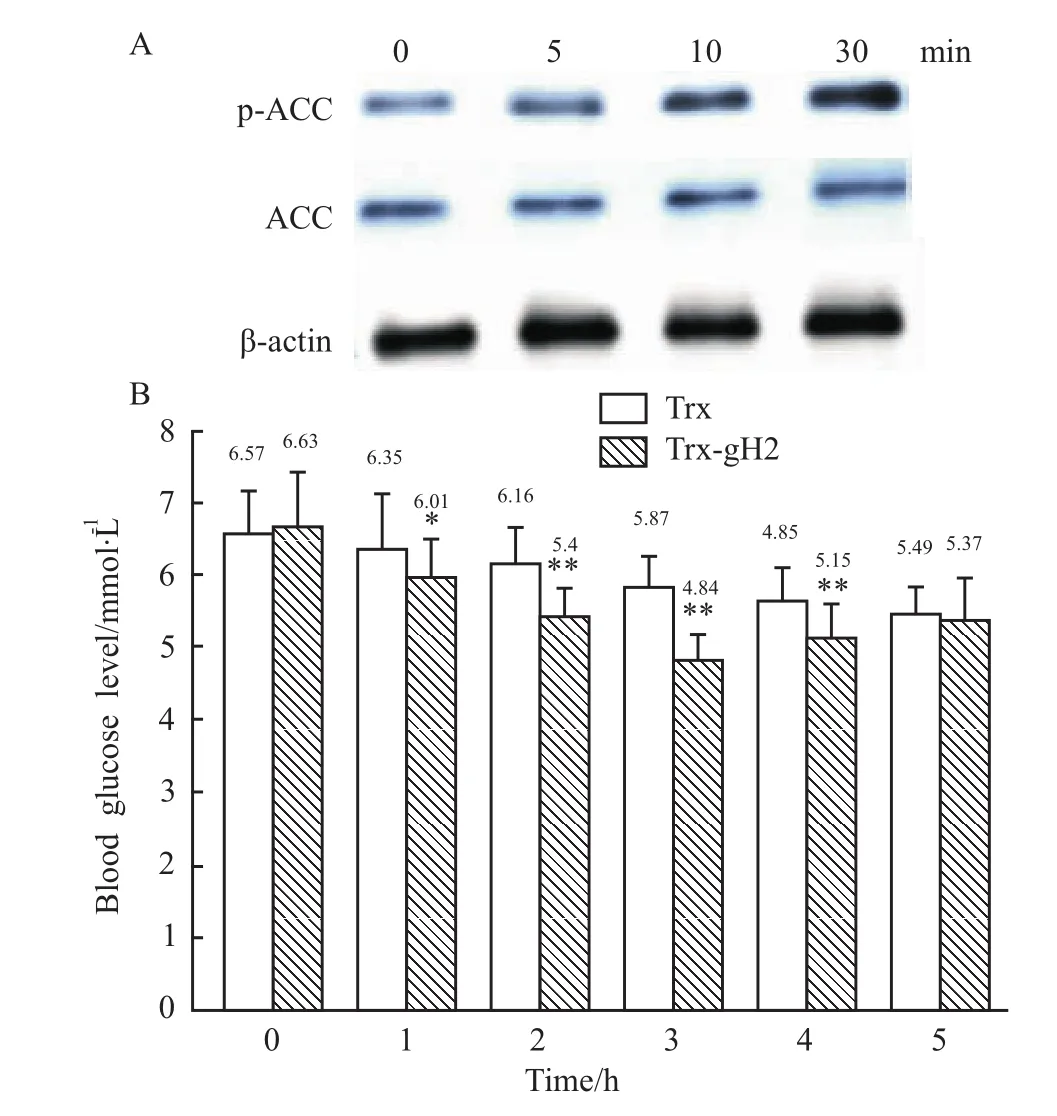
Fig 3 Biological activity assays of purified fusion recombinant protein Trx-gH2
利用酵母表达系统和大肠杆菌表达系统对hCTRP2的全长蛋白进行了表达,在酵母表达系统中,重组蛋白被酵母自身分泌的Yapsin蛋白酶降解,因而分泌的hCTRP2蛋白被立即切割成分子量大小不同的片段[4-5,9];pET32为表达载体,实现了全长hCTRP2在大肠杆菌中的可溶性融合表达,其表达产物具有生物活性。hCTRP2的球状区是其功能区,目前在对CTRPs蛋白的功能和作用机制研究时主要利用其球状功能区蛋白。Lee等[10]将hCTRP6与GST融合,也实现了hCTRP6球状区的可溶表达,但其表达量很低[10]。虽然GST标签也可增加一些重组蛋白的可溶性表达,但对于CTRPs蛋白,GST标签不能有效地增加CTRPs蛋白的可溶性表达。本研究最后以N端融合有Trx-tag的pET-32a(+)为表达载体,实现hCTRP2球状区蛋白的高效可溶表达。与酵母表达系统相比,大肠杆菌表达的Trx-gH2没有出现产物降解现象,说明CTRP2在大肠杆菌表达系统中的稳定性要比酵母高。
在细胞刺激实验时,Trx-gH2和酵母表达的hCTRP2一样,有激活ACC磷酸化的作用,在重组蛋白刺激细胞5 min后都能检测到磷酸化水平的增加[5];在检测动物水平的降血糖活性时,酵母表达的全长hCTRP2在注射小鼠1 h时的降血糖活性并不明显[5],而注射Trx-gH2蛋白在注射1 h后呈现出降血糖活性,说明Trx-gH2蛋白在动物水平上的活性出现得似乎更快一些;注射酵母表达的hCTRP2的降血糖活性可以维持至少7 h[5],而注射Trx-gH2 5 h后,其降血糖活性消失。由于Trx-gH2蛋白融合了Trx片段,虽然注射的蛋白质量相同,但与酵母表达的hCTRP2相比,Trx-gH2蛋白质分子要少,因此出现Trx-gH2降血糖持续活性不如酵母表达的全长hCTRP2。总之,本研究为hCTRP2或相似蛋白的可溶、稳定和活性表达找到了一种高效的蛋白表达系统和纯化方法。
参考文献:
[1]Wong GW,Wang J,Hug C,etal.A family of Acrp30/adiponectin structural and functional paralogs[J].Proc Natl Acad Sci USA,2004,101(28):10302-7.
[2]Wei Z,Peterson JM,Wong GW.Metabolic regulation by C1q/TNF-related protein-13(CTRP13):Activation of AMP-activated protein kinase and suppression of fatty acid-induced JNK signaling[J].JBiol Chem,2011,86(18):652-65.
[3]Kishore U,Gaboriaud C,Waters P,etal.C1q and tumor necrosis factor superfamily:Modularity and versatility[J].Trends Immunol,2004,25(10):551-61.
[4]Li H,Gao X,Zhou Y,et al.High level expression,purification and characterization of active fusion human C1q and tumor necrosis factor related protein 2(hCTRP2)in Escherichia coli[J].Protein Expr Purif,2011,79(1):1-6.
[5]李洪波,吴东海.重组毕赤酵母高密度发酵表达活性hCTRP2的研究 [J].中国药理学通报,2013,29(12):1738-42.
[5]Li H B,Wu D H.Large-scale production of active recombinant human C1q/TNFαrelated protein-2 in Pichia pastoris[J].Chin Pharmacol Bull,2013,29(12):1738-42.
[6]Frederick FM,Brent R,Kingston R E,et al.Short Protocols in Molecular Biology,5thEdition Books[M].New York:John Wiley and Sons,Inc.,Publishers,2000:343-502.
[7]Li H,Wang Y,Xu A,et al.Large-scale production,puricationand bioactivityassay of recombinant human interleukin-6 in themethylotrophic yeast Pichia pastoris[J].FEMSYeast Res,2011,11(2)160-7.
[8]李洪波,胡 兴,伍贤进,等.高度特异性人补体C1q/TNF相关蛋白-2抗体的制备及验证 [J].中国药理学通报,2013,29(10):1477-8.
[8]Li H B,Hu X,Wu X J,et al.High specific antibody preparation and analysis of human C1q/TNF related protein-2[J].Chin Pharmacol Bull,2013,29(10):1477-8.
[9]Bourbonnais Y,Larouche C,Tremblay G M.Production of fulllength human pre-elafin,an elastase specific inhibitor,from yeast requires the absence of functional yapsin 1(yps1p)endoprotease[J].Protein Expr Purif,2000,20(3)485-91.
[10]LeeW,Kim M J,Park E J,etal.C1q TNF-related protein-6 mediates fatty acid oxidation via the activation of the AMP-activated protein kinase[J].FEBS Lett,2010,584(5)968-72.