泼尼松对Ⅱ型胶原诱导性关节炎大鼠股骨微结构及生物力学的影响
吴青云,熊雪婷,许碧莲,,陈文双,崔 燎,,吴 铁,张新乐
(广东医学院1.药理学教研室、2.广东天然药物研究与开发重点实验室,广东湛江 524023)
类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎症为特征的慢性全身性自身免疫性疾病,通常可导致不可逆的关节破坏、畸形,甚至残疾、死亡。其在疾病发展和治疗过程中容易并发骨质疏松[1]。骨关节的破坏和骨质疏松是其致残的主要原因[2]。有研究显示,在第1年,68%的RA患者骨质丢失(>-0.003 g·cm-2)加速,四肢骨密度的丢失与进展性关节损害相关[1]。RA及其并发症给社会和家庭带来了严重的经济负担。目前虽然有许多药物治疗RA,如免疫抑制剂、非甾体类抗炎药、改变病情的抗风湿性药物等,糖皮质激素类药物(Glucocorticoids,GCs)因其强大的抗炎及免疫抑制作用,依然是临床上治疗RA的一个无可替代的药物。近年来临床研究显示,GCs能有效地控制RA症状及降低炎性指标,具有改善病情、抑制骨关节破坏的作用[3-4]。但也有文献报道,长期应用 GCs治疗RA会加重骨质丢失,导致骨质疏松的发生率增加[2]。
因此,本实验采用Ⅱ型胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠模型,利用骨生物力学和micro-CT等技术,观察泼尼松(prednisone,PDN)给药3个月后对股骨远端松质骨微观结构及骨生物力学性能的影响,为GCs治疗RA的临床应用提供实验依据。
1 材料与方法
1.1 实验动物40只♂6周龄Lewis大鼠,由北京维通利华公司提供,体质量(135±16)g。
1.2 药品及仪器醋酸泼尼松片购自广东华南药业集团有限公司(批号:120901),牛源性Ⅱ型胶原蛋白购自四川大学,弗氏不完全佐剂(IFA)购自美国Sigma公司。viva micro-CT 40(SCANCO Medical AG,瑞士)、858 Mini Bionix型材料测试机及测试系统(MTS,美国)。
1.3 CIA模型的建立及动物分组6周龄Lewis♂大鼠40只,适用性饲养2周后,随机分出6只为正常对照(control,CON)组,其余34只用来造模。此模型制备是将牛源性Ⅱ型胶原蛋白(collagenⅡ,CⅡ)溶解于0.05 mol·L-1的醋酸溶液中,4℃过夜,再与等体积的弗氏不完全佐剂混合,充分乳化(操作在冰上进行),将乳化后的液体滴在水中后不扩散且成形视为乳化完全,制得1.5 g·L-1Ⅱ型胶原乳剂。剃除大鼠背部周围毛,取配置好的乳剂,自鼠尾根部开始,在脊柱两旁皮内多点注射。每只鼠注射乳剂0.4 ml,1周后以相同方法、剂量加强免疫1次[5]。正常对照组按相同方法注射0.05 mol·L-1醋酸0.4 ml。免疫3周后筛选出发生关节炎(关节评分≥4)的大鼠,进行随机分成CIA组(n=7)、CIA加泼尼松 4.5 mg·kg-1·d-1[CIA+PDN(4.5 mg·kg-1·d-1)]组(n=6)、CIA加泼尼松 9 mg·kg-1·d-1[CIA+PDN(9 mg·kg-1·d-1)]组(n=7)。每组大鼠按5 ml·kg-1·d-1灌胃给药,连续给药90 d。每周称体重1次,并按体重变化调整给药量。实验结束时,大鼠麻醉后心脏抽血处死,迅速取出左股骨用生理盐水纱布、锡纸包裹,-20℃保存。
1.4 骨生物力学参数的测定检测时,将-20℃保存的左股骨常温解冻,生理盐水复湿,剔除股骨上面残存的肌肉,将股骨置于流变仪上分别进行三点弯曲试验,加载速度为 0.01 mm·s-1,跨距为 15 mm[6]。记录载荷-变形曲线,从曲线上直接获取或依公式计算出相应的力学指标:弹性载荷、最大载荷、断裂载荷、刚度参数。
1.5 M icro-CT测量将处理好的左股骨远心端(已截断)标本沿长轴垂直固定于样品固定器内。vivaCT 40选择扫描参数:图像矩阵为2 048×2 048,整合时间(integration time)为200 ms,能量/强度为70 kVp、114μA、8 W。以00旋转,进行扫描。扫描完成后,选取距生长板远端1.0 mm、层厚3.0 mm的骨组织为松质骨感兴趣区域(ROI)行三维重组,以最低阈值为190提取图像信息。获得重组图像后,使用micro-CT自带的软件进行定量分析。物理参数分析如下:骨密度(bone mineral density,BMD)、骨体积分数(bone volume/total volume,BV/TV)、结构模型指数(structuremodel index,SMI)、骨小梁数量(trabecular number,Tb.N)、骨小梁分离度(trabecular separation,Tb.Sp)、骨小梁厚度(trabecular thickness,Tb.Th)。
1.6 统计学分析所有数据均以±s形式表示,采用SPSS 17.0软件对数据进行方差分析及组间比较。
2 结果
2.1 各组大鼠股骨生物力学参数的变化与CON组比较,CIA组大鼠股骨弹性载荷、最大载荷、断裂载荷、刚度均明显减小(P<0.01)。与CIA组比较,泼尼松2个剂量组骨生物力学参数均无统计学意义(P>0.05)。见Tab 1。
2.2 各组大鼠股骨远端松质骨M icro-CT定量参数的变化与CON组比较,CIA组股骨BMD、Tb.Th、Tb.N、BV/TV均明显减小(P<0.05,P<0.01),而 SMI、Tb.Sp明显增加(P<0.01),骨小粱形态结构从板状向杆状化转变。与CIA组比较,泼尼松2个剂量组 Tb.Sp均减小(P<0.05,P<0.01),而Tb.N、BV/TV均增加(P<0.05,P<0.01),但 SMI、BMD、Tb.Th均无明显变化(P>0.05)。泼尼松2个剂量组之间各参数均无统计学意义(P>0.05)。见Tab 2。
2.3 各组大鼠股骨远端松质骨M icro-CT的3D图
Micro-CT的三维可视化成像结果形象地展示了各组大鼠股骨远心端松质骨的形态变化情况。
CON组骨小梁走向一致,粗细均匀,形状规则,排列密集;CIA组骨小梁稀疏、排列不均、网状结构消失、呈现出明显的骨微结构破坏,不能保持完整的微观构筑。泼尼松2个剂量组的骨微结构破坏较CIA组有所减轻,表现为骨小梁增多,间隙变小,出现较多完整的骨小梁连接结构。泼尼松2个剂量组之间变化无差别。见Fig 1。
Tab 1 Changes of biomechanical properties of femur in rats in different groups(±s)

Tab 1 Changes of biomechanical properties of femur in rats in different groups(±s)
**P<0.01 vs CON
Group n Elastic load/N Maximum load/N Break load/N Stiffness/N·mm-1 CON 6 105.7±19.0 145.7±15.0 142.8±15.3 456.6±60.2 CIA 7 55.6±12.9** 85.1±10.6** 77.7±17.0** 259.2±45.1**CIA+PDN(4.5 mg·kg-1·d-1) 6 65.3±13.5 94.8±14.5 90.5±16.9 305.3±43.7 CIA+PDN(9 mg·kg-1·d-1)7 66.8±9.3 91.6±5.4 82.11±16.01 286.6±35.2
Tab 2 Changes ofm icrostructural parameters of distal femur in rats in different groups(±s)

Tab 2 Changes ofm icrostructural parameters of distal femur in rats in different groups(±s)
*P<0.05,**P<0.01 vs CON;ΔP<0.05,ΔΔP<0.01 vs CIA
Group n SMI Tb.N/mm-1 Tb.Th/mm Tb.Sp/mm BV/TV/% BMD/mg·cm-2 CON 6 1.94±0.11 2.57±0.31 0.08±0.00 0.41±0.05 0.16±0.02 652.44±14.50 CIA 7 2.99±0.31** 0.61±0.17** 0.06±0.01** 1.77±0.41** 0.01±0.01**624.17±16.96*CIA+PDN(4.5mg·kg-1·d-1) 6 2.79±0.26 1.04±0.29Δ 0.07±0.01 1.05±0.28Δ 0.04±0.02Δ 642.16±15.26 CIA+PDN(9mg·kg-1·d-1) 7 2.77±0.24 1.17+0.31ΔΔ 0.06±0.01 0.92±0.20ΔΔ 0.04±0.01ΔΔ630.21±22.73

Fig 1 Segmented(SEG)image ofm icro-CT of distal femur in rats in different groups
与CON组比较,CIA组红色部分明显增多,橙色、黄色也多,提示CIA组分离度增大,骨小梁之间的距离明显变大。与CIA组比较,泼尼松2个剂量组绿色增多,红色、橙色、黄色减少,提示泼尼松2个剂量组骨小梁分离度变小,骨小梁之间的距离变小。泼尼松2个剂量组之间变化无显著性差别。见Fig 2。
与CON组比较,CIA组红色部分明显减少,说明骨小梁变薄。与CIA组比较,泼尼松2个剂量组红色部分都没有明显增多,说明厚度增加不明显。泼尼松2个剂量组之间变化无显著性差别。见Fig 3。
3 讨论
骨生物力学主要是研究骨组织在外界作用下的力学性能和骨在受力后的所产生的生物学效应,是评价药物对骨质量的指标[6-7],骨量的减少以及骨质内部结构的改变均能影响骨生物力学,可降低生物力学强度。另外,micro-CT通过X线扫描和三维重建,极大地解决了骨组织形态计量学测量方面存在切片方向的不固定性和二维平面的局限性的问题,成为研究分析骨微观结构的新兴技术,是理想的研究骨形态学的工具[5-6]。本实验所用到的vivaCT 40能够在不破坏样品的前提下,对骨骼进行高分辨率X线成像,显示骨骼内部详尽的三维信息,各项参数通过自带的软件便可获得的优点,且获得了二维测量所无法获得的三维参数,并可对分割不同的骨密度的部位进行定量分析,避免因取材部位不一致造成误差。
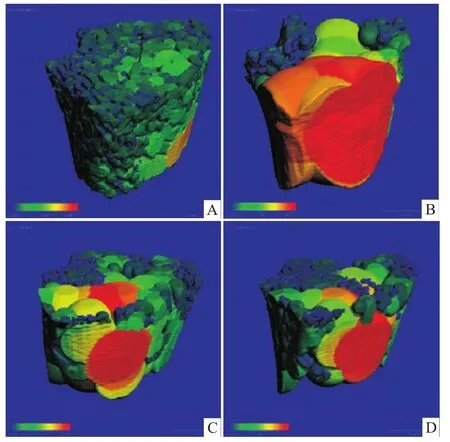
Fig 2 Trabecular separation image ofm icro-CT of distal femur in rats in different groups
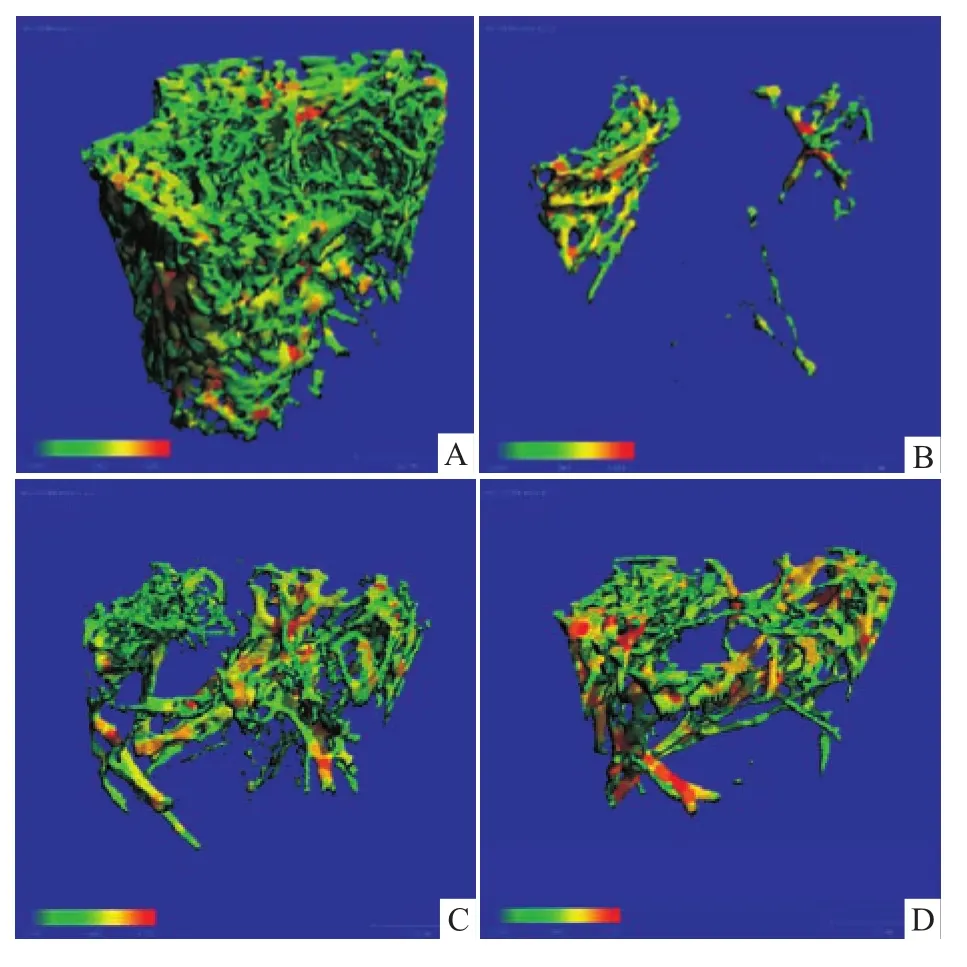
Fig 3 Trabecular thickness image ofm icro-CT of distal femur in rats in different groups
由Tab 1可知,与正常对照组比较,CIA大鼠弹性载荷、最大载荷、断裂载荷、刚度均明显减小。最大载荷即强度,能反映整个骨综合的抗外力冲击能力,与骨的尺寸和几何形状有关。刚度又称外在硬度,反映抗变形的能力。CIA大鼠股骨的结构破坏、骨生物力学性能降低,易变形和断裂,骨折风险明显增加。另外,CIA大鼠股骨 BMD、Tb.Th、Tb.N、BV/TV明显减小,SMI、Tb.Sp明显增加。SMI是用于评价骨小梁的形态结构,定义骨小梁板状和杆状的程度,理想板状结构为0,理想杆状结构为3,发生骨质疏松时,骨小梁从板状向杆状转变,SMI数值增加。CIA组的SMI比CON组明显增加,接近3,表明建模后骨小粱形态结构杆状化[8-9]。SMI值增加可能是由于关节炎大鼠破骨细胞在骨表面的吸收功能增加,破骨细胞吸收功能大于成骨细胞骨形成功能,使得吸收范围逐渐扩大,进而发展到由板状结构逐渐转变为杆状结构。由板状结构转变为杆状结构,骨小梁之间的连接逐渐变细、断裂,最后被破坏,甚至消失,大鼠股骨松质骨网状结构的完整性遭到破坏,发生骨折的危险性增加,这与生物力学的参数结果一致,表明松质骨微结构的改变影响了骨承载能力,对生物力学性能产生影响,这与文献报道一致[8-9]。三维结构重建后的大鼠股骨远心端股骨分割图可直接观察骨小梁的结构形态。骨小梁分离度图可直接反映骨小梁的距离情况,从绿到红,反映了骨小梁之间的距离越来越大,骨质疏松越来越严重。骨小梁厚度图除了可见骨小梁的结构和几何信息外,还可直接反映骨小梁的厚度分布情况,从绿到红,反映了骨从薄到厚,给出骨骼的结构参数及力学参数的定量数值,观察骨微结构变化。从micro-CT的3D图可见,CIA组大鼠骨小梁变稀疏、数目减少、变细、断裂、间距变宽、形态不规则、网状结构消失、排列不均,呈现出明显的骨微结构破坏,不能保持完整的微观构筑,表明大鼠股骨骨微结构发生了骨质疏松样改变。
由Tab 2可见,与CIA组比较,泼尼松2个剂量组Tb.N均增加,Tb.Sp均降低。由micro-CT的3D图也可见,泼尼松2个剂量组大鼠股骨骨小梁增多,间隙变小,小梁连接结构增多,骨微结构破坏减轻。提示泼尼松灌胃治疗3个月后,CIA大鼠股骨的松质骨微结构破坏有所改善。GCs可下调多种炎性细胞因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)等,抑制白细胞的迁移,调节内皮细胞和成纤维细胞功能。另外通过抑制致炎因子TNF-α、IL-6、IL-17等,调节核因子-κB受体活化因子配体(receptor activator of nuclear factor-κb ligand,RANKL)的表达,而抑制破骨细胞的活性[10-11]。
与CIA组比较,泼尼松2个剂量组大鼠股骨松质骨SMI、骨小梁厚度、骨密度及生物力学参数均无明显变化。提示经泼尼松治疗3个月后,CIA大鼠骨小粱形态结构仍是杆状化,其松质骨的板状结构没有恢复,未能明显修复骨小梁穿孔的结构。由于结构和骨小梁厚度无明显改善,从而使股骨的生物力学性能及骨密度都没有明显改善。GCs可直接抑制成骨细胞的产生,加速成骨细胞的凋亡,同时可抑制胰岛素样生长因子在成骨细胞的表达,降低骨的转换率[12]。因此,GCs虽然可以抑制炎症因子,对CIA大鼠股骨的松质骨微结构破坏有所改善,但是GCs抑制骨形成作用,导致松质骨的板状结构、生物力学性能和骨密度都无法恢复。
由结果可见,泼尼松 4.5、9 mg·kg-1·d-1对CIA大鼠股骨松质骨微结构及生物力学的作用无统计学意义,结果提示,通过增加泼尼松的剂量,并不能获得更好的效果。进一步提示,单用GCs治疗RA,即使增加GCs的剂量,也不能阻止骨质疏松的发生,因此,必须联合用药。如何通过联合用药防治RA诱发的骨质疏松,还有待于进一步的研究。
参考文献:
[1]Güler-Yüksel M,Klarenbeek N B,Goekoop-Ruiterman Y P.Accelerated hand bonemineral density loss is associated with progressive joint damage in hands and feet in recent-onset rheumatoid arthritis[J].Arthritis Res Ther,2010,12(3):1-11.
[2]van Everdingen A A,Siewertsz VanReesema D R,Jacobs JW,et al.Low-dose glucocorticoids in early rheumatoid arthritis:discordant effects on bone mineral density and fractures[J].Clin Exp Rheumatoll,2003,21(2):155-60.
[3]Engvall IL,Svensson B,Boonen A,etal.Low-dose prednisolone in early rheumatoid arthritis inhibits collagen type Idegradation by matrix metalloproteinases as assessed by serum 1CTP-a possible mechanism for specific inhibition of radiological destruction[J].Rheumatology(Oxford),2013,52(4):733-42.
[4]Buttgereit F,Mehta D,Kirwan J,et al.Low-dose prednisone chronotherapy for rheumatoid arthritis:a randomised clinical trial(CAPRA-2)[J].Ann Rheum Dis,2013,72(2):204-10.
[5]Cuzzocrea S,Mazzon E,Paola R D,et al.Effects of combination M40403 and dexamethasone therapy on joint disease in a ratmodel of collagen-induced arthritis[J].Arthritis Rheum,2005,52(6):1929-40.
[6]许碧莲,崔 燎,陈文双,等.丹参骨宝对维甲酸模型大鼠股骨生物力学及骨密度的影响[J].生物医学工程学杂志,2010,27(2):307-10.
[6]Xu B L,Cui L,Chen W S,et al.Effectsof Danshengubao on biomechanical properties and bonemineral density of femur induced by retinoic acid in rats[J].JBiomed Eng,2010,27(2):307-10.
[7]许碧莲,崔 燎,陈文双,等.维甲酸致大鼠骨质疏松模型探讨及丹参骨宝的预防作用[J].中国药理学通报,2010,26(4):539-43.
[7]Xu B L,Cui L,Chen W S,et al.Effects of retinoic acid on induction osteroporosismodel rats and preventive effects of Danshengubao[J].Chin Pharmacol Bull,2010,26(4):539-43.
[8]胡泽兵,周 涛,王 冰,等.间断性水平位站立对尾吊大鼠胫骨骨小梁结构影响的micro-CT评价[J].中国骨质疏松杂志,2013,19(5):431-4.
[8]Hu Z B,Zhou T,Wang B,etal.Evaluation of the effectof intermittent standing exposure on the tibia trabecular structure in tailsuspended ratsusingmicro-CT[J].Chin JOsteop,2013,19(5):431-4.
[9]Zhang R,Hu S J,L C,et al.Chyranthes bidentata root extract prevent OVX-induced osteoporosis in rats[J].JEthnopharmacol,2012,139(1):12-8.
[10]Earp JC,Dubois D C,Molano D S,etal.Modeling corticosteroid effects in a ratmodel of rheumatoid arthritis II:mechanistic pharmacodynamic model for dexamethasone effects in Lewis rats with collagen-induced arthritis[J].JPharmacol Exp Ther,2008,326(2):546-54.
[11]Earp JC,Dubois D C,Molano D S,etal.Modeling corticosteroid effects in a ratmodel of rheumatoid arthritis I:mechanistic disease progression model for the time course of collagen-induced arthritis in Lewis rats[J].JPharmacol Exp Ther,2008,326(2):532-45.
[12]许碧莲,徐道华,陈文双,等.小檗碱对糖皮质激素性骨质疏松大鼠松质骨和皮质骨的影响[J].中国药理学通报,2011,27(7):965-70.
[12]Xu B L,Xu D H,Chen W S,et al.Effects of Berberine on cancellous and cortical bone in rats induced by glucocorticoid[J].Chin Pharmacol Bull,2011,27(7):965-70.