巨细胞病毒启动子序列检测的复合实时定量PCR方法的建立
苗玉发,王三龙,周晓冰,霍 艳,耿兴超,吕建军,汪巨峰,李 波
(中国食品药品检定研究院国家药物安全评价监测中心,北京 100176)
巨细胞病毒(cytomegalovirus,CMV)启动子是启动真核基因表达的强力启动子,常参与构建高效真核表达载体,并广泛应用于基因治疗产品和DNA疫苗的制备。本研究所涉及的基因治疗产品是插入CMV启动子和人粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)基因的单纯疱疹病毒载体疫苗,CMV启动子能启动疫苗高效表达GM-CSF,导致局部树突状细胞(dendritic cells,DC)分裂和成熟,从而诱导和增强抗肿瘤免疫反应。本研究的目的是探索建立CMV启动子序列检测的复合实时定量PCR方法,并期望使建立的方法成为含CMV启动子的基因治疗产品的通用检测方法。
1 材料与方法
1.1 生物材料
基因治疗产品,2 ×1011pfu·L-1,由某生物科技公司提供。50 mg·L-1CMV启动子标准品上海生工技术有限公司。β肌动蛋白基因标准品,1×1014拷贝(copies)·L-1,由上海基康生物技术公司提供。
1.2 试剂及仪器
小鼠基因组DNA提取试剂盒,购自中国北京Tiangen Biotech公司;病毒DNA提取试剂盒购自中国上海捷瑞生物工程公司;实时定量PCR反应试剂购自日本TaKaRa公司;SYBR GreenⅠ染料购自中国厦门百维信生物公司;ABI PRISM 7000型实时荧光定量PCR仪购自美国ABI公司;超声波组织匀浆器购自德国IEKA公司;5810R型台式高速离心机购自德国艾本德公司。
1.3 动物
BALB/c小鼠,SPF级,体质量20~25 g,合格证号:SCXK(京)2009-0017,由北京维通利华实验动物技术有限公司提供。
1.4 小鼠基因组DNA和基因治疗产品病毒DNA的提取
小鼠放血处死后,取新鲜心脏或肝组织,称取约25 mg,去除结缔组织,用剪刀剪成细小碎块,加入DNA提取缓冲液,然后按照小鼠基因组DNA提取试剂盒说明书操作。取约200 μL基因治疗产品溶液,以12 500×g离心1.5 h,取出下层溶液及沉淀,加入到1.5 mL离心管中,加入20 μL蛋白酶K,消化1~2 h或过夜,然后按照病毒DNA提取试剂盒说明书操作。
1.5 单独PCR反应体系建立及验证
1.5.1 CMV启动子引物和探针的设计、合成及标准品的构建
针对CMV启动子序列用ABI Primer Express v2.0软件设计的上游引物为 5'AGACTTGGAAATCCCCGTGAGT3',下 游 引 物 为 5'CGTATTAGTCATCGCTATTACCATGGT3',探 针 为5'AACCGC TATCCACGCCCATTGATG3'。探针5'端报告基团用FAM标记,3'端淬灭基团用TAMRA标记。扩增产物长度为93 bp。将含有上述CMV启动子引物和探针序列的长度为107 bp的基因片段克隆到pUC57质粒中,克隆位点在SamⅠ酶切位点,通过紫外法对质粒进行准确定量。对构建好的质粒进行测序,证实插入的目的片段序列正确。引物、探针和质粒标准品由上海生工技术服务有限公司合成。
1.5.2 反应体系的优化
反应条件:94℃ 3 min;94℃ 30 s,60℃ 1 min,40个循环。
以CMV启动子标准品为扩增对象,对反应体系进行优化。上下游引物浓度分为40,200和800 nmol·L-1,共9种不同组合;探针浓度设置:50,100,200 和400 nmol·L-1;Ex Taq HS 聚合酶浓度设置:12 500,25 000,50 000 和100 000 U·L-1;Mg2+浓度设置:2,3,4和5 mmol·L-1。分别用上述各成分的不同浓度对等量的CMV启动子标准品进行扩增,选择Ct值最小,Delta Rn较大的浓度。扩增曲线为循环数对Delta Rn作图。
1.5.3 单独PCR反应的特异性、重复性、定量限和灵敏度
用SYBR GreenⅠ熔解曲线分析引物对基因治疗产品扩增的特异性。用不同浓度的CMV启动子标准品,在同一个反应中重复测定8次,计算各个复孔Ct值的变异系数(CV),以及由此外推出拷贝数的CV值。对1∶10倍比稀释的CMV启动子标准品进行扩增,找出标准曲线线性范围内的最小值即定量限。将×102的CMV启动子标准品以1∶2倍比稀释一系列浓度,找出能检测到的最小值即灵敏度。
1.6 复合PCR反应建立
1.6.1 β肌动蛋白基因引物和探针的设计、合成及标准品的构建
从NCBI基因库中以Blast方式查获β肌动蛋白基因的cDNA序列(GeneID:218370),以此为模板用Primer Express v2.0进行引物及探针的设计。上游引物为 5'CCTGAGGCTCTTTTCCAGCC3',下游引物为 5'TAGAGGTCTTTACGGATGTCAACGT3',探 针 为 5'TCCTTCTTGGGTATGGAATCCTGTGGC3'。探针5'端报告基团用VIC标记,3'端淬灭基团用TAMRA标记。扩增产物长度为109 bp。将含有上述引物和探针序列的基因片段插入质粒中,构建β肌动蛋白基因标准品。引物、探针和β肌动蛋白基因标准品由上海基康生物技术公司合成。用SYBR GreenⅠ熔解曲线分析引物对小鼠基因组扩增的特异性。
1.6.2 复合PCR扩增效率的比较
基因治疗产品和β肌动蛋白基因标准品分别以1∶10倍比稀释后,按优化好的反应条件,进行基因治疗产品单独的标准曲线扩增反应(monoplex)、β肌动蛋白基因标准品monoplex以及基因治疗产品和β肌动蛋白基因标准品混合在一起的复合反应(multiplex)。通过公式 E(efficiency)=10[-1/(-slope)]计算扩增效率。通过对复合扩增效率和单独扩增效率的比较,判断两套引物和探针组合在同一管中进行反应时,是否存在相互影响因素。
1.7 统计学分析
用SPSS 11.5和华西大学统计学教研室开发的PEMS v3.1软件对数据进行直线回归分析、作图及相关性分析。
2 结果
2.1 引物特异性
两对引物分别对基因治疗产品(图1A)和小鼠基因组(图1B)扩增后,在80~85℃间有一特异性的产物峰,没有出现双峰或异常增宽峰。基因治疗产品扩增反应中的无模板对照(图1A)有一引物二聚体峰,两对引物特异性都较高。
2.2 优化的反应体系
当两引物浓度均≥200 nmol·L-1,得到最大的Delta Rn值和最小的Ct值(图2A group a),检测的灵敏度最高。探针浓度大于100 nmol·L-1时(图2B group a,b),得到了较大的Delta Rn值和最小的Ct值。所有的酶浓度出现相同的Ct值和相当的荧光值(图 2C)。Mg2+浓度在 2 ~5 mmol·L-1间变化时,对PCR扩增几乎没有影响(图2D)。
优化后的PCR反应体系为:总体积25 μL,上下游引物 260 nmol·L-1,探针 100 nmol·L-1,5 ×PCR 缓 冲 液 5 μL,dNTP 200 μmol·L-1,Mg2+3 mmol·L-1,Ex Taq HS 聚 合 酶 1.5 U,模 板1.5 μL,灭菌水 16 μL。
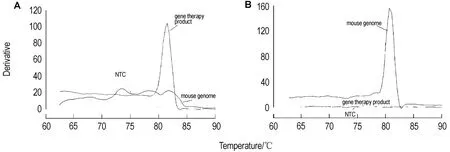
Fig.1 Dissociation curve of gene therapy product(A)and mouse genome(B).NTC:no template control.
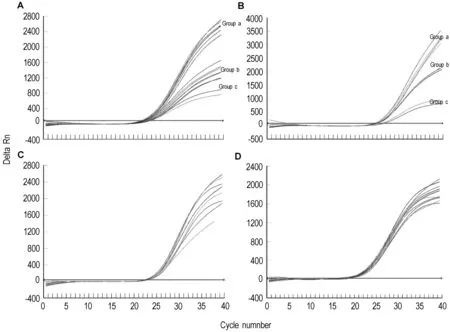
Fig.2 Amplification curve for optimization of reaction system.A:different primer concentration;B:different probe concentration;C:different polymerase concentration;D:different Mg2+concentration.Groups a,b and c are distinguished by different value of Delta Rn.
2.3 单独PCR反应的重复性
表1结果显示,Ct值的变异系数都小于2%,拷贝数的变异系数在20%左右,显示PCR具有较好的重复性,即此PCR反应体系精确性较好。
2.4 单独PCR反应的定量限和灵敏度
图3结果显示,CMV启动子标准品拷贝数在1.5 ×102~1.5 ×107范围內,标准曲线呈线性,即定量的线性范围达到6个数量级,定量限为1.5×102拷贝,反应体系的灵敏度为30拷贝。

Tab.1 Reproducibility of PCR reaction

Fig.3 Limit of quantification of reaction system.A:amplification curve;B:standard curve.a,b,c,d,e,f,g and h are a series of ×107,×106,×105,×104,×103and ×102CMV promoter standard material,normal mouse tissue negative control and no templet control,respectively.
2.5 CMV启动子标准品和基因治疗产品扩增效率
图4结果显示,两者标准曲线的相关系数R2都大于0.99。基因治疗产品的扩增效率为2.0076,CMV启动子质粒标准品的扩增效率为2.0138,两者的扩增效率都较高,且相近,构建的标准品可以对基因治疗产品准确定量。
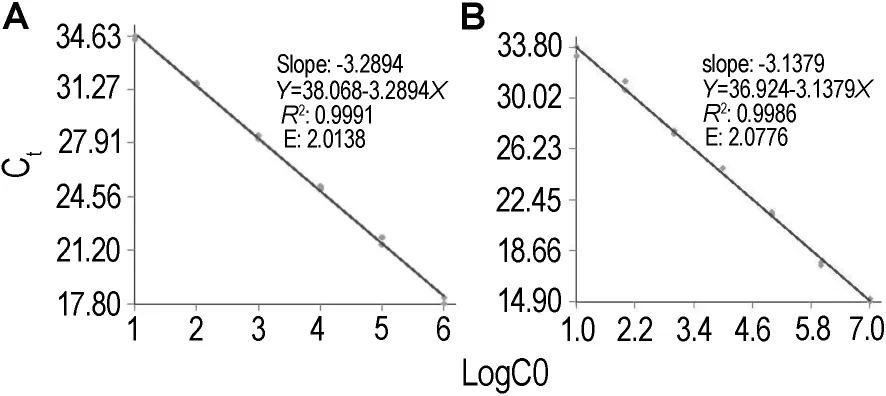
Fig.4 Comparison between amplification efficiency of standard material(A)and gene therapy product(B).
2.6 基因治疗产品和β肌动蛋白基因标准品扩增效率
图5结果显示,不管是基因治疗产品还是β肌动蛋白基因标准品在单独反应时,扩增效率都较高,复合反应时扩增效率都稍有降低,β肌动蛋白基因标准品扩增效率从2.9417减至2.7532,基因治疗产品扩增效率从2.1408减至2.1154。
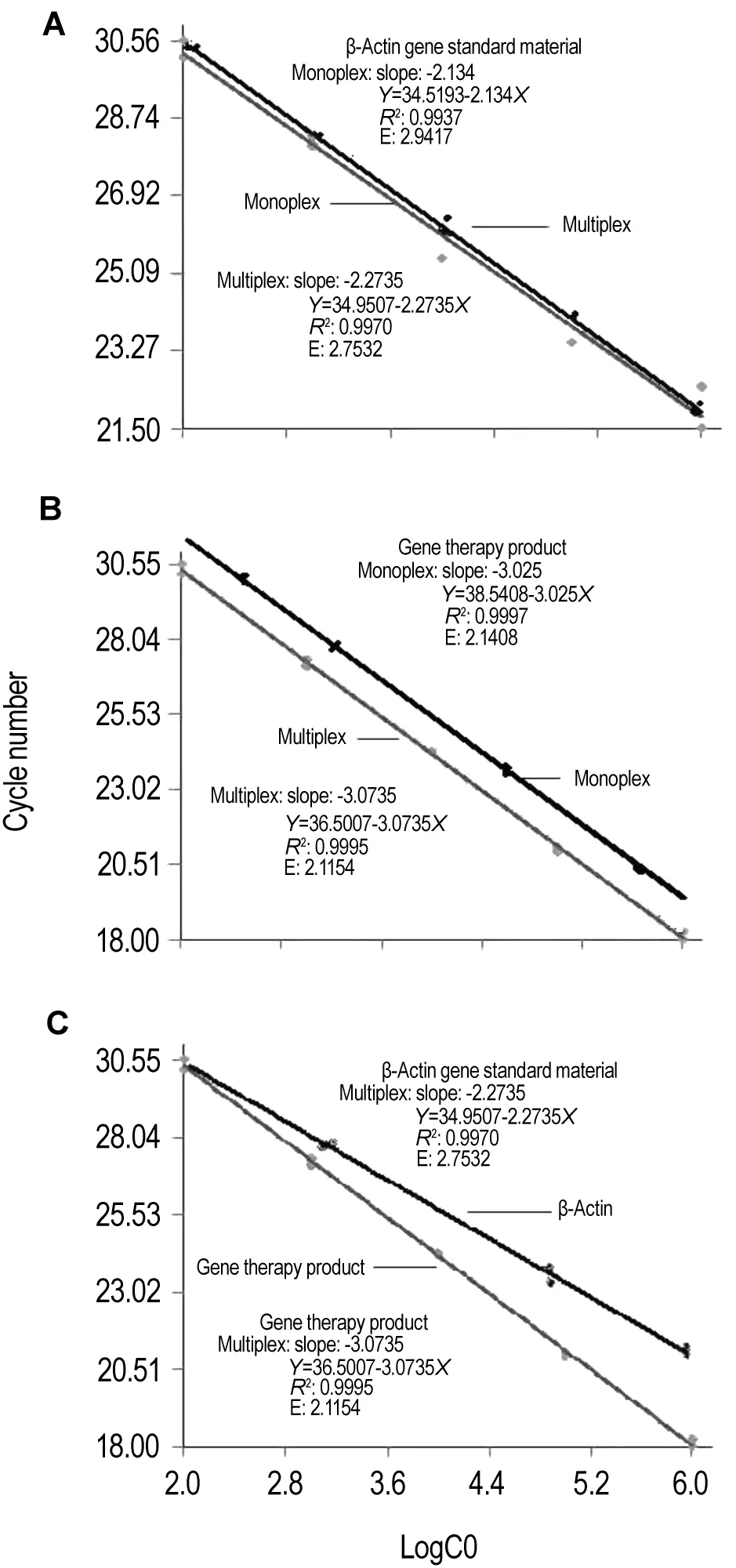
Fig.5 Amplification efficiency of gene therapy product and β-actin gene standard material.A:standard curve of β-actin gene monoplex and multiplex reaction;B:standard curve of gene therapy product monoplex and multiplex reaction;C:standard curve of β-actin gene and gene therapy product multiplex reaction.
3 讨论
应用定量PCR进行生物技术药物的生物分布研究时,在描述结果时常常有不同的表示方法,如拷贝/μL,拷贝/mg 组织等[1-5]。由于 DNA 抽提效率不同,这些表示方法都不能准确地表示定量。即便采用国际上常用的拷贝/ng基因组来表示,也有一定的不足。应用此单位的前提是所检测的目的基因在整个基因组中所占的比例要足够的少,即要保证所检测基因的吸光度与基因组的吸光度相比可以忽略。当目的基因含量越多时,这种表示方法就越不准确。为了减少这些常用单位的误差,需要对反应体系中的基因组进行单独定量。β肌动蛋白基因是小鼠基因组中的一种管家基因,一个基因组含有两个拷贝的β肌动蛋白基因,它能在不同组织中相对恒定地表达[6-7]。利用β肌动蛋白基因作为内参,定量了 β肌动蛋白基因的拷贝数,就可以定量基因组的拷贝数,从而可以把结果以拷贝/基因组或拷贝/细胞来表示,使结果的表达更为科学和准确。
在进行β肌动蛋白内参基因扩增反应时,待测基因和内参基因是在同一个反应体系中进行的。从理论上来讲,为了得到准确的多重定量结果,必须保证其中的一个扩增反应不能影响另一个扩增反应。否则,丰度较高的基因的扩增就会抑制丰度较低的基因的扩增,从而影响定量的准确性[8]。在本研究中,相比于单独反应,复合反应时两扩增效率都轻微降低,证实两个扩增反应都相互受到了轻微影响。但是,扩增效率下降都是轻微的,对定量的准确性影响不大。对β肌动蛋白内参基因扩增时发现,VIC荧光染料在扩增后的荧光值(Delta Rn)比较低,10倍系列稀释的标准品制作的标准曲线斜率也比较低(理想的斜率为3.322)。通过SYBR GreenⅠ法对其标准品进行验证,结果显示标准品良好,又通过对扩增过程中荧光信号值的变化(component)进行深入的分析发现,是由于探针的荧光染料标记不稳定所导致。尽管如此,还是对β肌动蛋白内参基因校正的复合反应体系进行了初步的摸索,基本上建立了β肌动蛋白内参基因校正的复合定量PCR方法。
[1] Jang IK,Suriakala K,Kim JS,Meng XH,Choi TJ.A TaqMan real-time PCR assay for quantifying typeⅢhepatopancreatic parvovirus infections in wild broodstocks and hatchery-reared postlarvae of Fenneropenaeus chinensis in Korea[J].J Microbiol Biotechnol,2011,21(11):1109-1115.
[2] Zhang L, Wu F, Shi LL,Dou XG.Quantitative analysis of HBV cccDNA form liver biopsy specimens HBV carriers:correlation with serological makers and sera HBV DNA[J].Chin J Exp Clin Virol(中华实验和临床病毒学杂志),2011,25(2):112-113.
[3] Roblin X,Pillet S,Oussalah A,Berthelot P,Del Tedesco E,Phelip JM,et al.Cytomegalovirus load in inflamed intestinal tissue is predictive of resistance to immunosuppressive therapy in ulcerative colitis[J].Am J Gastroenterol,2011,106(11):2001-2008.
[4] Ndongo N,Selliah S,Berthillon P,Raymond VA,Trépo C,Bilodeau M,et al.Expression of E1E2 on hepatitis C RNA-containing particles released from primary cultured human hepatocytes derived from infected cirrhotic livers[J].Intervirology,2011,54(1):1-9.
[5] Decaro N,Desario C,Beall MJ,Cavalli A,Campolo M,Dimarco AA,et al.Detection of canine parvovirus type 2c by a commercially available in-house rapid test[J].Vet J,2010,184(3):373-375.
[6] Marchal E,Hult EF,Huang J,Tobe SS.Sequencing and validation of housekeeping genes for quantitative real-time PCR during the gonadotrophic cycle of Diploptera punctata[J].BMC Res Notes,2013,6:237.
[7] Coltrini D,Di Salle E,Ronca R,Belleri M,Testini C,Presta M.Matrigel plug assay:evaluation of the angiogenic response by reverse transcriptionquantitative PCR[J].Angiogenesis,2013,16(2):469-477.
[8] Park JY,Jeon S,Kim JY,Park M,Kim S.Multiplex Real-time polymerase chain reaction assays for simultaneous detection of vibrio cholerae,Vibrio parahaemolyticus,and Vibrio vulnificus[J].Osong Public Health Res Perspect,2013,4(3):133-139.

