双酚A抑制大鼠胚胎中脑微团细胞的存活和分化与Notch-Hes通路有关
刘 然,蒋建军,尚兰琴,魏雪涛,吴 双,郝卫东
(1.北京大学医学部公共卫生学院毒理学系食品安全毒理学研究与评价北京市重点实验室,北京 100191;2.农业部农药检定所,北京 100125)
双酚A(bisphenol A,BPA)是一种典型的环境雌激素,用于生产碳酸聚酯、环氧树脂、聚苯乙烯树脂以及杀真菌剂、抗氧化剂、染料等。随着塑料制品的广泛应用,BPA造成了严重的环境污染,此外BPA还可从聚碳酸酯塑料产品(如婴儿奶瓶、食品包装和水瓶等)中迁移到食物和饮料中,通过人类日常使用的生活用品及饮用水进入人体内[1]。美国疾病预防控制中心研究估计约95%美国人的尿液中可以检测到BPA[2],此外,还可以在孕妇血清、羊水、胎盘组织和脐带血中检测到BPA,说明胚胎也可能在一定程度上暴露于BPA[3]。
许多研究表明,发育期胚胎对外源化学物的敏感性远远高于成年人[1]。尽管没有直接的证据证明BPA对人类发育有不良影响,但多项啮齿类动物的实验研究显示,孕期和(或)哺乳期暴露BPA可以降低子代动物的存活率、出生体重,抑制其早期生长[4]。本课题组之前的研究也表明 BPA≥20 μg·mL-1可抑制大鼠胚胎肢芽和中脑微团细胞的增殖和集落分化[5],但是其机制目前还不清楚。
雌激素对胚胎发育产生重要影响,在发育的关键时期暴露在外源性雌激素干扰物下,会影响正常的发育[6]。BPA可通过与雌激素受体(estrogen receptor,ER)结合或通过影响细胞信号转导途径等其他方式模拟或干扰内源性雌激素作用,发挥拟雌激素样效应[7]。研究表明,ER参与低剂量BPA对睾丸支持细胞的促增殖作用[8];BPA可上调细胞周期相关基因表达,抑制抗增殖基因的表达,从而促进MCF-7细胞的增殖,且此效应能被ER抑制剂逆转[9];BPA可以通过ER途径抑制小鼠卵子发生时印记基因的甲基化[10]。本研究旨在探讨ER途径在BPA对大鼠胚胎中脑微团细胞毒性中的作用。
1 材料与方法
1.1 实验动物
SPF级成年健康未育Sprague-Dawley大鼠,体质量200~220 g,由北京维通利华实验动物技术有限公司提供。于屏障环境中饲养(温度:20~26℃,相对湿度:40% ~70%),12 h明暗交替循环,自由进食饮水。于18:00雌、雄合笼交配,次日清晨进行阴道涂片检查,查到精子的动物定为妊娠第0天。
1.2 主要试剂
BPA(纯度 97%),雌激素受体抑制剂ICI182780,他莫西芬(tamoxifen,TAM)均购自美国Sigma公司;Ham'F12培养基和胎牛血清购自美国Hyclone公司;二甲基亚砜(DMSO),中性红和阿利新蓝购自美国Amresco公司;Trizol Up购自全式金公司;逆转录试剂盒和SYBR Premix ExTag购自日本TaKaRa公司;ERα和β肌动蛋白抗体购自美国 Santa Cruz公司,ERβ抗体购自 Abcam公司。
1.3 细胞制备
孕鼠于妊娠第13天经CO2麻醉后脱颈处死,消毒后剖腹,取出子宫分离出胚胎,将胚胎转移至37℃Hank's液中,于解剖显微镜下分离中脑。组织块用37℃PBS洗3次后,放入PBS中37℃孵育20 min,然后弃去PBS,加入0.25%胰蛋白酶,再于37℃孵育10 min。加入Ham's F12培养液(胎牛血清∶谷氨酰胺∶青/链霉素为88∶10∶1∶1)终止消化,再用培养液洗3次后,吸净。加入一定容量的培养液,用200 μL移液枪头反复吹吸黏稠的组织块,至组织块完全吹散。过200目细胞筛后,用台盼蓝记数细胞存活率在90%以上,调整细胞悬液浓度至5 ×109L-1。
1.4 中性红摄取法检测细胞存活
96孔板每孔加入5 μL制备好的细胞悬液,2~3 h后染毒,BPA浓度分别为0(溶剂对照)、10-12、10-10、10-8、10-6和 10-4mol·L-1,于 37℃,5%CO2和100%湿度的培养箱中连续培养5 d后去除培养液,加入 200 μL 4.5%戊二醛固定 20 min,生理盐水清洗3次后加入200 μL 0.05%中性红,室温孵育30 min。弃去中性红,生理盐水清洗3次后用酸性乙醇提取2 h,540 nm进行比色测量吸光度值(A)。细 胞 存 活 率 (%)=A染毒组/A溶剂对照组×100%。
1.5 苏木精染色法检测中脑细胞分化形成的集落总面积
按照1.4项分组处理的细胞,经不同浓度BPA染毒5 d后加入4%甲醛固定后,用Harries苏木精染色10 s,弃苏木精,将96孔板浸于蒸馏水中返蓝15 min,风干后于倒置显微镜下照相,利用Image图像处理软件计算中脑细胞分化形成的集落总面积。集落分化百分比(%)=染毒组集落总面积/溶剂对照组集落总面积×100%。
1.6 检测雌激素受体抑制剂和BPA共同培养对中脑微团细胞存活和集落分化的影响
96孔板每孔加入5 μL制备好的细胞悬液,2~3 h 后染毒,分别加入溶剂对照、BPA 0.1 mmol·L-1、ICI182780 0.1 nmol·L-1、TAM 1 nmol·L-1、BPA 0.1 mmol·L-1+ICI182780 0.1 nmol·L-1、BPA 0.1 mmol·L-1+TAM 1 nmol·L-1共同培养5 d,按照1.4和1.5项检测细胞存活率及集落总面积。
1.7 检测正常组织细胞中ER蛋白和mRNA表达
1.7.1 Western blot法检测正常组织细胞中ER蛋白的表达
6孔板每孔加入300 μL制备好的中脑细胞悬液(方法同1.3),细胞接种完毕后将培养板放入培养箱中,贴壁2~3 h后加培养液培养到第5天,弃去培养液,用PBS清洗3次,加入适量蛋白裂解液(每106个细胞加入200 μL裂解液)。于冰上裂解30 min后,4℃下离心12 000×g 15 min,取上清。分别取100 mg胎龄18 d(gestation day 18,G18)的胎鼠脑组织和成年雄性大鼠睾丸组织,各加1 mL蛋白裂解液,于冰上裂解30 min后,12 000×g 4℃离心15 min,取上清。上述制备的样品以50 μg总蛋白含量进行10%SDS-PAGE电泳,之后电转至硝酸纤维素膜,5%的脱脂奶粉室温封闭2 h后,一抗4℃杂交过夜,后再进行辣根过氧化物酶修饰的山羊抗兔的二抗标记,室温封闭2 h,最后用化学发光法曝光显影,得到蛋白条带。用Quantity One软件对蛋白条带进行定量分析,目的蛋白的相对表达量=目的蛋白条带积分光密度值/内参β肌动蛋白条带积分光密度值。
1.7.2 实时定量PCR法检测正常组织细胞中ER mRNA的表达
细胞培养方法同1.7.1,未经BPA染毒的中脑细胞体外培养5 d后弃去培养液,按照Trizol Up使用说明书提取细胞总RNA。分别取100 mg E13、E18胎鼠脑组织、成年大鼠睾丸和卵巢组织,各加1 mL Trizol Up裂解液提取组织总RNA。各取上述总RNA样品500 ng进行cDNA第一链合成。参照荧光定量PCR试剂盒说明进行基因表达的检测,引物序列见表1。采用2-△△Ct法进行基因表达相对定量,以卵巢组织作为参照因子,计算其他各组织中ER表达量经GAPDH校正后相对于卵巢的表达量。

Tab.1 Primers for Real-time PCR
1.8 实时定量PCR法检测BPA染毒中脑细胞中Notch1和Hes1 mRNA的表达
6孔板每孔加入300 μL制备好的中脑细胞悬液(方法同1.3),细胞接种完毕后将培养板放入培养箱中,2~3 h后染毒,BPA浓度分别为0(溶剂对照)和0.1 mmol·L-1。分别在细胞培养第 2,3,4和5天按1.7.2项进行细胞总RNA的提取、cDNA第一链的合成以及Notch1和Hes1 mRNA表达的检测。采用2-△△Ct法进行基因表达相对定量。
1.9 统计学方法
采用SPSS13.0统计软件进行数据分析。在满足正态分布和方差齐性的条件下,各剂量组间的均数比较采用单因素方差分析和Tukey's两两比较检验方法,统计学检验水平α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 BPA对中脑微团细胞存活和集落分化的影响
如图1所示,中脑微团细胞分别在含普通胎牛血清的培养体系和含无雌激素胎牛血清(经活性炭处理过)的培养体系中进行培养,发现与溶剂对照相比,BPA 10-12~10-6mol·L-1对细胞存活和集落分化百分比均没有明显的影响,BPA 10-4mol·L-1染毒组细胞存活率为(64.05±5.30)%(P<0.05)、集落分化百分比(51.90 ±13.82)%(P <0.05)。说明培养体系中含有的雌激素不影响BPA对中脑微团细胞的毒性作用,在后续的实验中采用普通胎牛血清配制培养体系,选择对中脑微团细胞存活和集落分化影响最为显著的 BPA 0.1 mmol·L-1进行研究。
2.2 雌激素受体抑制剂和BPA共同培养对中脑微团细胞存活和集落分化的影响
如图2、图 3 所示,BPA 0.1 mmol·L-1可以显著抑制中脑微团细胞的存活和集落分化(表现为集落形成的总面积减少)。ER抑制剂 ICI182780(0.1 nmol·L-1)和 TAM(1 nmol·L-1)均不影响中脑微团细胞的存活和集落分化,但亦不能逆转BPA对中脑微团细胞存活和集落分化的抑制作用,说明BPA对中脑微团细胞存活和集落分化的抑制作用可能不是通过ER途径介导的。

Fig.1 Effect of bisphenol A(BPA)on cell viability(A)and foci differentiation(B)of midbrain(MB)cells under charcoal-treated or charcoal-untreated sera.MB cells were prepared from rat embryonic midbrain on gestation day 13.MB cells were incubated with BPA for 5 d. ±s,n=6.*P <0.05,compared with solvent control.
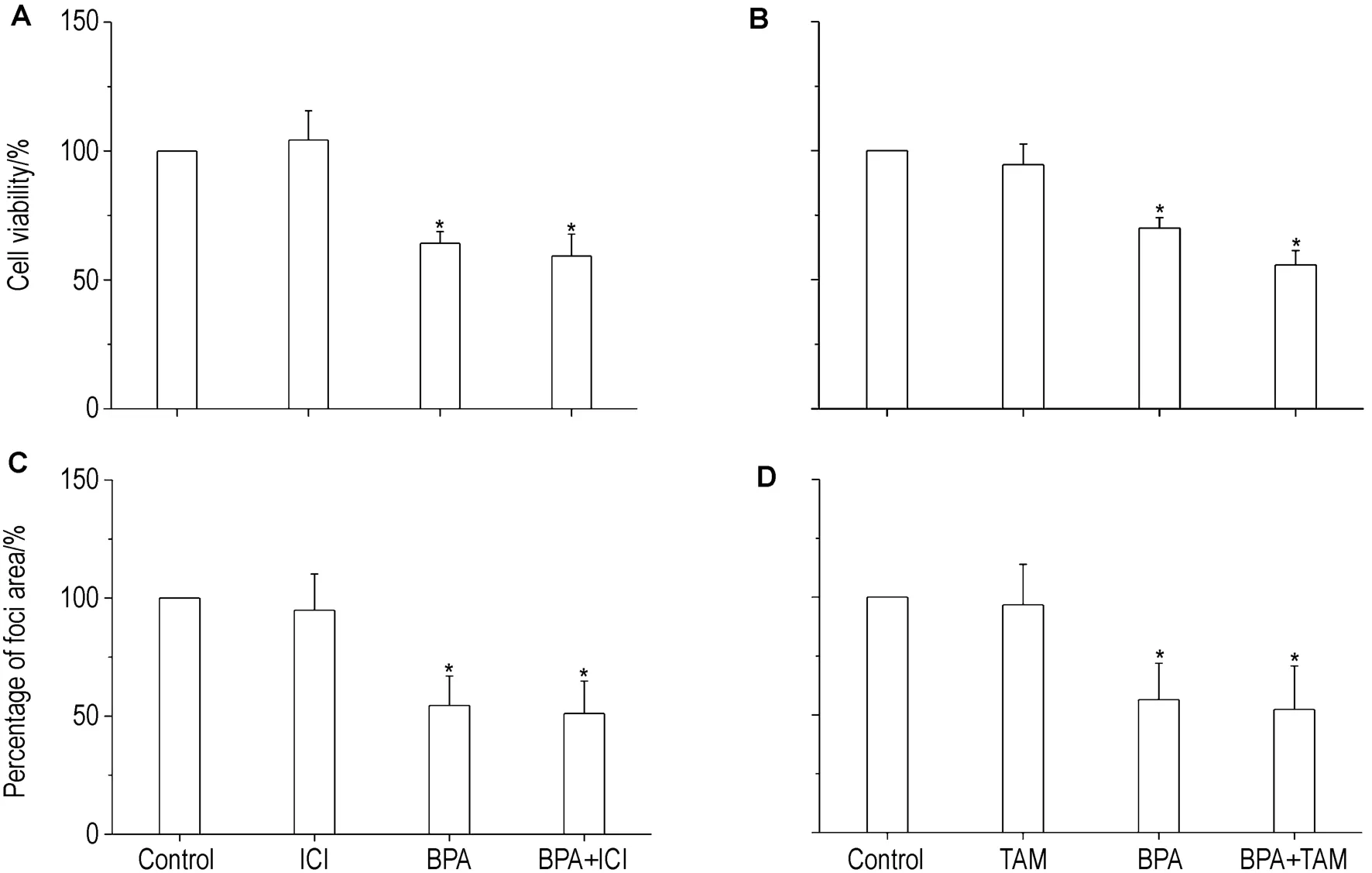
Fig.2 Effects of ICI182780 0.1 nmol·L -1(A,C)and TAM 1 nmol·L -1(B,D)on the inhibition of cell viability(A,B)and foci differentiation(C,D)in MB cell induced by BPA 0.1 mmol·L -1.±s,n=6.*P <0.05,compared with solvent control.

Fig.3 Effects of ICI182780 and TAM on the inhibition of foci differentiation in MB cell induced by BPA.A:solvent control;B:BPA 0.1 mmol·L-1;C:ICI182780 0.1 nmol·L-1;D:TAM 1 nmol·L-1;E:BPA 0.1 mmol·L-1+ICI182780 0.1 nmol·L-1;F:BPA 0.1 mmol·L -1+TAM 1 nmol·L -1 .
2.3 正常组织及中脑微团细胞中 ER蛋白和mRNA的表达
如图4所示,与阳性对照(成年大鼠的睾丸组织)相比,G18胚胎脑组织和中脑微团细胞中ERα和ERβ蛋白表达水平较低(P<0.05)。睾丸组织、G18胚胎脑组织和中脑微团细胞中ERα相对表达量分别为 1.57 ± 0.23,0.35 ± 0.12 和 0.41 ±0.08;ERβ 相对表达量分别为0.87 ±0.06,0.56 ±0.07和0.47±0.11。荧光定量 PCR 法对 G13和G18胎鼠脑组织及未经BPA染毒的中脑细胞中ERα和ERβ mRNA的表达水平进行定量分析,结果如图5所示,与ERα高表达的睾丸组织相比,胚胎脑组织和中脑微团细胞中ERα mRNA表达水平极低,约为其1/400;与ERβ高表达的卵巢组织相比,胚胎脑组织和中脑微团细胞中ERβ mRNA表达水平很低,约为其1/10。
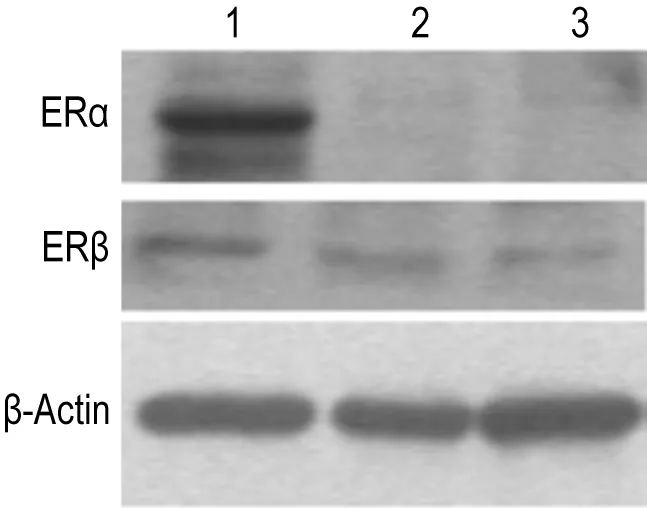
Fig.4 Protein expression levels of ERα and ERβ in normal adult testis,brain of gestation day 18(G18)and MB cells.Lane 1:adult testis;lane 2:embryonic brain of G18;lane 3:MB cells.

Fig.5 The mRNA expression levels of ERα and ERβ in normal adult testis,ovary,brain of G18 and G13 and MB cells.±s,n=3.*P <0.05,compared with ovary
2.4 BPA对中脑微团细胞Notch1和Hes1 mRNA表达水平的影响
如图6 所示,BPA 0.1 mmol·L-1染毒组中脑微团细胞在体外培养第2至5天Hes1 mRNA的表达水平为对照组的1.97~2.61倍,Notch1 mRNA表达水平仅在培养第2天有显著增加,为对照组的2.68 倍。
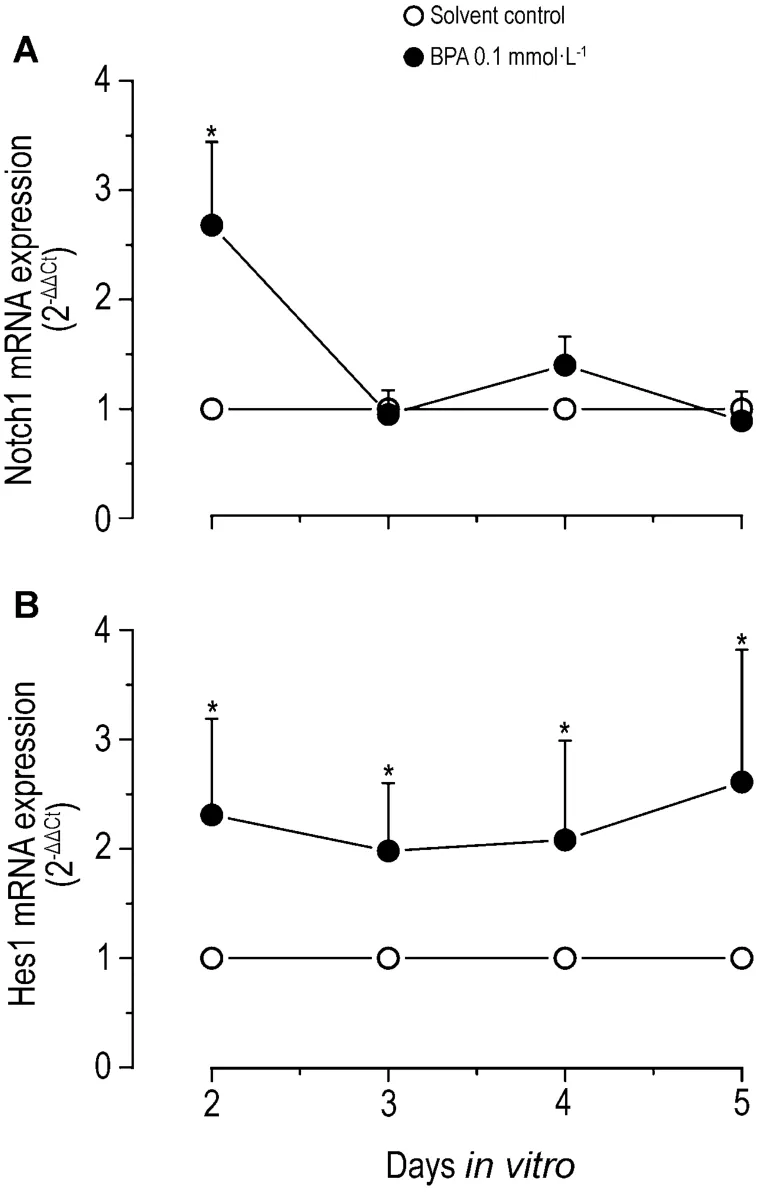
Fig.6 Effect of BPA on mRNA expression levels of Notch1 and Hes1 by real-time PCR.±s,n=5.*P <0.05,compared with solvent control.
3 讨论
本研究结果表明,BPA 0.1 mmol·L-1可以抑制中脑微团细胞的存活和集落分化,提示BPA具有潜在的发育毒性。根据以往的文献报道[11-12],ICI182780 0.1 nmol·L-1和 TAM 1 nmol·L-1可以拮抗ER且不会抑制细胞的存活和分化。本研究结果显示,ICI182780和TAM均不能阻断BPA对细胞存活和分化的抑制作用。Lee等[11]发现BPA在100 ~500 μmol·L-1剂量范围内显著抑制了 PC12细胞和皮质神经元的分化和存活,这种毒性不能被ER阻断剂逆转;将微量的BPA作用于表达ER的MCF-7细胞和不表达ER的C4-12细胞后,检测细胞中基因表达的变化,结果发现至少有15种基因表达的变化不依赖于ER[13];低剂量BPA能够对新生小鼠的神经胶质细胞产生双向影响,加入ER阻断剂ICI182780后此效应没有发生改变[12]。上述研究结果均说明BPA可以不通过ER途径发挥作用。
本研究发现,蛋白和mRNA的表达水平均很低。有研究指出,在小鼠胚胎发育第10.5天的脑组织中开始有ERβ mRNA表达,第16.5天的脑组织中才有ERα mRNA的表达[14]。本研究中培养的中脑细胞源于第13天的胚胎,ER表达量极低,不能发挥相应作用,所以ER抑制剂不能逆转BPA对中脑微团细胞的毒性作用。因此,我们推测BPA诱导的中脑微团细胞的毒性效应可能主要不是由ER途径介导的,而是有其他信号通路参与的。
Notch-Hes信号通路是一条保守的信号转导途径,在多种组织和器官的早期发育过程中,其家族成员对细胞的发育、生长及凋亡起着重要的调控作用。Notch信号由两个邻近细胞的受体与配体相互作用而激活,进而活化Hes等分化拮抗基因的转录,其表达产物与相应的分化效应基因的启动子特异性结合,阻碍细胞特异性分化效应基因的表达,最终影响细胞的分化和增殖[15]。本研究发现,BPA 0.1 mmol·L-1在体外培养第 2 至第 5 天的中脑微团细胞中可以上调Hes1 mRNA的表达水平,Notch1 mRNA表达水平仅在培养第2天有显著上调。这一结果说明,BPA可能通过上调Notch1受体表达,活化Hes1的转录表达,进而发挥抑制细胞分化的作用。在Notch1表达恢复到对照水平后,Hes1的表达还可持续上调,继续抑制细胞的分化。
目前有关Notch-Hes通路在BPA毒性中作用的研究并不多。对非洲爪蟾胚胎的研究结果表明,BPA 50 和100 μmol·L-1可使10.5 d 胚胎中Notch下游的Esr-1基因表达下调,加入Notch配体胞内结构域能够有效的逆转BPA对Esr-1的下调[16]。皮下给予孕鼠低于 NOAEL 剂量(20 μg·kg-1)的BPA,发现在E12.5胎鼠端脑Hes1和Hes5表达下调,而到 E14时,Hes1表达上调[17]。哺乳动物中的Hes基因和非洲爪蟾的Esr-1基因为同源基因,结合对非洲爪蟾的研究结果发现,BPA能影响Notch-Hes信号通路,且具有时间效应,这与本研究的结果相一致。
本研究提示,ER途径在BPA对中脑微团细胞存活和分化的抑制作用中可能不发挥主要作用,Notch-Hes信号通路可能参与了这一效应,深入的信号转导通路机制还有待进一步探讨。
[1] Chapin RE,Adams J,Boekelheide K,Gray LE Jr,Hayward SW,Lees PS,et al.NTP-CERHR expert panel report on the reproductive and developmental toxicity of bisphenol A[J].Birth Defects Res B Dev Reprod Toxicol,2008,83(3):157-395.
[2] Calafat AM1,Kuklenyik Z,Reidy JA,Caudill SP,Ekong J,Needham LL.Urinary concentrations of bisphenol A and 4-nonylphenol in a human reference population[J].Environ Health Perspect,2005,113(4):391-395.
[3] Engel SM, Levy B, Liu Z,Kaplan D,Wolff MS.Xenobiotic phenols in early pregnancy amniotic fluid[J].Reprod Toxicol,2006,21(1):110-112.
[4] Shelnutt S, Kind J, Allaben W. Bisphenol A:Update on newly developed data and how they address NTP's 2008 finding of ″Some Concern″[J].Food Chem Toxicol,2013,57:284-295.
[5] Xiao Y,Liu R,Xing L,Xu Y,Shang L,Hao W.Combined developmental toxicity of bisphenol A and genistein in micromass cultures of rat embryonic limb bud and midbrain cells[J].Toxicol In Vitro,2011,25(1):153-159.
[6] Tando S, Itoh K, Yaoi T, Ikeda J,Fujiwara Y,Fushiki S.Effects of pre-and neonatal exposure to bisphenol A on murine brain development[J].Brain Dev,2007,29(6):352-356.
[7] Wetherill YB,Akingbemi BT,Kanno J,McLachlan JA,Nadal A,Sonnenschein C,et al.In vitro molecular mechanisms of bisphenol A action[J].Reprod Toxicol,2007,24(2):178-198.
[8] Ge LC, Chen ZJ, Liu HY, Zhang KS,Liu H,Huang HB,et al.Involvement of activating ERK1/2 through G protein coupled receptor 30 and estrogen receptor α/β in low doses of bisphenol A promoting growth of Sertoli TM4 cells[J].Toxicol Lett,2014,226(1):81-89.
[9] Lee HR,Hwang KA,Park MA,Yi BR,Jeung EB,Choi KC.Treatment with bisphenol A and methoxychlor results in the growth of human breast cancer cells and alteration of the expression of cell cyclerelated genes,cyclin D1 and p21,via an estrogen receptor-dependent signaling pathway[J].Int J Mol Med,2012,29(5):883-890.
[10] Chao HH,Zhang XF,Chen B,Pan B,Zhang LJ,Li L,et al.Bisphenol A exposure modifies methylation of imprinted genes in mouse oocytes via the estrogen receptor signaling pathway[J].Histochem Cell Biol,2012,137(2):249-259.
[11] Lee YM,Seong MJ,Lee JW,Lee YK,Kim TM,Nam SY,et al.Estrogen receptor independent neurotoxic mechanism of bisphenolA,an environmental estrogen[J].J Vet Sci,2007,8(1):27-38.
[12] Miyatake M,Miyagawa K,Mizuo K,Narita M,Suzuki T.Dynamic changes in dopaminergic neurotransmission induced by a low concentration of bisphenol-A in neurones and astrocytes[J].J Neuro-endocrinol,2006,18(6):434-444.
[13] Singleton DW,Feng Y,Chen Y,Busch SJ,Lee AV,Puga A,et al.Bisphenol-A and estradiol exert novel gene regulation in human MCF-7 derived breast cancer cells[J].Mol Cell Endocrinol,2004,221(1-2):47-55.
[14] Lemmen JG,Broekhof JL,Kuiper GG,Gustafsson JA,van der Saag PT,van der Burg B.Expression of estrogen receptor alpha and beta during mouse embryogenesis[J].Mech Dev,1999,81(1-2):163-167.
[15] Perdigoto CN,Bardin AJ.Sending the right signal:Notch and stem cells[J].Biochim Biophys Acta,2013,1830(2):2307-2322.
[16] Imaoka S,Mori T,Kinoshita T.Bisphenol A causes malformation of the head region in embryos of Xenopus laevis and decreases the expression of the ESR-1 gene mediated by Notch signaling[J].Biol Pharm Bull,2007,30(2):371-374.
[17] Nakamura K,Itoh K,Yaoi T,Fujiwara Y,Sugimoto T,Fushiki S.Murine neocortical histogenesis is perturbed by prenatal exposure to low doses of bisphenol A[J].J Neurosci Res,2006,84(6):1197-1205.

