纳米氧化铝亚慢性染毒致小鼠神经细胞线粒体损伤机制
郭卫伟,常丽俊,丁 勇,李 欢,葛翠翠,王海洋,张勤丽,牛 侨
(山西医科大学公共卫生学院劳动卫生教研室,山西太原 030001)
纳米氧化铝,作为一种新型的材料,由于其空间结构的特殊性而表现出与传统材料不同的特性(表面效应,小尺寸效应,宏观量子隧道效应及量子尺寸效应),并被应用于人工晶体、高效催化剂、涂料、高温陶瓷、密封黏结剂、医药、激光材料及屏蔽材料等[1],因此,纳米氧化铝材料的人体生物学效应研究,显得尤为必要。由于纳米颗粒的理化特性,可以沉积到鼻腔上腔黏膜,再通过嗅球迁移到脑组织其他部位[2],因此,本实验采用滴鼻染毒方式研究纳米氧化铝颗粒的神经毒性。
线粒体作为活性氧和ATP产生的主要细胞器。在细胞受到刺激时,线粒体的数量、大小及结构可发生病理性改变,从而调节着细胞的生存或死亡。Chen等[3]对纳米氧化铝进行体内外研究,发现线粒体是纳米氧化铝颗粒的主要靶细胞器之一。同时,线粒体功能失调也是众多中枢神经系统病变的早期特征。Tanaka等[4]发现线粒体功能紊乱可损伤小鼠的空间学习记忆能力。自噬可作为线粒体质量的主要调控机制之一[5-6]。Khan 等[7]发现,氧化铁纳米颗粒可损失细胞中的线粒体,同时细胞的自噬与线粒体的损伤程度成正相关。同时一些研究认为,自噬也可能引起细胞的死亡[8-10]。本课题组前期研究发现,不同浓度纳米氧化铝致原代神经元线粒体膜电位降低,小鼠的空间记忆能力显著降低[11-12]。在前期研究结果基础上,本实验观察纳米氧化铝对神经细胞线粒体的损伤,进一步探讨损伤神经细胞的机制。
1 材料与方法
1.1 试剂与仪器
纳米氧化铝(<50 nm)(美国Sigma公司);组织蛋白抽提试剂盒和BCA蛋白定量试剂盒(北京康为世纪生物科技有限公司);超微量ATP酶测定试剂 盒 (Na+-K+-ATPase、Ca2+-Mg2+-ATPase)(南京建成科技有限公司);微管相关蛋白轻链3(light chain 3,LC3)抗体(日本 Medical& Biological Laboratories公司);Beclin1抗体(美国Proteintech Group公司);细胞素c氧化酶亚单位Ⅳ(cytochrome c oxidaseⅣ,COXⅣ)抗体(美国Proteintech Group公司);抗β肌动蛋白鼠单克隆抗体(北京康为世纪科技有限公司);抗GAPDH鼠单克隆抗体(北京康为世纪科技有限公司);山羊抗小鼠IgG(H+L),HRP(北京康为世纪科技有限公司);兔抗山羊IgG(美国Jackson Immuno Research公司);e-ECL发光液(北京康为世纪科技有限公司);其他试剂均为国产分析纯。
超声波破碎仪(Sonics&Material Inc.,美国);酶标仪(美国Becton Dickinson公司);DYY-12型电泳仪电源(北京六一仪器厂);2600C自动X射线胶片洗片机(上海申贝总公司电影机械厂);捷达801系列凝胶电泳图像分析系统(江苏省捷达科技发展有限公司);透射电镜(JEM-100CX,Japan)。
1.2 纳米氧化铝(<50 nm)悬液的制备与表征
纳米氧化铝颗粒溶于生理盐水中,制成相应浓度的悬液。超声 30 min后,电子显微镜(×80 000)观察纳米氧化铝颗粒,呈规则分布均匀的球形,平均粒径为(112±24)nm。静置1 h后,纳米氧化铝颗粒粒径和分布无显著变化。因此,染毒期间纳米颗粒的形状及分散程度没有明显变化。

Fig.1 Distribution of 50 nm Al2O3after ultrasonic(A)and on standing for 1 h after ultrasonic(B).
1.3 动物分组及染毒后处理
健康成年雌性ICR小鼠40只,体质量20~25 g,由中国协和医科大学实验动物中心提供,许可证编号:SCXK(京)2011-0012。动物房以自然节律采光,温度20~25℃,湿度40% ~60%,清洁,安静。小鼠自由进食饮水,适应喂养1周后,按体质量随机分为4组:生理盐水对照组,纳米氧化铝25,50和75 mg·kg-1。每天鼻腔滴注3 次,每次10 μL,约50 min,连续染毒30 d。染毒过程中,均匀缓慢滴注两侧鼻孔,待鼻腔中未排出液体再放回鼠笼,每只滴注需要约1 min左右,连续染毒1个月。染毒结束后,经过7 d的行为学检测后,立即处死小鼠。
1.4 海马CA3区神经细胞超微结构观察
各组分别剥取1只小鼠海马CA3区的组织块(约1 mm2大小),快速放入固定液中,固定后经漂洗,脱水和渗透过程,镜检;并通过Olympus分析软件测量线粒体粒径。
1.5 线粒体 Na+-K+-ATPase 与 Ca2+-Mg2+-ATPase活力测定
各组选取3只小鼠处死,取新鲜大脑皮质100 g,采用差速离心法,粗提细胞线粒体(即镜检细胞中不存圈的亮环数达70% ~80%),溶解于0.1 mL预冷的活性裂解液(Tris·HCl 20 mmol·L-1pH 7.5,EGTA 2 mmol·L-1,EDTA 2 mmol·L-1,1%Trion-100,每毫升线粒体活性裂解液加入1 μL蛋白酶抑制剂和1 μL DTT),冰上放置100 min,再涡旋振荡30 s,4℃,15 000 ×g,离心10 min,取上清液,按照说明书测定酶活力。
1.6 Western蛋白印迹法检测COXⅣ,Beclin 1及LC3表达
各组选取3只小鼠处死,剥取大脑皮质,-80℃冻存,按试剂盒说明书抽提组织蛋白,用BCA法蛋白定量,加等体积的2×上样缓冲液,煮沸5 min,制成样品。凝胶电泳图像分析系统分析条带积分吸光度值。以β肌动蛋白,GAPDH为内参。分别用COXⅣ/β肌动蛋白,Beclin 1/GAPDH,LC3Ⅱ/LC3Ⅰ的积分吸光度值比例表示相应蛋白的表达量。
1.7 统计学分析
2 结果
2.1 纳米氧化铝对小鼠神经细胞线粒体的影响
图2A与B所示,纳米氧化铝0与25 mg·kg-1组线粒体形态呈线状,嵴结构完整和密度紧密。而纳米氧化铝50 mg·kg-1组线粒体明显肿胀,内嵴结构排列稀疏,核周线粒体呈空泡化(图2C1,C2)。纳米氧化铝75 mg·kg-1组线粒体大多呈微球形,嵴结构完整但密度增强(图2D1,D2)。线粒体的平均粒径如表1所示,纳米氧化铝50 mg·kg-1组分别是0 与25 mg·kg-1组的1.4 倍与1.5 倍(P <0.05)。而75 mg·kg-1组却是 50 mg·kg-1组的 73%(P <0.05)。

Fig.2 Morphological changes in the mitochondrion in CA3 regions of the nerve cell in the ICR mouse treated with Al2O3nanoparticles detected bytransmission electron microscopy.The mouse treated with nano-alumina(< 50 nm)by nasal inhalation for 1 month.A:nano-Al2O3 0 mg·kg -1group;B:nano-Al2O325 mg·kg -1group;C:nano-Al2O350 mg·kg -1group;D:nano-Al2O375 mg·kg -1group.1:showed the whole nerve cell;2:the part of 1.Arrows showed the mitochondrion.

Tab.1 Effect of nano-alumina on the diameter of the mitochondrion of nerve cells
2.2 纳米氧化铝对线粒体 Na+-K+-ATPase与Ca2+-Mg2+-ATPase 活力的影响
表2结果显示,纳米氧化铝引起线粒体Na+-K+-ATPase 和 Ca2+-Mg2+-ATPase 活力显著下降(P<0.05)。与正常对照组相比,纳米氧化铝50和75 mg·kg-1组 Na+-K+-ATPase 活力分别下降52%和 58%(P <0.05),Ca2+-Mg2+-ATPase 活力分别下降51%和50%。与25 mg·kg-1组相比,纳米氧化铝50和75 mg·kg-1组分别降低43%和50%(P <0.05)。

Tab.2 Effect of nano-alumina(< 50 nm)on the enzyme activities of Na+ -K+ -ATPase and Ca2+-Mg2+-ATPase in mitochondria
2.3 纳米氧化铝对皮质COXⅣ,Beclin 1,LC3Ⅰ和LC3Ⅱ蛋白表达的影响
Western电泳结果(图3)及半定量数据结果(表3)显示,纳米氧化铝75 mg·kg-1组 COXⅣ蛋白表达显著下降(P<0.05);其他剂量组之间无统计学差异。说明纳米氧化铝75 mg·kg-1显著降低线粒体的数量。纳米氧化铝75 mg·kg-1组蛋白Beclin 1表达量和LC3Ⅱ/LC3Ⅰ的比例显著增加,正常对照组的1.4 和2.1 倍(P<0.05)。
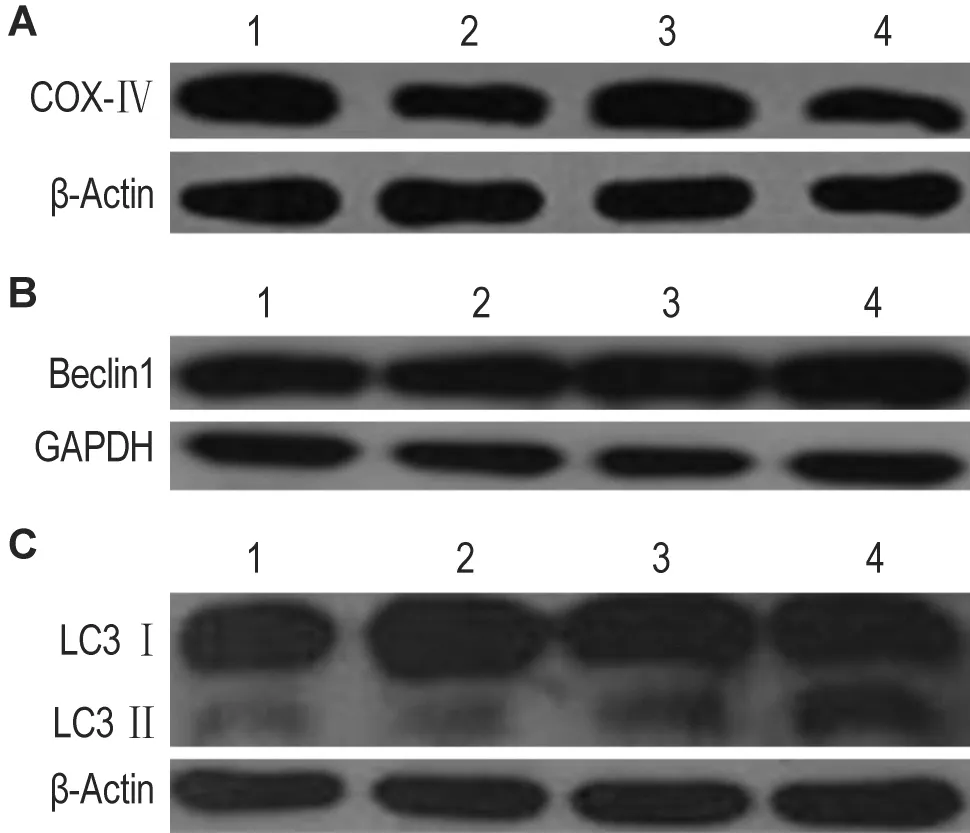
Fig.3 Effect of nano-alumina(< 50 nm)on the expression of cytochrome c oxidaseⅣ(COXⅣ)(A),Beclin 1(B)and light chain 3Ⅱ(LC3Ⅱ)/LC3Ⅰ(C)proteins in cerebral cortex.See Fig.1 for the treatment.Lane1 -4:nano-Al2O30,25,50 and 75 mg·kg-1,respectively.
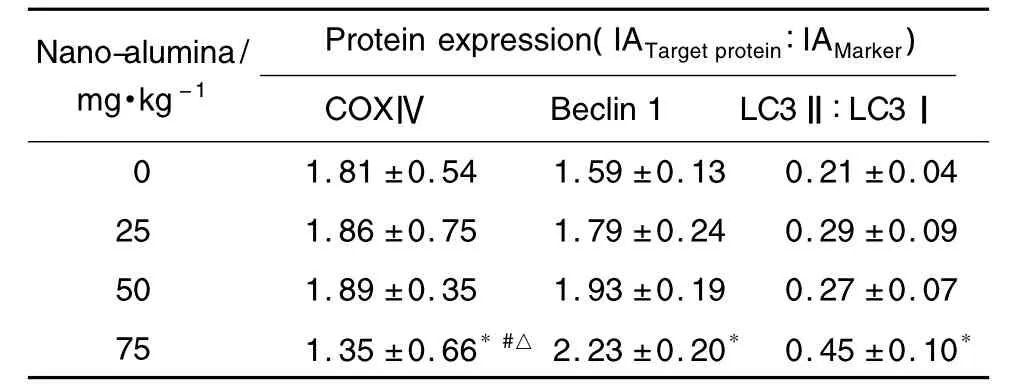
Tab.3 Effect of nano-alumina(<50 nm)on the expression of COX-Ⅳ,Beclin1 and LC3Ⅱ/LC3Ⅰproteins in cerebral cortex
3 讨论
本研究显示,纳米氧化铝能够引起线粒体结构明显的形态学改变;同时暴露于不同浓度纳米氧化铝的线粒体粒径存在统计学差异,从定量水平进一步说明了线粒体结构的损伤。同时,随着纳米氧化铝浓度的升高,Na+-K+-ATPase 和 Ca2+-Mg2+-ATPase活力,COX-Ⅳ蛋白的表达明显下降,而自噬相关蛋白的表达量明显升高。COX-Ⅳ蛋白作为线粒体的标志蛋白,可以用来对线粒体数量进行定量检测[13]。综上表明,纳米氧化铝可明显损伤神经细胞线粒体的结构并引起功能及数量的下降,而受损的线粒体受到机体的自噬清除。Lin等[14]研究发现,ICR小鼠经静脉注射不同浓度的量子点705,神经细胞的线粒体呈现渐进性变化,线粒体肿胀或代偿性肥大,最后可见微球形线粒体增生,而这些微线粒体可能是功能低下的新生线粒体。Narendra等[15]认为,线粒体的调控性降解与线粒体的分离密切相关。因此,本研究中纳米氧化铝损伤线粒体结构,并可能引起幼稚线粒体增生,而这加重酶活力的下降。酶活力的降低可间接表明纳米氧化铝影响线粒体的供能,但线粒体ATP含量的变化还需进一步的检测。机体通过自噬清除受损的线粒体,进一步解释了线粒体数量的下降。Chen等[16]研究发现,自噬可能是纳米氧化铝介导细胞毒性的主要机制。在本研究中,自噬在清除受损线粒体的同时,也可能通过对线粒体质量的调控而影响神经细胞功能。但也有研究报道,纳米颗粒损伤线粒体的同时,也可引起细胞的凋亡或坏死[17-18]。
综上所述,纳米氧化铝可损伤神经元线粒体,激活细胞内的自噬途径。然而,线粒体的分离增生,并未引起线粒体数量的增加;同时,在纳米氧化铝诱导自噬的产生,是否存在其他死亡方式,均需进行更进一步研究。
[1] Wang DR.Nano-alumina[J],Polymer Additives(聚合物与助力剂),2009,(2):28-35.
[2] Oberdörster G,Sharp Z,Atudorei V,Elder A,Gelein R,Kreyling W,Cox C.Translocation of inhaled ultrafine particles to the brain[J].Inhal Toxicol,2004,16(6-7):437-445.
[3] Chen L,Yokel RA,Hennig B,Toborek M.Manufactured aluminum oxide nanoparticles decrease expression of tight junction proteins in brain vasculature[J].J Neuroimmun Pharmacol,2008,3(4):286-295.
[4] Tanaka D, Nakada K, Takao K,Ogasawara E,Kasahara A,Sato A,et al.Normal mitochondrial respiratory function is essential for spatial remote memory in mice[J].Mol Brain,2008,1:21.
[5] Brunk UT,Terman A.The mitochondrial-lysosomal axis theory of aging:accumulation of damaged mitochondria as a result of imperfect autophagocytosis[J].Eur J Biochem,2002,269(8):1996-2002.
[6] Tatsuta T,Langer T.Quality control of mitochondria:protectionagainstneurodegenerationand ageing[J].EMBO J,2008,27(2):306-314.
[7] Khan MI, Mohammad A, Patil G, Naqvi SA,Chauhan LK,Ahmad I.Induction of ROS,mitochondrial damage and autophagy in lung epithelial cancer cells by iron oxide nanoparticles[J].Biomaterials,2012,33(5):1477-1488.
[8] Yu L,Wan F,Dutta S,Welsh S,Liu Z,Freundt E,et al.Autophagic programmed cell death by selective catalase degradation[J].Proc Natl Acad Sci USA,2006,103(13):4952-4957.
[9] Gozuacik D,Kimchi A.Autophagy and cell death[J].Curr Top Dev Biol,2007,78:217-245.
[10] Lam D,Kosta A,Luciani MF,Golstein P.The inositol 1,4,5-trisphosphate receptor is required to signal autophagic cell death[J].Mol Biol Cell,2008,19(2):691-700.
[11] Ji JW.The investigation of cognitive impairment in mice expoured to nano-alumina particles by nasal drip(鼻腔滴注纳米氧化铝颗粒致小鼠认识损伤的探讨)[D].Taiyuan:Shanxi Medical University,2011.
[12] Ge CC,Li WQ,Zhang QL,Niu Q.In vitro study on the effects of Nano-aluminum oxide particles with various sizes on apoptosis of neuron cells[J].J Environ Occup Med(环境与职业医学),2012,29(2):72-76.
[13] Li N, Sioutas C, Cho A, Schmitz D,Misra C,Sempf J,et al.Ultrafine particulate pollutants in-duce oxidative stress and mitochondrial damage[J].Environ Health Perspect,2003,111(4):455-460.
[14] Lin CH,Chang LW,Wei YH,Wu SB,Yang CS,Chang WH,et al.Electronic microscopy evidence for mitochondria as targets for Cd/Se/Te-based quantum dot 705 toxicity in vivo[J].Kaohsiung J Med Sci,2012,28(7 Suppl):S53-S62.
[15] Narendra D,Tanaka A,Suen DF,Youle RJ.Parkin is recruited selectively to impaired mitochondria and promotes their autophagy[J].J Cell Biol,2008,183(5):795-803.
[16] Chen L,Zhang B,Toborek M.Autophagy is involved in nanoalumina-induced cerebrovascular toxicity[J].Nanomedicine,2013,9(2):212-221.
[17] Afeseh Ngwa H,Kanthasamy A,Gu Y,Fang N,Anantharam V,Kanthasamy AG.Manganese nanoparticle activates mitochondrial dependent apoptotic signaling and autophagy in dopaminergic neuronal cells[J].Toxicol Appl Pharmacol,2011,256(3):227-240.
[18] Wang G,Wang JJ,Yang GY,Du SM,Zeng N,Li DS,et al.Effects of quercetin nanoliposomes on C6 glioma cells through induction of typeⅢ programmed cell death[J].Int J Nanomed,2012,7:271-280.

