维生素D对妊娠糖尿病胰岛素敏感性脂肪因子及肿瘤坏死因子-α的影响
张黎明,高凌,帅红霞,润袁敏,邓晨盺,田源,马计,肖婧
(湖北文理学院附属医院内分泌科,襄阳 441021)
维生素D对妊娠糖尿病胰岛素敏感性脂肪因子及肿瘤坏死因子-α的影响
张黎明,高凌,帅红霞,润袁敏,邓晨盺,田源,马计,肖婧
(湖北文理学院附属医院内分泌科,襄阳 441021)
目的 探讨血清维生素D水平对妊娠糖尿病(GDM)胰岛素敏感性、脂肪因子脂联素(APN)、视黄醇结合蛋白4(RBP4)、内脂素(visfatin)及肿瘤坏死因子(TNF-α)的影响及作用机制。方法选择妊娠糖尿病患者101例(GDM组)和血糖正常孕妇50例(正常组),检测两组相关生化指标、APN、RBP4、visfatin、TNF-α及25羟化维生素D3(25OHD3)水平。在GDM组中将诊断为维生素D缺乏患者24例随机分为治疗组及对照组各12例,治疗组口服1,25二羟维生素D3[1,25(OH)2D3]0.25μg·d-11个月,再行相关生化指标检查。结果GDM组患者25OHD3及APN水平明显低于正常组(P<0.05),而RBP4、visfatin、TNF-α水平高于正常组(均P<0.05);治疗组经补充维生素D,胰岛素分泌指数上升,胰岛素抵抗指数下降,而APN水平升高,与25OHD3呈正相关(r=0.526);RBP4、visfatin、TNF-α降低,与25OHD3呈负相关(r分别为-0.272,-0.153,-0.072)。结论维生素D可降低相关脂肪因子RBP4、visfatin和TNF-α,升高APN,从而对妊娠糖尿病起到防治作用。
维生素D;糖尿病,妊娠;胰岛素敏感性;脂联素;内脂素;视黄醇结合蛋白;肿瘤坏死因子
研究表明,维生素D缺乏与糖代谢异常相关[1]。维生素D的经典作用是维持机体钙环境稳定和骨代谢平衡。维生素D缺乏症可以造成肥胖和代谢综合征,其核心发病环节是胰岛素抵抗(insulin resistance, IR),这也是妊娠糖尿病(gestational diabetesmellitus, GDM)的发病机制之一。临床研究表明,GDM患者往往有一个低维生素D状态,可能与白色脂肪组织维生素D受体失活有关[2]。维生素D通过抑制脂肪形成转录因子和脂质的蓄积,同时也影响脂肪因子的产生及其参与炎症反应,从而发挥着调节体内脂肪生成的作用。2012年10月~2013年3月,笔者通过测定GDM患者相关生化指标及脂肪因子,探讨维生素D通过相关脂肪因子对GDM发病机制的调控作用。
1 资料与方法
1.1 临床资料 选择本院住院的GDM患者101例(GDM组),同期产科门诊健康体检者50例(正常组),年龄(28±2)岁,孕周(26±2)周。GDM患者均符合2010年美国糖尿病学会的《糖尿病诊治指南》的糖尿病诊断标准;维生素D缺乏的入选标准:血清25羟化维生素D3(25OHD3)<25 ng·mL-1。排除骨折、免疫性疾病、糖尿病急性并发症及近6个月服用维生素D、钙制剂者,以及使用胰岛素及类似物者。
1.2 观察指标 测定孕前身高、体质量,计算孕前体质量指数(body mass index,BMI)。空腹血糖(fasting blood glucose,FBG)、口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)、餐后2 h血糖(2 h postprandial blood glucose,2 hPG)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)采用日立7600全自动生化分析仪测定。糖化血红蛋白(glycated hemoglobin,HbA1c)采用液相离子交换层析法测定。空腹胰岛素(fasting insulin,FINS)使用化学发光免疫分析测定。计算胰岛素抵抗指数(HOMAIR)和胰岛素分泌指数(HOMA-β)。采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定血清脂肪因子脂联素(adiponectin,APN)、视黄醇结合蛋白4(retinol binding protein 4,RBP4)、内脂素(visfatin)及肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)。测定25OHD3:采取高效液相色谱法(HPLC)测定。取静脉血,-70℃冻存以备用。色谱柱:Hypesil ODS,5μm,250 mm×4.0 mm预柱:Lichrospher 100RP-185μm,4 mm×4 mm;流动相:乙腈∶水(80∶20);流速:1 mL·min-1;柱温:30℃;检测波长:265 nm。
1.3 治疗方法 选取GDM组中确诊为维生素D缺乏(<25 nmol·L-1)的患者24例,随机分治疗组和对照组各12例,两组均行胰岛素类似物治疗,制定相同的饮食及运动计划,治疗组口服1,25(OH)2D3(青岛双鲸药业有限公司,批准文号:国药准字H20113033) 0.25μg·d-1,1个月后两组行血清相关指标检测。
1.4 统计学方法 采用SPSS17.0版统计软件对结果进行统计学处理。研究数据均为计量资料,以均数±标准差()表示,两组间均数做方差齐性检验后采用独立样本t检验。以P<0.05为差异有统计学意义。变量间相关程度采用Pearson相关分析。
2 结果
2.1 GDM组和正常组观察指标比较 两组年龄差异无统计学意义(P>0.05)。GDM各组的BMI、体质量、血糖(空腹及餐后2 h)、TG、APN、RBP4、Visfatin、TNF-α与正常组比较,均差异有统计学意义(P<0.05)。GDM组的血清25OHD3水平较正常组明显降低(P<0.05)。见表1,表2。
2.2 治疗组和对照组观察指标比较 治疗组相对于对照组,胰岛素敏感性(HOMA-IR)下降(P=0.000),血糖下降不明显(P=0.422)。见表3。
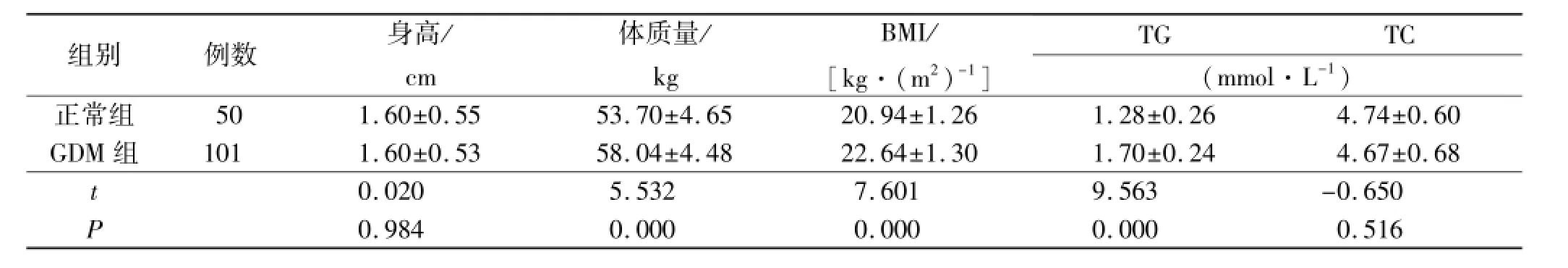
表1 GDM组与正常组临床资料和血脂生化指标比较Tab.1 Comparison of clincal data and blood lipid biochem ical index between GDM group and normol group
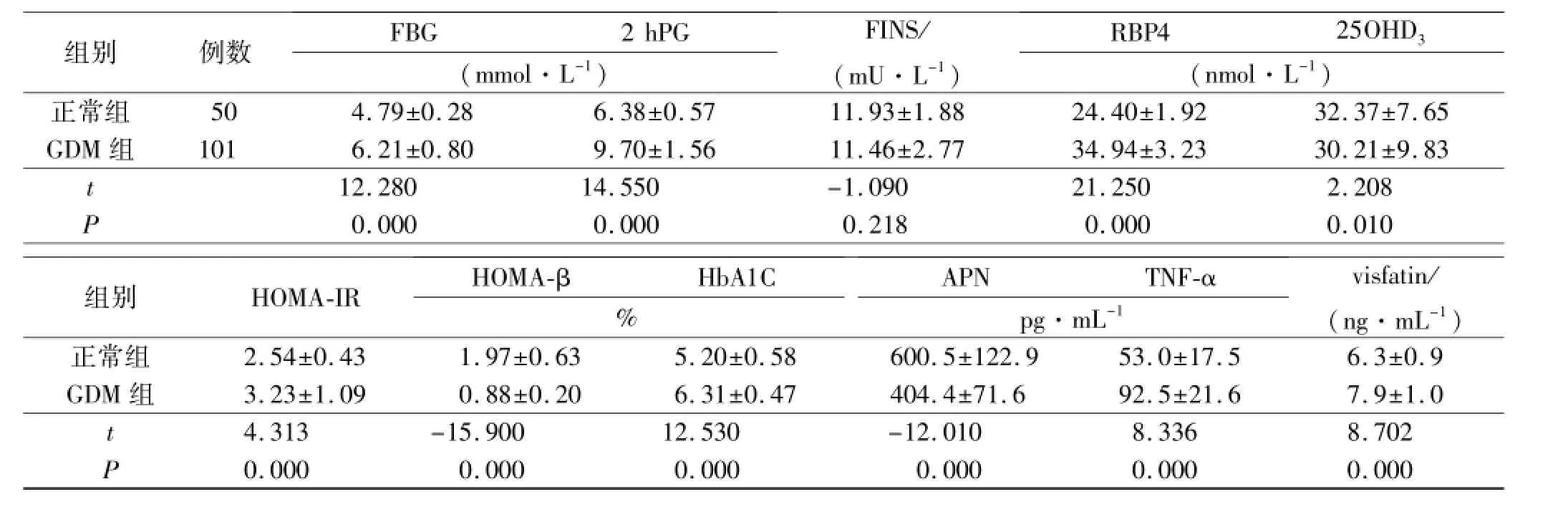
表2 GDM组与正常组血生化指标比较Tab.2 Comparison of biochem ical parameters between GDM group and normal group
2.3 25OHD3与RBP4APN、visfatin、TNF-α的相关性分析 25OHD3与RBP4APN、visfatin、TNF-α的相关性(r)分别为0.526,-0.272,-0.153,-0.072。
3 讨论
维生素D及其活性形式[1,25(OH)2D3]是有效的免疫调节剂,而25OHD3具有更长的生物半衰期,可作为反映体内维生素D状况的最佳指标。维生素D在葡萄糖及胰岛素代谢中发挥重要作用[3]。维生素D受体和25-羟基维生素D1α-羟化酶(CYP27B1)基因在大量的组织,包括那些参与糖代谢调节的组织和细胞,如肌肉、脂肪和胰岛β细胞均有表达。由此推测GDM的发病原因之一是因维生素D缺乏导致孕妇胰岛素抵抗和胰岛素分泌受损。血浆维生素D缺乏具有导致GDM的风险,通过:①维生素D与其受体结合,通过细胞内外钙浓度变化调节β细胞的功能与分泌[4];②维生素D直接刺激细胞膜胰岛素受体表达和葡萄糖转运,从而形成对葡萄糖稳态的影响[5]。胰岛素抵抗是妊娠糖尿病发病的重要环节。研究发现,脂肪因子是造成胰岛素抵抗的重要原因。而维生素D可以抑制前脂肪细胞分化为成熟的脂肪细胞,其作用机制是多方面的,包括对脂肪因子的影响,从而发挥其抗脂肪形成的作用,减少外周组织的胰岛素抵抗[6]。
维生素D通过抑制单核细胞趋化蛋白-1和促进脂肪细胞中脂联素的产生,降低促炎性因子及增加抗炎性因子的表达,从而发挥其在人类肥胖和胰岛素敏感性中的作用[7]。低维生素D水平及低脂联素水平均与肥胖、胰岛素抵抗及心血管疾病相关[8-9]。研究证实,RBP4 mRNA在前脂肪细胞几乎测不到,但在分化过程中增加约1 600倍(P<0.05)。而且,RBP4的分泌仅局限于成熟的脂肪细胞中,进一步表明RBP4与脂肪细胞分泌密切相关[10]。YANG等[11]最早发现了RBP4参与胰岛素抵抗,在小鼠实验中证实RBP4与小鼠胰岛素抵抗密切相关。本研究结果显示,在维生素D缺乏的GDM患者中RBP4与对照组相比明显升高,补充维生素D后RBP4浓度下降,说明维生素D可以通过直接影响胰岛素抵抗,从而间接使RBP4浓度下降,表明RBP4作为脂肪因子,参与了胰岛素抵抗的发生。RBP4影响妊娠糖尿病的关键机制是导致胰岛素抵抗及降低β细胞功能:①RBP4降低磷脂酰肌醇-3激酶的活性和胰岛素受体底物-1的磷酸化[12];②RBP4通过促进磷酸烯醇式丙酮酸激酶(肝葡萄糖糖异生酶),从而促进肝糖原的输出[11];③RBP4的遗传变异与胰岛素抵抗和糖尿病的发生密切相关[13]。TNF的生成与释放与脂联素有关,具有一定的抗炎作用,对妊娠糖尿病有保护作用。TNF-α活性增强可以促进脂肪分解引起血浆游离脂肪酸水平增高,抑制肌肉组织胰岛素受体的酪氨酸激酶的活性,抑制胰岛素受体底物-1的磷酸化和Glut-4的表达,从而导致胰岛素抵抗和高胰岛素血症。维生素D可能在免疫激活和炎症中也发挥了重要的作用。实验证明,TNF-α、白细胞介素-6、维生素D和胰岛素抵抗指数之间有明显的关联[14]。
表3 治疗组与对照组治疗前后血生化指标比较Tab.3 Comparison of biochemical parameters before and after treatment betw een the treatment group and the control group
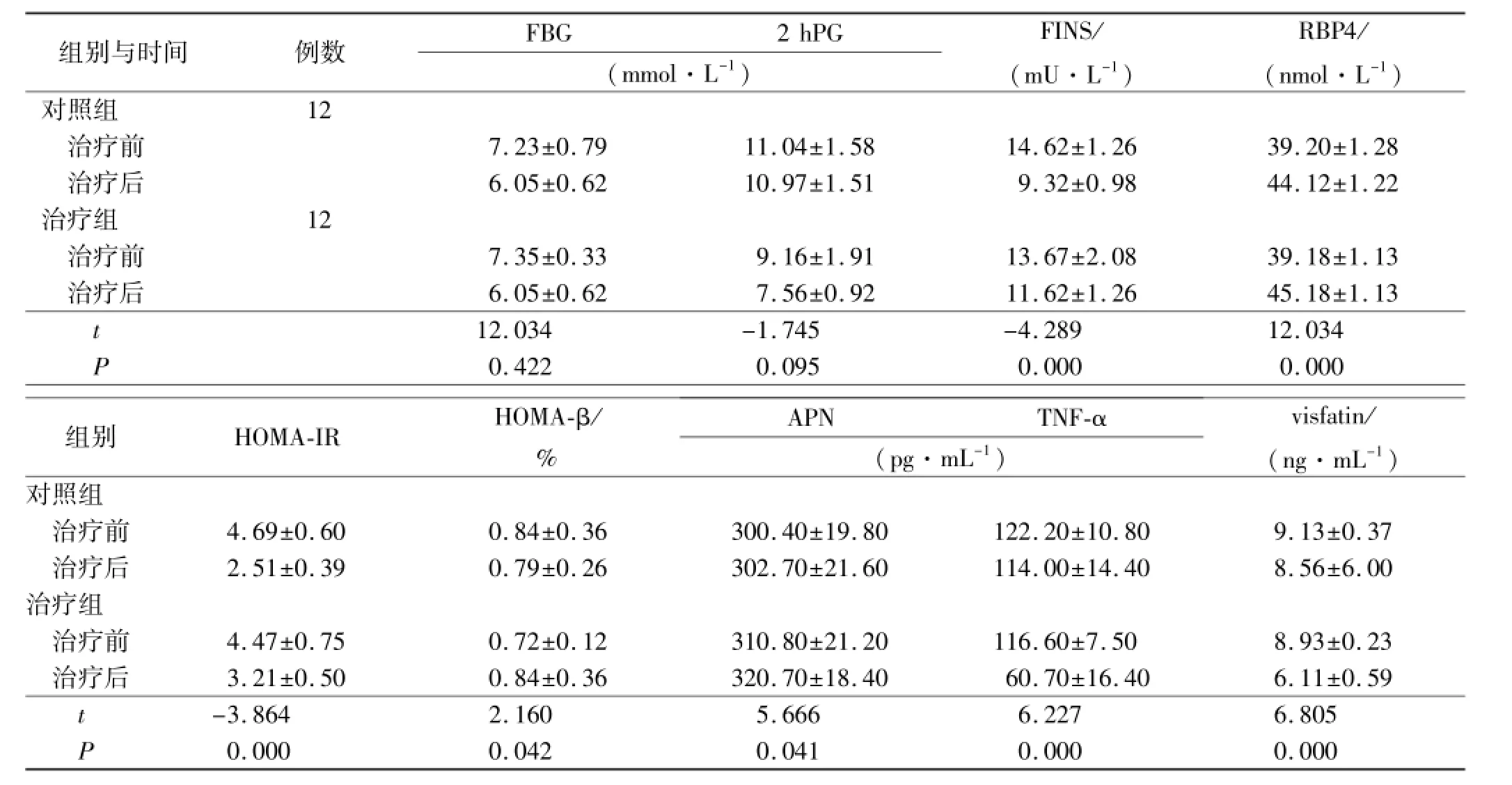
表3 治疗组与对照组治疗前后血生化指标比较Tab.3 Comparison of biochemical parameters before and after treatment betw een the treatment group and the control group
组别与时间例数FBG 2 hPG (mmol·L-1) FINS/ (mU·L-1) RBP4/ (nmol·L-1)对照组12治疗前7.23±0.79 11.04±1.58 14.62±1.26 39.20±1.28治疗后6.05±0.62 10.97±1.51 9.32±0.98 44.12±1.22治疗组12治疗前7.35±0.33 9.16±1.91 13.67±2.08 39.18±1.13治疗后6.05±0.62 7.56±0.92 11.62±1.26 45.18±1.13 t 12.034-1.745-4.289 12.034 P 0.422 0.095 0.000 0.000组别HOMA-IR HOMA-β/ % APN TNF-α (pg·mL-1) visfatin/ (ng·mL-1)对照组治疗前4.69±0.60 0.84±0.36 300.40±19.80 122.20±10.80 9.13±0.37治疗后2.51±0.39 0.79±0.26 302.70±21.60 114.00±14.40 8.56±6.00治疗组治疗前4.47±0.75 0.72±0.12 310.80±21.20 116.60±7.50 8.93±0.23治疗后3.21±0.50 0.84±0.36 320.70±18.40 60.70±16.40 6.11±0.59 t -3.864 2.160 5.666 6.227 6.805 P 0.000 0.042 0.041 0.000 0.000
脂肪组织既是机体的储能器官,又是内分泌器官,其分泌的多种脂肪激素参与及维持人体的能量代谢平衡[15-16]。维生素D作用于GDM患者脂肪因子的机制为:①过氧化物酶增殖物激活受体(peroxisome proliferateraltivated receptor,PPAR)的作用,GDM发病过程中,可能出现脂代谢紊乱,并进一步降低胰岛素敏感性。①25(OH)2D3和维生素D受体能够抑制C/ EBPα(CCAAT)和过氧化物酶受体(γPPARγ),抑制PPARγ,影响脂肪的成熟,从而发挥其抗脂肪形成的作用[17]。直接激活PPAR-δ表达,减少外周组织的胰岛素抵抗[18]。②钙受体的作用:调节脂肪细胞膜钙离子的流动来干扰脂肪因子,发挥对胰岛素敏感的作用。③调节炎症因子的作用:干扰细胞因子基因中的维生素D反应元件或相关转录因子,降低胰岛素抵抗[19-20]。研究证明,除了C/EBPα和PPARγ,1,25 (OH)2D3在抑制细胞外信号调节的激酶(ERK)mRNA的表达和磷酸化中起着重要的作用,是一个重要的脂肪细胞分化抑制剂[21]。
脂肪组织产生和释放的多种促炎和抗炎的因素,包括脂肪因子瘦素、脂联素、抵抗素、内脂素,以及细胞因子和趋化因子,如TNF-α、白细胞介素-6、单核细胞趋化蛋白1等,在胰岛素抵抗和心血管疾病的发生和发展中发挥重要作用[20]。本研究表明,相关脂肪因子及1,25(OH)2D3的水平可以作为胰岛素敏感性的判断指标,并为GDM的治疗提供了新的思路[22]。
[1] ALZAIM M,WOOD R J.Vitamin D and gestational diabetes mellitus[J].Nutr Rev,2013,71(3):158-167.
[2] DING C,GAO D,WILDING J,et al.Vitamin D signalling in adipose tissue[J].Br JNutr,2012,108(11):1915-1923.
[3] MICHAEL F.The D-lightful vitamin D for child health[J]. JParent Enteral Nutr,2012,36(1 Suppl):9-19.
[4] ZHANG C,QIU C,HU F B,et al.Maternal plasma 25-hydroxyvitamin D concentrations and the risk for gestational diabetesmellitus[J].PLoSOne,2008,3(11):e3753.
[5] MICHAEL F.Vitamin D deficiency[J].N Engl JMed, 2007,357(2):266-281.
[6] WOOD R J.Vitamin D and adipegenesis:new molecular insight[J].Nutr Rev,2008,66(1):40-46.
[7] VAIDYA A,WILLIAMS J S,FORMAN J P.The independent association between 25-hydroxyvitamin D and adiponectin and its relation with BMI in two large cohort: the NHS and the HPFS[J].Obesity(Silver Spring),2012, 20(1):186-191.
[8] LORENTE-CEBRIAN S,ERIKSSON A,DUNLOP T,et al. Differential effects of 1a,25-dihydroxycholecalciferol on MCP-1 and adiponectin production in human white adipocytes[J].Eur JNutr,2012,51(3):335-342.
[9] NUNLEE-BLAND G,GAMBHIR K,ABRAMSC,et al.Vitamin D deficiency and insulin resistance in obese African-American adolescents[J].J Pediatr Endocrinol Metab, 2011,24(1-2):29-33.
[10] FRIEBED,NEEFM,ERBSS,etal.Retinol binding protein 4(RBP4)is primarily associated with adipose tissue mass in children[J].Int J Pediatr Obes,2011,6(2-2):345-352.
[11] YANG Q,GRAHAML T E,MODY N,et al.Serum retinol binding protein 4 contributes to insulin resistence in obesity and type 2 diabetes[J].Nature,2005,436(7049):356-362.
[12] KRUGLUGERW,KRZYZANOWSKA K,ZEMANY L,etal. Serum concentrations of retinol binding protein 4 in women with and without gestational diabetes[J].Diabetologia, 2008,51(7):1115-1122.
[13] CRAIG R L,CHUW S,ELBEIN S C.Retinol binding protein 4 as a candidate gene for type 2 diabetes and prediabetic intermediate traits[J].Mol GenetMetab,2007, 90(3):338-344.
[14] BEILFUSS J,BERG V,SNEVE M,et al.Effects of a 1-year supplementation with cholecalciferol on interleukin-6,tumor necrosis factor-alpha and insulin resistence in overweight and obese subjects[J].Cytokine,2012,60(3):870-874.
[15] NTEEBA J,ORTINAU L C,PERFIELD JW 2nd,et al. Diet-induced obesity alters immune cell infiltration and expression of inflammatory cytokine genes in mouse ovarian and peri-ovarian adipose depot tissue[J].Mol Reprod Dev, 2013,80(11):948-958.
[16] AMER P.Insulin resistance in type 2 diabetes role of the adipokines[J].Curr Mol Med,2005,5(2):333.
[17] 罗娜,张真稳,朱妍等.血清25(OH)D3水平与2型糖尿病大血管病变的关系研究[J].南京医科大学学报, 2012,32(7):952-956.
[18] SHEN X,LI H,LIW,et al.Pioglitazone prevents hyperglycemia induced decrease of Adipo R1 and Adipo R2 incoronary arteries and coronary VSMCs[J].Mol Cell Endocrinol,2012,363(1-2):27-35.
[19] FANTUZZIG.Adipose tissue,adipokines,and inflammation [J].JAllergy Clin Immunol,2005,115(5):911-919.
[20] BELLIA A,GARCOVICH C,D’ADAMO M,et al.Serum 25-hydroxyvitamin D levels are inversely associated with systemic in severe obese subjects[J].Intern Emerg Med, 2013,8(1):33-40.
[21] SAKUMA S,FUJISAWA J,SUMIDA M,et al.The involvement ofmitogen-activated protein kinases in the 1a,25-dihydroxy-cholecalciferol-induced inhibition of adipocyte differentiationin vitro[J].JNutr Sci Vitaminol(Tokyo), 2012,58(1):1-8.
[22] CEKMEZ F,AYDEMIR G,AYDINOZ S,et al.Low 25-hydroxyvitamin D level and adiponectin is associatied with insulin sensitivity in large gestational age infants[J]. Cytokine,2012,59(1):156-158.
DOI 10.3870/yydb.2014.05.012
Effects of Vitaimin D on Insulin Sensitivity and the Adipokine Factors,TNF-αin Patients with Gestational Diabetes Mellitus
ZHANG Li-ming,GAO Ling,SHUAI Hong-xia,RUN Yuan-min,DENG Chen-xin,TIAN Yuan,MA Ji,XIAO Jing
(Department of Endocrinology,Hubei University of Arts and Science,Xiangyang 441021,China)
ObjectiveTo investigate the relationship and mechanism of the serum vitamin D levels with insulin sensitivity and adipokines APN,RBP4,visfatin and TNF-αin patients with gestational diabetesmellitus(GDM).MethodsA total of101 patientswith gestational diabetes(GDM group)and 50 pregnantwomen with normal blood sugar(control group)were recruited to detect the serum levels of correlative biochemical indexes,APN,RBP4,visfatin,TNF-αand 25OHD3using an HPLC method.Twenty-four patients in the GDM group diagnosed with vitamin D deficiency(<25 nmol·L-1)were randomized to receive either 1,25(OH)2D3(0.25μg·d-1)orally or no treatment.Serum levels of correlative biochemical indexes were detected after 1 month.ResultsGDM patients had 25OHD3levels significantly lower than the control group(P<0.05),APN levels lower than the control group,and RBP4,visfatin,TNF-αlevels significantly higher than the control group(allP<0.05).After 1 month of 1,25(OH)2D3treatment,HOMA-IR increased,while HOMA-βdecreased.APN levels was positively correlated(r=0.526) with 25OHD3;RBP4,visfatin,TNF-αdecreased and were negatively correlated with 25OHD3(rvalues were-0.272,-0.153, -0.072).ConclusionVitamin D can reduce the adipokines RBP4,visfatin,TNF-α,increase APN,and thus play a protective role for gestational diabetes.
Vitamin D;Diabetes,gestational;Insulin sensitivity;Adiponectin;Visfatin;Retinolbinding protein;Tumor necrosis factor
R977.24;R587.1
A
1004-0781(2014)05-0593-05
2013-04-26
2013-07-03
张黎明(1978-),男,湖北安陆人,主治医师,在读硕士,研究方向:内分泌疾病。电话:(0)15978052318,E-mail:baizhaoshan@163.com。
高凌(1965-),女,湖北襄阳人,主任医师,教授,硕士,研究方向:内分泌疾病。电话:(0)13972253336,E-mail:xfgl856@163.com。

