外泌体致敏树突状细胞体外抗骨肉瘤细胞生长作用*
董革辉,刘福慧,韩建华,夏本杰,黄俊琼
(1.遵义医学院第三附属医院骨科,遵义 563000;2.遵义医学院附属医院输血科,遵义 563003;3.遵义医学院附属医院检验科,遵义 563003)
外泌体致敏树突状细胞体外抗骨肉瘤细胞生长作用*
董革辉1,刘福慧2,韩建华1,夏本杰1,黄俊琼3
(1.遵义医学院第三附属医院骨科,遵义 563000;2.遵义医学院附属医院输血科,遵义 563003;3.遵义医学院附属医院检验科,遵义 563003)
目的 观察骨肉瘤细胞分泌的外泌体体外刺激细胞毒性T细胞对骨肉瘤细胞的杀伤作用。方法采用超滤离心联合蔗糖密度梯度超速离心的方法从骨肉瘤细胞培养上清液中分离外泌体(Texo)。透射电子显微镜鉴定Texo形态,western blot分析Texo表面主要组织相容性复合体-玉(MHC-玉)类分子表达。分离培养小鼠骨髓来源树突状细胞(DC),流式细胞仪鉴定细胞表型。噻唑蓝(MTT)法检测负载Texo的DC刺激T淋巴细胞增殖情况及效应淋巴细胞对骨肉瘤细胞的杀伤作用。结果透射电镜下见Texo为圆形或类圆形小体,大小不等,平均直径50~100 nm;Texo表面有MHC-玉类分子表达。骨髓来源DC边缘有绒毛样突起,呈典型的树突状细胞形态,经脂多糖诱导后DC的CD80、MHC-玉、MHC-Ⅱ类分子表达明显高于未经诱导的DC,阳性率分别为77.16%,83.21%,91.26%。负载Texo的DC刺激T细胞增殖能力及T细胞对靶细胞的杀伤效应明显强于未负载Texo的DC与Texo(P<0.05)。结论负载Texo的DC能促进T细胞增殖,可体外诱导细胞毒性T细胞应答抑制骨肉瘤细胞生长。
外泌体;骨肉瘤;树突状细胞;T细胞;抑制作用
外泌体是由细胞分泌到细胞外的膜性小囊泡,直径30~100 nm,具有双层脂质结构,携带大量与其来源和功能密切相关的膜性分子。淋巴细胞、树突状细胞(dentritic cell,DC)、肿瘤细胞等均可分泌外泌体。肿瘤细胞分泌到细胞外的外泌体(tumor-derived exosome,Texo)富含肿瘤相关抗原、主要组织相容性复合体(major histocompatibility complex,MHC)分子、共刺激分子,可诱导抗肿瘤细胞毒性T细胞(cytotoxic T lyphocyte,CTL)应答[1]。Texo作为肿瘤疫苗,在实验性免疫治疗中取得了显著效果,笔者尚未见其应用于骨肉瘤免疫治疗的报道。笔者从骨肉瘤细胞分离Texo,体外刺激树突状细胞,探讨Texo致敏TC诱导CTL对骨肉瘤细胞的生长抑制作用,以期为骨肉瘤的免疫治疗提供实验依据。
1 材料与方法
1.1 实验动物与细胞 雌性Balb/c小鼠,6~8周龄,体质量20~22 g,洁净度:SPF级,购自第三军医大学实验动物中心,生产许可证号:SCX(渝)2012-0001,实验许可证号:SYXK(黔)2011-003。小鼠骨肉瘤细胞K7M2购自汉恒生物科技有限公司(批号:20111219)。
1.2 试剂与仪器 细胞培养液RPMI1640购自Hyclone公司,胎牛血清(fetal bovine serum,FBS)购自Gibco公司,鼠MHC-玉单克隆抗体购自Senta Cruz公司,辣根过氧化物酶标记羊抗鼠二抗购自Sigma公司, 100 kD Amicon Ultra-15离心超滤管购自美国Millipore公司,超速离心管购自美国Beckman公司,增强化学发光(enhanced chemiluminescence,ECL)试剂盒(批号:20120123)、蛋白预染Marker购自碧云天生物技术研究所。
1.3 Texo的分离与纯化 将K7M2细胞用含10%胎牛血清的RPMI1640培养液于37℃、5%二氧化碳条件下培养,隔天换液,待单层细胞生长达到80%融合时,用胰蛋白酶消化细胞,进行传代。选取对数生长期细胞,收集细胞培养上清液200~500 mL,4℃、300×g离心10 min,取上清液于4℃、800×g离心30 min,再取上清液4℃、10 000×g离心30 min,吸取上清液加入100 kD Amicon Ultra-15离心超滤管,4℃、1 500×g离心30 min,至浓缩液体积<8 mL;将浓缩液、30 g·L-1蔗糖/重水垫和磷酸盐缓冲液(phosphate buffered solution,PBS) (0.01 mol·L-1)以3∶3∶4的比例依次加入Beckman专用离心管,4℃、100 000×g超速离心60 min,取出承载Texo的蔗糖/重水垫,用PBS50倍体积稀释,再经100 000×g超速离心60 min,得到的沉淀即为Texo。取适量PBS重悬,孔径0.22 μm滤膜过滤除菌,分装, -80℃保存。
1.4 透射电镜观察Texo形态特征 取Texo重悬液10 μL滴于载样铜网上,室温静置1 min,用滤纸从侧面吸干液体,滴加20 g·L-1磷钨酸溶液(pH6.8)约30 μL于铜网上,室温负染1 min,吸干负染液,白炽灯下烤干,透射电子显微镜(日立高新技术国际贸易有限公司生产,H-7650型)观察Texo形态。
1.5 Western blot分析MHC-Ⅰ类分子表达 以体外培养的骨肉瘤细胞作为对照,调整细胞浓度为1× 1011·L-1,于-20℃反复快速冻融4次后,1 000×g离心30 min,上清液即为细胞裂解物。取Texo 40 μg及骨肉瘤细胞裂解物40 μg,分别加入适量电泳上样缓冲液,在12%聚丙烯酰胺凝胶上进行电泳分离,用半干电转仪将蛋白质转移至醋酸纤维膜上,室温用5%脱脂奶粉包被2 h后,加入一抗(1∶400)4℃过夜, PBS洗涤3次,加入辣根过氧化物酶标记的二抗(1∶5 000),37℃孵育30 min,加入发光试剂室温放置1 min,PBS洗涤3次,暗室曝光显影。
1.6 小鼠骨髓来源DC的培养 CO2窒息法处死小鼠,无菌条件下取小鼠股骨、胫骨,PBS冲洗骨髓至髓腔变白,收集冲洗液,1 500×g离心5 min,收集细胞用PBS洗2次。三羟甲基氨基甲烷-氯化氨红细胞裂解液(Tris-NH4Cl)裂解红细胞,用含20 μg·L-1粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、1 μg·L-1白细胞介素4 (interlukin 4,IL-4)的DMEM培养基重悬细胞至2× 109·L-1,按每孔4 mL加入24孔板,置37℃、5%CO2培养箱中培养。第3天更换培养液,轻轻晃动培养板,弃去上清液,补入含细胞因子的DMEM完全培养液。第6天细胞换液,用含20 μg·L-1GM-CSF、1 μg·L-1IL-4和15 μg·L-1肿瘤坏死因子(tumor necrosis factor,TNF)的DMEM培养液重悬细胞,继续培养24 h后收集细胞,换无血清的AIM-V培养基,加入10 μg·mL-1脂多糖(lipopolysaccharide,LPS),置37℃、5%CO2培养箱中培养过夜,次日收集细胞进行表型鉴定。
1.7 T淋巴细胞增殖实验 CO2窒息法处死Balb/c小鼠,无菌分离脾脏,经200目钢网研磨制成单个细胞悬液,PBS洗2次,用RPMI 1640培养液重悬细胞,加入尼龙毛柱中,常规培养1 h,收集流出的T淋巴细胞。将DC与T淋巴细胞(T)按1∶3比例混合培养。实验分为4组,A组:Texo-DC+T;B组:DC+T;C组:Texo (10 μg·mL-1)+T;D组:T(对照组)。将上述各组细胞加入96孔培养板,每孔100 μL,每组设复孔3个,将培养板置于37℃、5%CO2培养箱中培养3 d后,每孔加入噻唑蓝(methylthiazolyldiphenyl-tetrazoliumbromide, MTT)溶液(5 mg·mL-1)20 μL,继续于培养箱中孵育4 h,每孔再加入二甲基亚砜(dimethyl sulfoxide,DMSO) 150 μL,震荡混匀,酶标仪(北京普朗新技术有限公司生产,型号:DNM-9600G)于波长570 nm测定吸光度(A)值。按下列公式计算刺激指数(stimulating index,SI), SI=实验组平均A值/对照组平均A值。
1.8 细胞毒性实验 设实验组、效应细胞对照组、DC对照组及靶细胞对照组,实验组为Texo-DC+T,T淋巴细胞为效应细胞,实验组按效靶比12.5∶1,25∶1,50∶1,加入已铺好骨肉瘤细胞的96孔培养板,每孔100 μL,每组设复孔3个。于37℃、5%CO2培养箱中培养48 h,加入5 mg·mL-1MTT溶液20 μL,继续培养4 h后加入DMSO150 μL,于波长570 nm测定A值,计算杀伤率。杀伤率(%)=[靶细胞对照组A值-(实验组A值-效应细胞对照组A值)]/靶细胞对照组A值×100%。
2 结果
2.1 Texo的分离鉴定 细胞培养上清液经300×g,800 ×g,10 000×g梯度离心后,管内可见体积大小不等的沉淀物,去沉淀物后上清液经超滤离心管100 000×g离心浓缩60 min,离心管底见块状黄白色沉淀。吸取蔗糖/重水垫,PBS稀释后再经100 000×g离心60 min,离心管底可见少量黄白色沉淀,该沉淀即为Texo。电子显微镜观察见Texo呈圆形或类圆形,大小不等,平均直径50~100 nm,散在分布或聚集成团(图1)。Texo和细胞裂解物均表达MHC-玉类分子,肿瘤细胞来源的Texo MHC-玉灰度值较肿瘤细胞裂解物高(图2)。
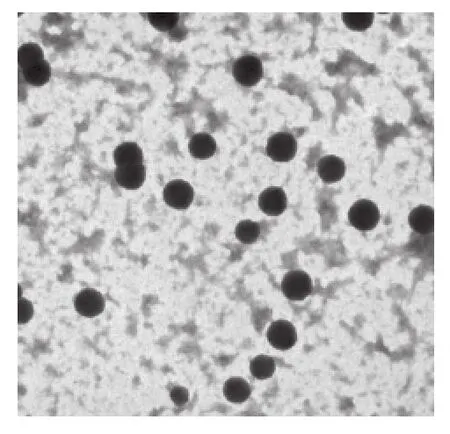
图1 K7M2细胞分泌的Texo电镜图(×50 000)Fig.1 Electron microscope results of exosome purified fromM7K2 cell(×50 000)

图2 Texo的Western blot分析结果Fig.2 Western blot analysis on MHC-1 expression
2.2 DC表型分析 高倍镜下可见部分细胞表面有2或3个毛刺样突起。培养第7天加入LPS 24 h后(即第8天),细胞全部脱壁,呈悬浮生长,细胞边缘有突起2~5个,呈星形,为典型的树突状细胞形态。未经LPS诱导的DC表面CD80、MHC-玉类分子、MHC-Ⅱ类分子表达较低,阳性率分别为42.53%,54.96%, 33.44%;经LPS诱导后的DC表面分子的表达较未经LPS诱导的DC明显增高,阳性率分别为77.16%, 83.21%,91.26%,为成熟的DC(图3)。

图3 流式细胞仪分析DC表面标志Fig.3 FCManalysis on surface marker of DC
2.3 Texo致敏DC刺激T淋巴细胞增殖 Texo-DC+T组、DC+T组和Texo+T组对T淋巴细胞的SI分别为(1.51±0.25)(0.76±0.06)(1.15±0.08)。Texo组SI<1,说明没有刺激T细胞活化的能力;负载Texo的Texo-DC组和未负载Texo的DC组均>1,说明有刺激T细胞活化的能力;负载Texo的DC与未负载Texo的DC相比,刺激T细胞活化的能力明显增强(P<0.05)。
2.4 Texo致敏DC诱导CTL的特异性杀伤作用 负载Texo的DC在效靶比为12.5∶1时,其抗肿瘤活性与未负载Texo的DC、Texo、T细胞对照组相比,差异无统计学意义;在效靶比25∶1,50∶1时,负载Texo的DC诱导CTL抗肿瘤活性明显高于其他3组,差异有统计学意义(P<0.05),见图4。
3 讨论
骨肉瘤是一种来源于间叶组织的恶性肿瘤,易转移,手术治疗5年生存率较低,目前多采用手术切除联合化学治疗(化疗),但抗癌药物常常导致骨髓抑制、肝功能损害等严重不良反应[2]。对于那些化疗药物耐药或无法忍受化疗药物不良反应的患者,骨肉瘤的治疗束手无策,因而需要研发新的治疗策略。肿瘤患者肿瘤细胞表面MHC-玉类分子表达减少或缺失,导致抗原呈递功能障碍,从而影响肿瘤特异性的CTL活化和抗肿瘤效应,患者抗肿瘤免疫功能低下。Texo作为新型亚细胞肿瘤疫苗,是近年来疫苗研究的热点。Texo是由活细胞分泌的膜性微囊结构,其功能根据细胞来源的不同而不同[3-5]。目前研究得较多的是DC来源的Texo和肿瘤细胞来源的Texo。Texo含有MHC-玉类分子、四跨膜蛋白、肿瘤相关抗原等[6-7],被树突状细胞摄取后,可激活T淋巴细胞,发挥抗肿瘤免疫效应[8-9]。

图4 Texo致敏DC诱导特异性CTL活性Fig.4 Activity of CTL induced by Texo-pulsed DC
笔者在本实验中采用超滤离心联合蔗糖密度梯度超速离心的方法从骨肉瘤细胞提取Texo,电镜下见骨肉瘤细胞分泌的Texo呈圆形或类圆形,平均直径50~100 nm,表面有MHC-玉类分子表达,与文献报道一致。小鼠骨髓来源的DC经LPS诱导成熟后,采用Texo进行刺激,观察Texo致敏DC对T细胞的活化增殖效应及活化T细胞对骨肉瘤细胞的杀伤效应,探讨Texo的抗肿瘤作用。结果显示,单独Texo不能刺激T淋巴细胞增殖,负载Texo的DC和未负载Texo的DC均能刺激T细胞增殖,负载Texo的DC刺激T细胞活化的能力较未负载Texo的DC强。细胞毒性实验中,负载Texo的DC在高浓度时有较强的杀瘤作用。未负载Texo的DC、Texo与效应细胞对照组相比,无明显抑瘤作用。以上结果表明,Texo致敏DC可诱导T细胞活化,活化后的CTL发挥抗肿瘤作用抑制骨肉瘤细胞生长。Texo虽然含有MHC-玉类分子和肿瘤抗原,但不能直接诱导CTL反应,T细胞的活化除了需要肿瘤抗原及MHC分子刺激外,还需要DC等抗原提呈细胞提供共刺激信号,只有当其负载到DC上时,才能高效诱导CTL发挥抗肿瘤作用。
本研究成功地从骨肉瘤细胞分离了Texo,并证实了骨肉瘤细胞来源的Texo可诱导CTL反应,增强抗肿瘤免疫效应,为骨肉瘤的免疫治疗提供依据。
[1] TAURO B J,GREENING D W,MATHIAS R A,et al.Two distinct populations of exosomes are released fromLIM1863 colon carcinomacell-derivedorganoids[J].MolCell Proteomics,2013,12(3):587-598.
[2] 陆华,程道海,张赞.大剂量甲氨蝶呤治疗骨肉瘤29例[J].医药导报,2012,31(11):1451-1453.
[3] WAHLGREN J,KARLON TDE L,GLADER P,et al.Activated human T cells secrete exosomes that participate in IL-2 mediated immune response signaling[J].PLoS One,2012,7 (11):e49723.
[4] KING H W,MICHAEL MZ,GLEADLE J M.Hypoxic enchanement of exosome release by breast cancer cells[J]. BMC Cancer,2012,12:421.
[5] MARLEAU A M,CHEN C S,JOYCE J A,et al.Exosome removal as a therapeutic adjuvant in cancer[J].J Transl Med,2012,10:134.
[6] HAYOUN D,KAPP T,EDRI-BRAMI M,et al.HSP60 is transported through the secretory pathway of 3-MCA-induced fibrosarcoma tumour cells and undergoes N-glycosylation [J].FEBS J,2012,279(12):2083-2095.
[7] HEGMANS J P,BARD MP,HEMMES A,et al.Proteomic analysis of exosomes secreted by human mesothelioma cells [J].AmJ Pathol,2004,164(5):1807-1815.
[8] MARTON A,VIZLER C,KUSZ E,et al.Melanoma cell-derived exosomes alter macrophage and dendritic cell functions in vitro[J].Immunol Lett,2012,148(1):34-38.
[9] BU N,WU H,SUN B,et al.Exosome-loaded dendritic cells elicit tumor-specificcytotoxic T cells in patients with glioma[J].J Neurooncol,2011,104(3):659-667.
DOI 10.3870/yydb.2014.07.009
Texo-pulsed Dendritic Cells Inhibited the Growth of Osteosarcoma Cells by Stimulating CTL Response in Vitro
DONG Ge-hui1,LIU Fu-hui2,HAN Jian-hua1,XIA Ben-jie1,HUANG Jun-qiong3
(1.Department of Orthopeadics,the Third Affiliated Hospital of Zunyi Medical College,Zunyi 563000,China;2.Department of Blood Transfusion,Affiliated Hospital of Zunyi Medical College,Zunyi 563003,China;3.Clinical Laboratory, Affiliated Hospital of Zunyi Medical College,Zunyi 563003,China)
ObjectiveTo investigate the stimulation of exosome derived fromosteosarcoma cells suppressing cytotoxic T cells and the inhibitory effect of active T cells for surpressing osteosarcoma cells.MethodsExosome derived fromtumor cells was isolated and purified by ultracentrifugation.Its morphology was observed with transmission electron microscope,and the major histocompatibility complex-I(MHC-I)molecules were analyzed by western blot.Mice bone marrow-derived dendritic cells were pulsed with exosome.Surface membrane MHC-I molecules were analyzed with flowcytometry.The effect of active T cells on the growth of osteosarcoma cells were detected by MTT assay after the T cells being stimulated by exosome-pulsed dendritic cells.ResultsThe exosome was round or near round corpuscle,and the diameter was about 50-100 nmby transmission electron microscope.The size was relatively homogeneous.Western blot showed that the exosome expressed MHC-玉molecules.Surface membrane CD80,MHC-I and II molecules were expressed on 77.16%,83.21%,and 91.26%of LPS-treated dendritic cells, respectively,which were up-regulated compared to untreated cells.Dendritic cells pulsed with exosome derived fromosteosarcoma cells caused significantly higher T cells stimulation and osteosarcoma cells inhibition as compared to un-pulsed dendritic cells.(P<0.05).ConclusionT cells can inhibit the growth of osteosarcoma cells after being stimulated by exosome-pulsed dendritic cellsin vitro.
Exosome;Osteosarcoma;Dendritic cells;T cells;Inhibition
R979.6;R965
A
1004-0781(2014)07-0874-04
2013-09-01
2013-10-11
*遵义市科技计划项目(遵市科合社字[2008] 4号)
董革辉(1968-),男,贵州遵义人,副主任医师,学士,主要从事骨肿瘤的研究。电话:0852-8925271,E-mail: 1468195302@qq.com。

