孕马尿中雌酮硫酸钠单克隆抗体的研制*
阿曼古力·托洪尔别克,冯晓辉,巩月红,齐新伟,阿尔孜古丽·吐尔逊,高晓黎
(新疆医科大学 1.药学院;2.第一附属医院临床医学研究院,乌鲁木齐 830054)
孕马尿中雌酮硫酸钠单克隆抗体的研制*
阿曼古力·托洪尔别克1,冯晓辉2,巩月红2,齐新伟2,阿尔孜古丽·吐尔逊2,高晓黎1
(新疆医科大学 1.药学院;2.第一附属医院临床医学研究院,乌鲁木齐 830054)
目的 建立雌酮硫酸钠(ESS)单克隆抗体的制备方法。方法以ESS为抗原免疫Balb/c小鼠,筛选小鼠免疫方法,并通过方阵滴定法确定间接酶联免疫吸附测定(ELISA)方法;再以杂交瘤抗体技术获得抗ESS单克隆抗体细胞株。结果ESS抗原5次以初次免疫200 μg,加强免疫100 μg的免疫剂量多点注射小鼠背部皮下免疫为小鼠最佳免疫方法;确定10 μg·L-1为抗原包被浓度,1∶2 000的一抗血清稀释倍数;细胞融合率达90.2%,ELISA法筛选阳性率为4.4%,并筛选得到两株特异性较好的细胞株2C8和8A7。结论该研究筛选建立了ESS小鼠免疫方法及灵敏度高、特异性好的间接ELISA筛选体系,可用于ESS单克隆抗体的制备及检测,且建立了ESS单克隆抗体制备方法。
雌酮硫酸钠;单克隆抗体;测定法,酶联免疫吸附;杂交瘤细胞
雌酮硫酸钠(sodium estrone sulfate,ESS)是甾体激素类化合物中雌性激素的一种,为孕马尿中的一种天然结合雌激素。结合雌激素在临床上主要用于雌激素替代疗法,通过缓解因雌激素不足引起的临床症状来治疗和预防女性生理或人工绝经后出现的更年期综合征、骨质疏松症[1]、冠心病[2]以及老年性痴呆症[3]。孕马尿中富含雌激素[4-6],每升孕马尿中雌激素的平均含量在70~130 mg,可以充分利用孕马尿来提取天然雌激素。但是在大规模采集孕马尿生产结合雌激素的产业化过程中急需一种快速地检测和有效控制孕马尿质量的方法。ESS作为孕马尿中主要结合雌激素,可应用纯化的ESS作为抗原与牛血清清蛋白偶联制备完全抗原免疫Balb/c小鼠后,制备分泌特异性抗ESS的单克隆抗体(monoclonal antibody,McAb)[7],再利用ESS单克隆抗体可以建立一种快速、灵敏、特异的检测孕马尿中ESS的方法,用于孕马尿中结合雌激素含量的快速检测,将有重要的应用价值。
1 材料与方法
1.1 动物 6~8周龄雌性Balb/c小鼠,购自新疆医科大学实验动物中心。SPF级;动物许可证号:SCXK (新)2011-0004。
1.2 试药 雌酮硫酸钠免疫用完全抗原[雌酮硫酸钠-牛血清清蛋白(sodium estrone sulfate-bovine serum albumin,ESS-BSA)]:由本课题组合成提供;雌酮硫酸钠包被抗原[(雌酮硫酸钠-卵清蛋白(sodium estrone sulfate-ovalbumin,ESS-OVA)]:由本课题组合成提供;牛血清清蛋白:美国BBI公司;卵清蛋白:Sigma分装;达尔伯克改良必需基本培养基(Dulbecco's modified minimal essential medium,DMEM)粉剂:美国GIBCO公司;胎牛血清:美国GIBCO公司;L-谷氨酰胺:上海生工生物工程股份有限公司;聚乙二醇1450(polyethlene glycol1450,PEG1450):美国Sigma公司;8-氮鸟嘌呤:美国Sigma公司;酶稳定剂:连云港贝尔化学试剂有限公司;四甲基联苯胺(tetramethyl benzidin,TMB ):美国BBI公司;二甲亚砜(dimethyl sulfoxide,DMSO):上海生工生物工程股份有限公司;弗氏完全佐剂、弗氏不完全佐剂:美国Sigma公司;辣根过氧化物酶-山羊抗小鼠IgG抗体:美国Sigma公司;次黄嘌呤、氨蝶呤与胸苷培养基(hypoxanthine,aminopterin and thymidine,HAT):美国Sigma公司;次黄嘌呤和胸苷培养基(hypoxanthine and thymidine,HT):美国Sigma公司。
1.3 仪器 AE250型分析天平(梅特勒-托利仪器有限公司);二氧化碳(CO2)恒温培养箱(Thermo公司);倒置显微镜(Thermo公司);X-mark型酶标仪(BIORAD公司);KDC-220HR高速冷冻离心机(科大创新股份有限公司中佳分公司);DHP-9160B电热恒温干燥箱(上海琅玕实验设备有限公司)。
1.4 细胞 骨髓瘤细胞(SP2/0细胞),购自上海细胞库。
1.5 小鼠免疫方法 选择健康的6~8周龄的雌性Balb/c小鼠12只。免疫前尾静脉采血,作为阴性对照血清。初次免疫分别将100和200 μg的ESS-BSA免疫抗原与等量的弗式完全佐剂混合,完全乳化后,分别采用背部皮下多点注射或腹腔注射(每只0.2 mL);20 d后分别用50和100 μg的ESS-BSA免疫抗原与弗式不完全佐剂混合后同法进行第2次免疫。以后每10 d免疫1次,3次免疫第4天血后采血,检测血清效价。
1.6 间接非竞争酶联免疫吸附检测法(enzyme-linked immuno-sorbent assay,ELISA)的建立及检测
1.6.1 包被抗原使用浓度的确定 包被抗原ESSOVA使用浓度的确定采用方阵滴定法,用系列浓度(1,5,10,15 μg·mL-1)的包被抗原包被96孔酶标板,将抗血清做倍比稀释(1∶500,1∶1 000,1∶2 000, 1∶4 000,1∶8 000,1∶16 000),采用间接非竞争ELISA法测定包被抗原的最佳使用浓度。检测结果以抗体稀释度对吸光度(A阳性-A阴性)作图选择A值差值较高者所对应的包被浓度为最佳包被浓度[8-11]。
1.6.2 免疫方法和免疫剂量对免疫效价的影响 采用间接ELISA经免疫的12只小鼠多抗血清效价。包被原浓度为10 μg·mL-1。抗血清效价的结果判定方法用酶联免疫检测仪记波长450 nm读数。一抗为3免后抗血清稀释2 000倍。以空白小鼠血清作为阴性对照,每个样品设定两个平行[8-11]。
1.6.3 免疫次数对免疫效价的影响 每次免疫后第4天眼眶采血,分别测定两只小鼠的3免、4免、5免、6免抗血清效价[8-11]。
1.7 细胞融合及阳性克隆的筛选 用乳化完全的ESS-BSA以所筛选出的免疫方法免疫的Balb/c小鼠6只,用间接ELISA法以ESS-OVA作为包被抗原测定小鼠血清抗体效价,血清达到1∶10 000以上时,即可进行细胞融合。融合前3 d用未乳化的ESS-BSA对效价最高的Balb/c小鼠进行冲击免疫。
1.7.1 饲养细胞,SP2/0细胞,免疫小鼠脾细胞的准备 在融合前一天,取Balb/c小鼠腹腔巨噬细胞,并悬于HAT选择培养基里,每孔100 μL铺置饲养细胞于96孔细胞培养板中,每孔细胞约105个,置于37℃,含5%CO2培养箱里;SP2/0细胞复苏并培养至对数生长期,供融合用;融合当天处死经冲击免疫的小鼠,制备脾细胞悬液用于融合。
1.7.2 细胞融合及培养 分别吸取含脾细胞1×108个和SP2/0细胞悬液2×107~3×107个,加入到离心管,补加不完全培养液至40mL,充分混匀。以1 000 r·min-1,离心7 min,弃去上清液。轻轻弹动离心管管底,使沉淀细胞均匀松散至糊状。于37℃水浴中,一手均匀地转动离心管,另一手用吸管吸取预热至37℃,50%的PEG1450溶液0.8 mL,沿转动的管壁加入,加入PEG1450的时间控制在60 s,静置30 s。在5 min内加入不完全培养液25 mL,使PEG1450稀释而失去促融合作用。800 r·min-1,离心7 min后弃上清液。加入适量HAT培养液,轻轻吹吸沉淀细胞,使其悬浮并混匀。将细胞悬液加入已铺有饲养细胞层的96孔培养板中,每孔0.1 mL,并置于37℃,含5%CO2的培养箱内培养。融合培养24 h后,每隔24 h观察1次。培养至6 d,先弃掉培养孔1/2的上清液,加入与弃掉的培养上清液等量(约100 μL)的含HAT的完全培养液。7~10 d后用HT培养基换出HAT培养基。待其长至孔底面积1/10以上时吸出上清液供抗体检测[12-15]。
1.7.3 阳性杂交瘤细胞的筛选 融合12 d后,酶标板包被ESS-OVA,测定有杂交瘤生长孔细胞上清液。检测到有阳性杂交瘤生长的孔,再用有限稀释法将强阳性的杂交瘤细胞进行克隆化,直到找到稳定分泌抗ESS抗体的细胞单克隆[13,16-18]。
2 结果
2.1 包被抗原使用浓度的确定 由表1可见,随着抗血清稀释倍数的增加,板孔溶液的A值减小。取A值最接近1.0的孔为ELISA最佳包被浓度,根据测定结果在包被原10 μg·mL-1,抗血清1∶2 000时的A值接近1.0,故选择10 μg·mL-1为最佳包被浓度。
2.2 免疫方法及免疫剂量对免疫效价的影响 4种不同处理方式分别为:①200/100 μg免疫剂量腹腔注射(每只100 μg为首次免疫剂量,每只50 μg为加强免疫剂量);②200/100 μg免疫剂量背部皮下多点注射(每只200 μg是首次免疫剂量,每只100 μg是加强免疫剂量);③100/50 μg免疫剂量的腹腔注射(每只100 μg是首次免疫剂量,每只50 μg是加强免疫剂量);④100/ 50 μg免疫剂量的背部皮下多点注射(每只200 μg是首次免疫剂量,每只100 μg是加强免疫剂量)。结果显示,背部皮下多点注射比腹腔注射的免疫效价高;免疫剂量的提高也能引起较高的免疫效价。
2.3 免疫次数对免疫效价的影响 由表2可以看出, 2,3,4次免疫的效价数据有增高,5次免疫效价跟4次免疫相当,6次免疫效价有降低趋势。故进行5次免疫为恰当。
2.4 细胞融合及阳性杂交瘤筛选结果
2.4.1 各免疫小鼠效价测定 经所筛选的ESS-BSA免疫小鼠方法免疫的Balb/c小鼠6只抗血清效价均在12 800以上(表3)。其中4号小鼠效价最低,为12 800;其余5只小鼠效价均51 200以上,说明免疫效果较好,可进行细胞融合。

表1 方阵滴定法确定包被原工作浓度的吸光度Tab.1 Absorbance of working concentration on coating antigen by ELISA chess-board assay

表2 免疫次数对免疫效价吸光度的影响Tab.2 Effects of absorbance of immunity times on antiserum titer

表3 各免疫小鼠经ESS-BSA免疫后抗血清效价Tab.3 Antibody titers in the serum of mice immunized with ESS-BSA
2.4.2 细胞融合 图1为复苏后处于对数生长期的SP2/0细胞。由图2可看出,失败的融合实验所有细胞遮光性差,而成功的融合实验能看到大又亮的细胞存在。

图1 复苏后的SP2/0细胞(×40)Fig.1 SP2/0 cells after recovering from freezing(×40)
2.4.3 杂交瘤细胞的选择性培养 图3为细胞融合后观察各孔于HAT选择性培养基中培养2,3,4,7 d后的杂交瘤生长情况。可看出除了杂交瘤细胞,其他细胞都会逐渐凋亡,杂交瘤细胞会逐渐长成集落,集落逐渐变大。
2.4.4 采用ELISA法筛选阳性杂交瘤细胞 表4为融合10 d后,根据观察记录杂交瘤生长情况及阳性杂交瘤检测结果所统计的表格。本实验用50%的 PEG1450作融合剂,融合效率较高,融合率90.25%,阳性率4.4%。

图2 融合0 h,成功的融合实验(A)和失败的融合实验(B)对比图谱(×40)Fig.2 Comparison of successful(A)and failed(B)cell fusion 0 h after fusion(×40)
细胞融合第10天,对有杂交瘤生长的细胞上清进行ELISA检测,筛选出杂交瘤生长数较少(尽量挑单个杂交瘤克隆孔),并且A值1.5以上的34个孔及A值。根据每孔杂交瘤集落生长情况和ELISA检测结果,挑取A值大于1.5且杂交瘤集落数较少的阳性孔4个(1E5,2C8,5G6,8D3)和单个杂交瘤细胞生长阳性孔3个(3G9,4F2,8A7)。采用有限稀释法进行亚克隆。计数,根据细胞数目确定亚克隆铺板孔数目。
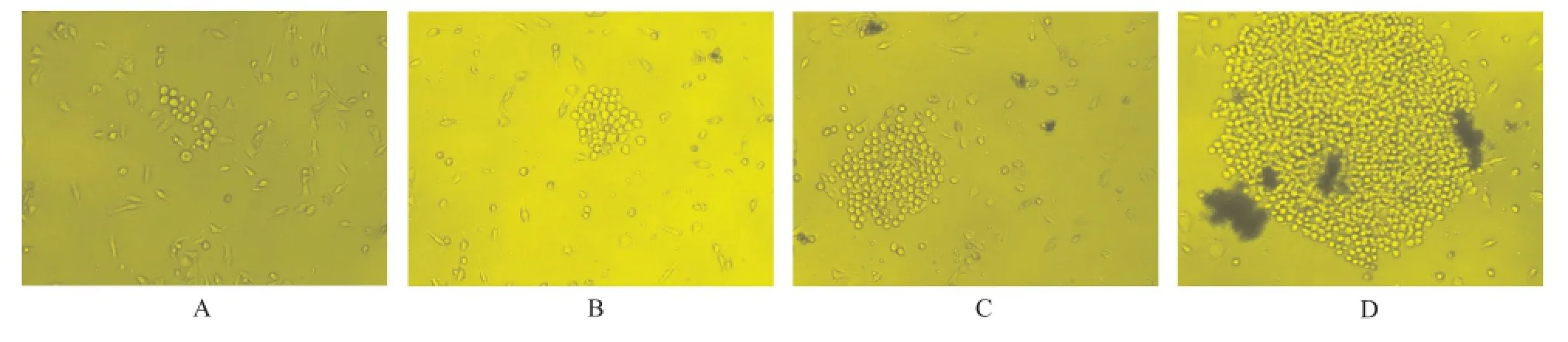
A.2 d;B.3 d;C.4 d;D.7 d图3 融合2,3,4,7 d后的杂交瘤细胞生长情况(×40)A.2 d;B.3 d;C.4 d;D.7 dFig.3 Growth of hybridoma cells at 2,3,4,7 d after cell fusion(×40)
2.4.5 阳性杂交瘤细胞克隆化 表5为亚克隆阳性率统计结果,最终得到三株克隆株,分别为2C8,5G6, 8A7。再对较稳定的2C8,8A7细胞株进行第4次亚克隆,得到了两株稳定分泌ESS单克隆抗体的杂交瘤细胞株。

表4 细胞融合率及阳性率结果Tab.4 Results of the fusion rates and positive rates

表5 亚克隆阳性孔率结果Tab.5 Results of positive rates after cloning %
3 讨论
单克隆抗体制备技术,试验周期较长,技术繁琐,需要科研工作的连续性,因此得到一能够稳定分泌高效价、高特异性的单克隆抗体的杂交瘤细胞株是较复杂艰巨的工程。免疫程序、免疫途径、免疫剂量、免疫周期等对机体免疫应答及其抗体效价和亲和性有重要的影响[19]。免疫效价的考察需要建立稳定有效的ELISA法等检测方法。在研制ESS单抗的过程中发现免疫原的制备,免疫原与佐剂乳化程度对免疫效果及后续的杂交瘤制备都起着重要的作用。本课题所采用的将一注射器(规格5 mL)用长约3 cm的塑料细管(一次性输液管剪一截)与另一相同规格的注射器连接,反复地均匀用力推拉两个注射器约1 h的方法为操作简便,可有效节省抗原和佐剂,并可将抗原与佐剂乳化完全。此外,融合操作技术对融合效率的影响大。应把握好PEG1450的滴加速度和用基础培养基终止融合实验的速度,每一步需严格计时。杂交瘤细胞选择性培养时,应避免细胞污染,定期查培养箱的CO2浓度及培养箱湿度。细胞上清液变黄时,应及时换培养液。培养板应逐个进行换液。由于杂交瘤生长至一定面积后需进行杂交瘤阳性筛选,因此在杂交瘤筛选实验前应建立好稳定的检测方法。应进行多次阳筛,以避免假阳性及漏筛等情况。
甾体激素类化合物中的一种雌性激素,其作为孕马尿中结合雌激素主要成分,可从孕马尿中提取ESS供其补充制剂的研发。作为雌激素原料的孕马尿收集是该项研发首要且关键的步骤,而合格孕马尿的采集则需要一检测手段。孕马尿雌激素单克隆抗体可运用胶体金层析技术等免疫检测手段开发成快速,操作简便,低成本,可应用于野外操作的雌激素检测方法。雌激素单克隆抗体的研发有广阔的应用前景。
[1] LINDSAY R,GALLAGHER J C,KLEEREKOPER M,et al. Bone response to treatment with lower doses of conjugated estrogens with and without medroxyprogesterone acetate inearly postmenopausal women[J].Osteoporosis Int,2005,16 (4):372-379.
[2] RICKY Y K,LILY T K F,FAN S,et al.Effect of postmenopausal hormone replacement therapy on lipoprotein and homocysteine levels in Chinese women[J].Mol Cel Biochem,2001,225(1-2):129-134.
[3] HONJO H,IWASA K,KAWATA M,et al.Progestins and estrogens and Alzheimer's disease[J].J Steroid Biochem Mol Biol,2005,93(2-5):305-308.
[4] 赵文军,吴雪萍,卡玛尔.孕马结合态混合雌激素的提取方法:中国,01104852.2[P].2001-08-15.
[5] 张兰兰,赵文军,吴雪萍,等.孕马尿中甾体成分及其活性的研究现状[J].天然产物研究与开发,2003,15(4): 354-358.
[6] 张兰兰,赵文军,吴雪萍,等.孕马尿中甾体成分的研究[J].中草药,2003,34(增刊):92-93.
[7] KOHLER G,MILSTEIN C.Continuous cultures of fused cells secreting antibody of predefined specificity[J]. Nature,1975,256(5517):495-497.
[8] BANTROCH S,BUHLER T,LAM J S.Appropriate coating methodsandotherconditionsforenzyme-linked immunosorbentassayofsmooth,rough,andneutral lipopolysaccharides of pseudomonas acruginosa[J].Clin Diag Lab Immunol,1994,1(1):55-62.
[9] ZHOU X L,ZHAO H,GAO X D,et al.Preparation and characterizationofmonoclonalantibodiesagainsta polysaccharide from flammulinavelutipes mycelium[J]. Hybridoma,2008,27(6):439-444.
[10] 赵丕成,袁大为,祝润,等.抗磺胺嘧啶单克隆抗体的制及其ELISA检测试剂盒的建立[J].细胞与分子免疫学杂志,2004,20(2):191-194.
[11] BANTROCH S,BUHLER T,LAM J S.Appropriate coating methods and other conditions for ELISA of smooth,rough, and neutral lipopolysaccharides of pseudomonas acruginosa [J].Clin Diag Lab Immunol,1994,1(1):55-62.
[12] 徐志凯.实用单克隆抗体技术[M].西安:陕西科学技术出版社,1992:1-29.
[13] 龙森.分泌抗恩诺沙星单克隆抗体杂交瘤细胞株的建立[D].长春:吉林农业大学,2006.
[14] 傅春玲.盐酸克伦特罗单克隆抗体免疫检测试剂盒的研制[D].天津:天津商学院,2006.
[15] 蒋广明.黄曲霉毒素Bl-单抗的制备及初步应用[D].扬州:扬州大学,2007.
[16] YANG T,ZHONG P,QU L,et al.Preparation and identification of anti-2,4-dinitrophenyl monoclonal antibodies [J].Immunol Methods,2006,313(1-2):20-28.
[17] 苏丽静,肖亮,战涛,等.蛇毒C型凝集素类似蛋白Agkisacutacin单克隆抗体的制备和鉴定[J].细胞与分子免疫学杂志,2007,23(11):1031-1033.
[18] 朱泽尧.磺胺眯残留单克隆抗体的筛选与制备[D].广州:暨南大学,2008.
[19] LIPMAN N S,JACKSON L R,TRUDEL L J.Monoclonal versus polyclonal antibodies:distinguishing characteristics, applications,and information sources[J].ILAR J,2005,46 (2):258-268.
DOI 10.3870/yydb.2014.08.004
Preparation of Monoclonal Antibody of Sodium Estrone Sulfate from Pregnant Mare’s Urine
AMANGULI·Tuohongerbieke1,FENG Xiao-hui2,GONG Yue-hong2,QI Xin-wei2,AERZIGULI·Tuerxun2, GAO Xiao-li1
(1.School of Pharmacy;2.the First Hospital Affiliated with Xinjiang Medical Univesity,Urimqi 830054,China)
Objective To establish a method to prepare anti-sodium estrone sulfate monoclonal antibody(ESS-Mab).MethodsBalb/c mice were immunized by ESS.Immune methods were screened.The blood serum potencies were measured by indirect ELISA and the best consistence of antigen and the first antibody were confirmed with method of titration.Cell fusion was carried by using PEG method and McAb hybridoma was screened with the indirect ELISA.ResultsThe best immunization method of mice was subcutaneously multi-point injection in mouse back with the dose of 200/100 μg ESS antigen five times.The fusion rate was 90.2%.Hybridoma positive rate of ELISA screening was 4.4%.Finally two cell lines 2C8 and 8A7 with good specificity and sensitivity were obtained.ConclusionThe best immunization way is selected and indirect ELISA is set up effectively and reliably for screening and presenting ESS McAb.the hybridoma technique is able to prepare monoclonal antibody of anti-ESS successfully.
Sodium estrone sulfate;Monoclonal antibody;Assay,enzyme-linked immuno-sorbent;Hybridoma
R977.1;R965
A
1004-0781(2014)08-0991-06
2013-12-09
2014-03-06
*新疆维吾尔自治区科技厅高技术发展计划项目(200910108);新疆维吾尔自治区重大科技专项课题(201130101-4)
阿曼古力·托洪尔别克(1986-),女,新疆阿勒泰人,硕士,研究方向:新疆地产资源新药研究与开发。电话: (0)13659999801,E-mail:amangul2008@126.com。
高晓黎(1962-),女,河南新野人,教授,博士生导师,博士,研究方向:新疆地产资源新药研究与开发。电话: 0991-4312411,E-mail:gxli@tefeng.com。

