尼群地平片在不同介质中的溶出度比较
王翼,缪娅妮,詹长娟,王华,徐伟
(南京理工大学泰州科技学院化工学院,泰州 225300)
尼群地平片在不同介质中的溶出度比较
王翼,缪娅妮,詹长娟,王华,徐伟
(南京理工大学泰州科技学院化工学院,泰州 225300)
目的 比较5个不同厂家尼群地平片的体外溶出情况,为临床用药提供参考。方法采用紫外分光光度法,参考现行标准《中华人民共和国药典》2010年版及药品品质再评价标准,分别选取0.1 mol·L-1盐酸-乙醇(70∶30)溶液及含有0.15%聚山梨酯80的水溶液、pH1.2盐酸溶液、pH4.0醋酸盐缓冲液、pH6.8磷酸盐缓冲液为溶出介质,测定尼群地平片的溶出度。结果在0.1 mol·L-1盐酸-乙醇(70∶30)介质中,60 min时,溶出度均>75%,而在其余4种介质中,45 min溶出均未超过70%,根据相似因子f2法不同介质中的溶出曲线不相似。结论所考察厂家产品符合现行质量标准的要求,但均不符合药品品质再评价的标准。尼群地平片在不同介质中的溶出行为有差异。
尼群地平;溶出度;分光光度法,紫外
溶出度实验是评价口服固体制剂内在质量的一种重要手段,对保证不同生产企业生产的同一药品具有相同品质和疗效起到十分重要的作用,国家药品审评中心也于2011年1月在其官方网站上提供了“日本厚生省药品体外溶出实验信息库”,供用药人员参考[1]。尼群地平片作为高血压治疗的主要药物,目前国内已有上百家企业获得尼群地平片生产许可[2]。并且我国的现行标准比日本标准,宽松很多[1,3]。不同厂家生产的尼群地平片的内在质量到底如何?笔者选取了5个生产厂家的尼群地平片作为对象,根据“药品品质再评价工程”[4]通过体外溶出实验反映其内在差别,为用药提供参考。
1 仪器及试药
1.1 仪器 UV2450紫外分光光度计(日本岛津公司),ZRS-8L智能溶出实验仪(天津市天大天发科技有限公司),AL 104分析天平[梅特勒-托利多仪器(上海)有限公司]。
1.2 试药 尼群地平片(规格:10 mg,A、B、C、D、E 5个厂家的批号分别为:201303082,13031602,130304, 157130157,121008)。盐酸(无锡市佳妮化工有限公司,批号:20120215,分析纯)、无水乙醇(无锡市佳妮化工有限公司,批号:20121210,分析纯)、聚山梨酯-80 (国药集团化学试剂有限公司,批号:20080324,分析纯)、氯化钠(无锡市佳妮化工有限公司,批号: 20091108,分析纯)、磷酸氢二钠(国药集团化学试剂有限公司,批号:F20081104,分析纯)、磷酸氢二钾(江苏强盛功能化学股份有限公司,批号:20120910,分析纯)、无水乙酸钠、冰乙酸(无锡市佳妮化工有限公司,批号:20100702,分析纯)。尼群地平对照品(武汉大华伟业医药化工有限公司,批号:1311002,含量99.74%)。
2 方法与结果
2.1 紫外分光光度法的建立与评价
2.1.1 溶出介质的选择 据国家药审中心推荐的尼群地平片“药品品质再评价”标准[1],分别选取900 mL含0.15%聚山梨酯-80的水溶液(介质Ⅰ)、pH1.2盐酸溶液(介质Ⅱ)、pH4.0醋酸盐缓冲液(介质Ⅲ)、pH6.8磷酸盐缓冲液(介质Ⅳ)为溶出介质,具体配制方法参考文献[4]。另选取现行质量标准中的“0.1 mol·L-1盐酸-乙醇(70∶30)900 mL”(介质Ⅴ)作为比较。
2.1.2 贮备液的配制 准确称取尼群地平对照品100 mg,置500 mL量瓶中,用无水乙醇溶解并稀释至刻度,摇匀,得200μg·mL-1的尼群地平贮备液。
2.1.3 最大吸收波长的选择 分别以上述5种介质作为溶液,配制一定浓度的尼群地平溶液,于波长200~400 nm范围内进行紫外扫谱,结果显示尼群地平最大吸收波长分别为354 nm(介质Ⅰ、Ⅴ),355 nm (介质Ⅱ),358 nm(介质Ⅲ),359 nm(介质Ⅳ)。
2.1.4 标准曲线的绘制 准确移取尼群地平贮备液1,2,3,4,5,6 mL置100 mL量瓶中,分别用以上5种溶出介质稀释至刻度,在相应最大吸收波长测定吸光度,以吸光度值对浓度进行线性回归,得不同溶出介质下的标准曲线方程及相关系数,结果显示尼群地平在浓度2~12μg·mL-1范围内线性关系良好。见表1。
2.1.5 5个厂家尼群地平片的含量测定 分别取5个厂家尼群地平片20片,精密称定,研细。准确称取尼群地平粉末适量(约相当于尼群地平10 mg),置100 mL量瓶中,用无水乙醇溶解并稀释至刻度,滤过,作为供试品溶液。准确移取续滤液5 mL置100 mL量瓶中,加溶出介质Ⅰ稀释至刻度,在354 nm波长处测定吸光度,计算含量,A、B、C、D、E 5个厂家的尼群地平片的相对标识百分含量分别为(100.5±0.59)%, (100.1±0.87)%,(99.6±1.10)%,(99.8±0.77)%, (101.7±1.73)%(n=3)。

表1 尼群地平标准曲线方程
2.1.6 回收率实验 准确移取已知含量的供试品溶液5 mL,置100 mL量瓶中,按含量的80%,100%, 120%加入尼群地平贮备液(各平行操作3份),用溶出介质稀释至刻度,在相应最大吸收波长处测定吸光度,根据标准曲线方程计算相应的回收率(n=9),尼群地平在Ⅰ~Ⅴ种溶出介质中的平均回收率分别为99.5%(RSD=1.86%),100.1%(RSD=1.97%), 100.1%(RSD=2.41%),99.3%(RSD=2.01%), 99.6%(RSD=0.50%)。
2.1.7 稳定性实验 准确移取“2.1.5”项下的供试品溶液5 mL,置100 mL量瓶中,分别加5种溶出介质稀释至刻度,在室温下放置,于0,2,4,6,8,12,24 h测定吸光度,结果吸光度RSD值介于0.32%~0.52% (n=7)。
2.1.8 精密度实验 用上述5种溶出介质分别配制浓度为8μg·mL-1的尼群地平对照品溶液,在相应最大吸收波长处测定吸光度,平行测定6次,结果吸光度RSD值介于0.28%~0.87%(n=6)。
2.2 溶出度实验 分别选取上述5种溶出介质,体积均为900 mL,转速为100 r·min-1,照《中华人民共和国药典》2010版二部溶出度测定法(附录ⅩC第二法),分别在5,10,15,20,30,45,60,90,120 min时取溶液适量,经孔径0.45μm微孔滤膜过滤,取续滤液于最大吸收波长处测定吸光度,根据标准曲线方程计算累计溶出度,绘制溶出曲线(n=6)。5个厂家的产品均在介质Ⅴ中的溶出最好,均能满足现行质量标准的要求。但在介质Ⅰ中,45 min溶出24.8%~51.3%;在介质Ⅱ中,45 min溶出27.0%~44.5%;在介质Ⅲ中,45 min溶出22.0%~36.3%;在介质Ⅳ中, 45 min溶出33.9%~60.4%。另外,溶出曲线的比较采用相似因子f2法[5]。经计算,在介质Ⅰ、Ⅱ、Ⅲ、Ⅳ中,A厂家产品的4条溶出曲线均相似(f2>50),B厂家的产品在介质Ⅲ和介质Ⅳ的溶出曲线不相似(f2= 45),C厂家的产品在介质Ⅰ和介质Ⅲ、介质Ⅱ和介质Ⅳ、介质Ⅲ和介质Ⅳ的溶出曲线均不相似(f2分别为41,47,35),D厂家的产品在介质Ⅰ和介质Ⅳ、介质Ⅱ和介质Ⅳ、介质Ⅲ和介质Ⅳ的溶出曲线均不相似(f2分别为44,42,36),E厂家的产品在介质Ⅰ和介质Ⅲ、介质Ⅲ和介质Ⅳ的溶出曲线均不相似(f2分别为47, 46)。见图1。
3 讨论
尼群地平在含有聚山梨酯-80的介质中,经实验,发现237 nm附近处的吸收峰会出现裂峰,但354 nm处的吸收峰不受影响,所以,笔者选取354 nm作为紫外检测波长。尼群地平在不同介质中最大吸收波长存在差异,可能与介质的pH及极性有关。
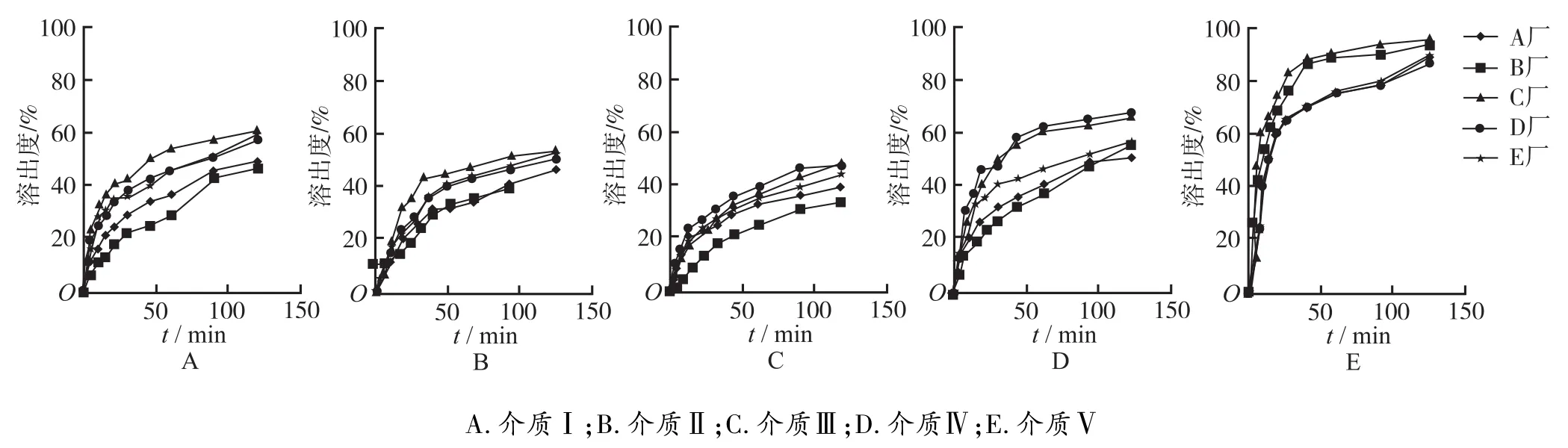
图1 5个厂家尼群地平片在5种介质中的溶出曲线
对于口服固体制剂,溶出度是十分重要的体外评价指标,而一个良好的溶出度标准不仅保证制剂在体内的良好吸收,对不同厂家生产的同一产品的质量也应有很好的区分能力。从这一点上,尼群地平片的我国现行溶出度标准中,溶出介质选用0.1 mol·L-1盐酸-乙醇(70∶30)溶液值得商榷。从本实验中,也可以看出该介质对不同质量的产品区分能力太小。溶出介质的选择不能为了提高体外溶出“效果”而忽略人体的生理条件,不能“为了溶出而溶出”。
尼群地平片的我国现行溶出度标准为:采用介质Ⅴ,60 min时溶出度需>75%;而《日本橙皮书》的要求为:在介质Ⅰ、Ⅱ、Ⅲ、Ⅳ中,45 min时,溶出度需均>70%,且溶出曲线近乎完全一样,即要求尼群地平片在以上4种介质中均具有良好溶出。本溶出度实验结果均远远低于《日本橙皮书》的要求,而这一标准也正是目前国家药审中心推荐的标准,特别是在介质Ⅲ中,各厂家产品的溶出度均表现最差。而且,所比较的5个厂家的产品不仅在溶出限度上不能满足“药品品质再评价”的要求,在4种介质中的溶出行为也不能保持相似(A厂家除外,但遗憾的是A厂家产品溶出限度不符合要求)。故所考察的5个厂家的产品在溶出限度及各溶出介质中溶出曲线的相似性上均不能满足药品品质再评价的要求,这与各厂家的制备工艺密切相关。厂家只有改良制剂的制备工艺,使其产品在不同的pH介质中均能较好溶出,才能从根本上提高质量。
目前,我国在推行药品品质再评价工程,参比制剂的选择是一项非常重要的工作,一个良好的参比制剂可以为其他的生产厂家提供“方向”。本实验中尼群地平片未能找到合适的“原研制剂”,仅从市场占有率较高的厂家中随机抽取了5家,从实验结果来看,这5个厂家均不能满足参比制剂的要求。今后还需扩大分析范围,尽快考察出质量好的参比制剂,为群众用药提供参考,同时,生产厂家也应根据要求提高生产技术,提升产品质量。
[1] 国家食品药品监督管理总局药品审评中心.日本厚生省药品体外溶出实验信息库的声明[EB/OL].[2011-01-01].http://www.cde.org.cn/drugInfo.do?method=init&frameStr=3.
[2] 国家食品药品监督管理总局.药品查询[EB/OL].[2014-01-20]http://app1.sfda.gov.cn/datasearch/face3/base. jsp.
[3] 国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:232.
[4] 谢沐风.简介日本“药品品质在评价”工程(溶出度研究系列一)[J].中国药品标准,2005,6(6):42-46.
[5] 药品审评中心.普通口服固体制剂溶出度实验技术指导原则[EB/OL].[2012-11-19].http://www.cde.org.cn/zdyz.do?method=largePage&id=177.
DOI 10.3870/yydb.2014.12.027
R972.2;R927.2
B
1004-0781(2014)12-1639-03
2014-01-28
2014-04-10
王翼(1980-),男,山西临汾人,讲师,硕士,研究方向:药物新剂型的开发。电话:0523-86150675,E-mail: lywy226@163.com。

