铁锰生物污泥吸附磷
李 冬,孙 宇,曾辉平,蔡言安,张 杰,2
(1.北京工业大学水质科学与水环境恢复工程北京市重点实验室,北京 100124;2.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090)
铁锰生物污泥吸附磷
李 冬1*,孙 宇1,曾辉平1,蔡言安1,张 杰1,2
(1.北京工业大学水质科学与水环境恢复工程北京市重点实验室,北京 100124;2.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090)
采用扫描电镜(SEM)、X射线能谱仪(EDS)、比表面和孔隙度分析仪等设备,研究了由生物除铁除锰滤柱反冲洗铁锰生物污泥制得的铁锰氧化物的表征性状,并结合等温吸附-解吸和动力学实验研究对铁锰氧化物吸附磷的吸附特性和相关机制进行探究.结果表明:供试铁锰氧化物是球形颗粒聚合体,孔隙发达且多以微孔形式存在,比表面积为 285.6m2/g.铁锰氧化物的磷吸附特性可用 Langmuir方程和Freundlich方程来描述,相关系数均大于 0.9,达到极显著水平,吸附容量为 39.06mg/g.中性盐介质(KNO3)中在最大吸附量时 P的解吸率为13.04%.铁锰氧化物对磷的吸附焓变△H0为正值,是吸热过程,吉布斯自由能变△G0为负值,该吸附过程是自发进行的.准二级动力学模型可较好地反映供试铁锰氧化物的等温吸附动力学.
铁锰氧化物;磷;吸附
近年来,水体富营养化已成为世界各国面临的重大环境问题[1-4].据报道,当水体中的总磷含量达到 0.015mg/L时,就可引发水体富营养化,控制水体中磷的浓度是防止水体富营养化的重要手段[4-7].在各种除磷方法中,吸附法除磷以其高效低耗、工艺简单及运行可靠快速等优点逐渐受到人们重视[8-10].铁锰氧化物是常用的除磷吸附剂[11-14],对磷具有较强的吸附作用.
生物除铁除锰滤池的反冲洗废水中含有大量的铁锰生物污泥[15-17],若未经处理就排入水体,将造成严重污染.对其进行相应处理后,可得到一种有吸附性能较好的铁锰氧化物.本文研究了这种铁锰氧化物对磷的吸附特征,并考察其吸附特性影响因素.以期为低浓度磷酸盐废水的深度处理以及富营养化水体的处理提供一种新的材料,也为生物除铁除锰滤池反冲洗废水的处理提供一种废物利用的方法.
1 材料与方法
1.1 铁锰氧化物的制备
由成熟生物除铁除锰滤池的同一运行阶段(进水浓度为Fe:2-3mg/L、Mn:0.5mg/L)反冲洗产生的铁锰生物污泥制得铁锰氧化物.具体制备方法为:收集滤池反冲洗出水,静沉12h,将沉积在底部的铁泥于105℃下烘干4h,冷却后经研钵磨碎,过200目筛后于干燥器中备用.
1.2 试验方法
1.2.1 等温吸附与解吸试验 称取11份0.10g铁锰氧化物于50mL离心管中.加入30mL系列磷吸附液(KH2PO4配制),浓度依次为 5.0,10.0,20.0, 40.0,60.0,80.0,100.0,120.0,150.0,180.0,250mg/L (pH4.5,含0.01mol/L KNO3).在25℃条件下恒温振荡24h,8000r/min离心10min,上清液过0.45µm滤膜,测定其中的磷含量,分别应用 Langmuir方程和Freundlich方程对吸附平衡进行拟合.
吸附试验后的铁锰氧化物用无水乙醇悬浮洗涤,离心,弃上清液,加入0.01mol/L KNO3溶液30ml.在 25℃条件下恒温振荡 24h,上清液过0.45µm滤膜,测定其中磷的浓度.
1.2.2 吸附动力学 准确称量 0.10g铁锰氧化物于50ml离心管中,共称取24份,分为2组,并加入30mL吸附液于各样品中.其中,第1组吸附液中磷浓度为10mg/L,第2组为40mg/L.之后,将2组样品置于恒温振荡器中振荡(T=25℃),分别于 5,10,20, 30,45,60,90,120,180min时对第 1组样品取样,于5,10,20,30,45min以及1,2,4,6,8,12,16,20, 24,48h时对第2组样品取样,样品过0.45µm滤膜,并测定其中磷的浓度,应用准二级动力学方程来拟合数据.
1.2.3 影响因素研究温度 对等温吸附试验中的温度进行调控,研究 15,25,35℃条件下的铁锰氧化物的吸附性能,并进行热力学分析研究.
离子浓度:设置离子浓度为 0.001mol/L KNO3、0.01mol/L KNO3和0.1mol/L KNO3,考察初始磷溶液浓度分别为10mg/L和40mg/L时,不同离子浓度对铁锰氧化物吸附性能的影响规律.
pH 值:在磷浓度为 15mg/L,电解质为0.01mol/L KNO3的条件下,调节pH值,研究铁锰氧化物在pH值为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0时的吸附性能.
1.3 试验装置及分析方法
试验装置为国华SHA—B恒温振荡器.
铁锰氧化物表面特征的测定:铁锰氧化物表面分析采用 SEM 扫描电镜(日本 Hitachi S—4300);铁锰氧化物的鉴定分析采用美国 EDAX GENESIS XM2 60S X—射线能谱仪(EDS);比表面及孔性结构分析采用美国 Quantachrome-NOVA4000e全自动比表面和孔隙度分析仪.
总磷浓度测定为钼酸铵分光光度法.pH值测定采用WTW pH 340i便携式PH计.
2 结果与讨论
2.1 铁锰氧化物的鉴定和表征
对制备得到的铁锰氧化物进行表面分析和鉴定分析,得到扫描电镜(SEM)和EDS图谱.由图1可见,该种铁锰氧化物是以球形颗粒聚合体存在的.从图2(EDS图谱)可清晰看到元素Fe与O的特征峰,结合图2和表1可明显看出,样品中元素Fe与O质量百分比远远高于其他元素,说明样品主要为铁锰氧化物.样品中C的含量相对较高,主要因为样品中混有生物滤池经反冲洗后流失的微生物以及预处理时粘上的碳导电胶.

图1 铁锰氧化物的扫描电镜(SEM)图片Fig.1 SEM diagrams of system of iron and manganese oxide
由表2可见,从总孔体积与微孔体积可以看出,铁锰氧化物的孔隙发达且多以微孔形式存在.多点 BET法测得的比表面积为 285.6m2/g,与具有良好吸附性能的水铁矿比表面积常见值(200~350m2/g)相似[18].
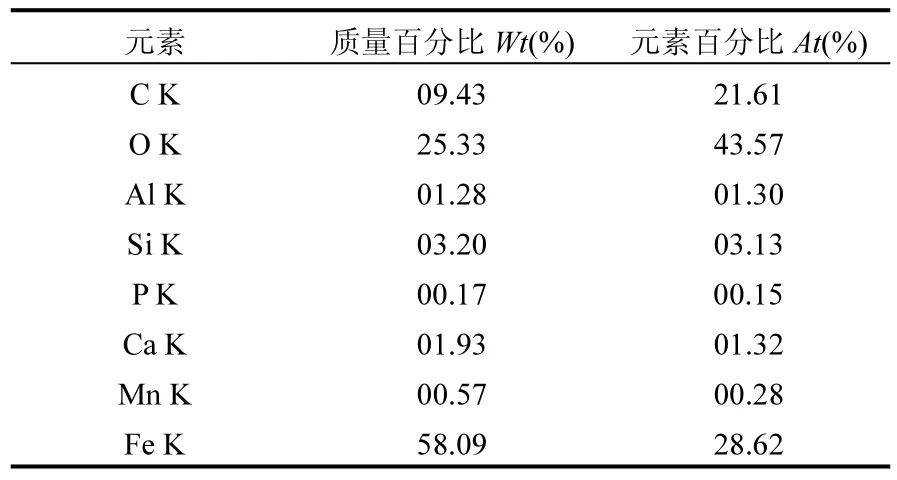
表1 铁锰氧化物的EDS结果Table 1 EDS results of two kinds of iron and manganese oxides
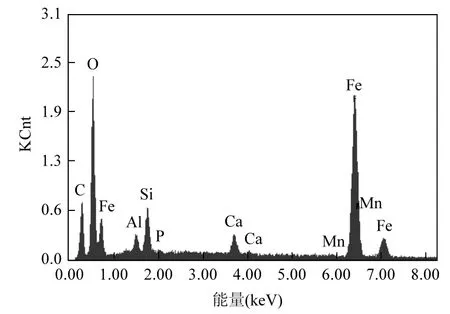
图2 铁锰氧化物的EDS图谱Fig.2 EDS spectra for iron and manganese oxides

表2 孔性结构参数Table 2 Pore structural properties
2.2 等温吸附与磷解吸研究
从图 3可见,供试铁锰氧化物对磷的吸附量都先随平衡溶液中磷的浓度的增加而急剧上升,之后,随着平衡溶液中磷的浓度继续增加,吸附量变化减慢.这种等温吸附曲线属于高亲和力的 H型等温线,其特点是溶质在极低浓度时就有很大的吸附量,具有类似于化学吸附的特征.
将供试铁锰氧化物对磷的吸附结果用Langmuir吸附等温方程及 Freundlich吸附等温方程拟合.其中,Langmuir吸附等温方程如下:
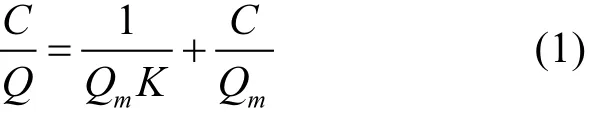
式中:Q为单位铁锰氧化物的吸磷量;Qm为单位铁锰氧化物的最大吸磷量,mg/g;K为与吸附能有关的常数;C为当吸附-解吸达到平衡时溶液中磷的浓度.
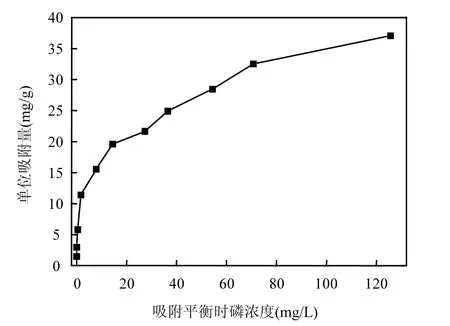
图3 铁锰氧化物的等温吸附曲线Fig.3 Isothermal adsorptioncurveofiron and manganese oxides
用 Langmuir吸附等温方程拟合得出的结果如表3所示.铁锰氧化物的拟合相关系数在0.9以上,达到1%的显著水平,说明Langmiur方程能较好地拟合铁锰氧化物对磷的吸附.由铁锰氧化物的磷吸附参数可以看出,最大吸附容量为39.06mg/g,说明铁锰氧化物吸附磷的能力较强.结合王小明等[19]、Abou-Hassanet Ali等[20]和邵兴华等[21]对不同种类铁矿吸附性能的研究可知,本试验中铁锰氧化物对磷的吸附量明显高于单一的针铁矿和赤铁矿,略小于吸附能力很强的水铁矿.最大缓冲容量MBC反映固液体系吸附溶质时的缓冲能力[22],铁锰氧化物MBC值为3814mL/g,说明铁锰氧化物的固液体系缓冲能力较强,即使溶液中磷浓度变化较大,体系仍能维持较好的吸附效果.
Freundlich吸附等温方程如下:
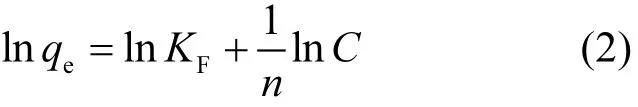
式中:qe为平衡吸附量,mg/g;C为吸附-解吸达到平衡时溶液中磷的浓度,mg/L;KF为Freundlich吸附系数,近似地看作与吸附剂吸附容量有关的参数,吸附系数 KF值越大,吸附剂的吸附效果越好;1/n为直线的斜率,是与吸附分子与吸附剂表面作用强度有关的参数,通常1/n在0.1~0.5之间说明吸附反应容易进行,在2以上则很难进行.
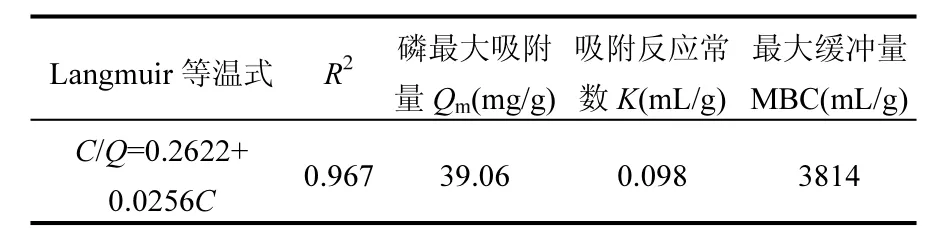
表3 铁锰氧化物吸磷的Langmuir吸附等温式Table 3 Langmuir isothermal result of adsorption of phosphate on iron and manganese oxides
用 Freundlich吸附等温方程拟合的结果见表 4.相关系数在 0.9以上,达到 1%的显著水平,说明 Freundlich方程也能很好地拟合铁锰氧化物对磷的吸附.铁锰氧化物的 1/n值为 0.315,在0.1~0.5之间,说明其很容易吸附水中的磷,具有较强的吸附能力.
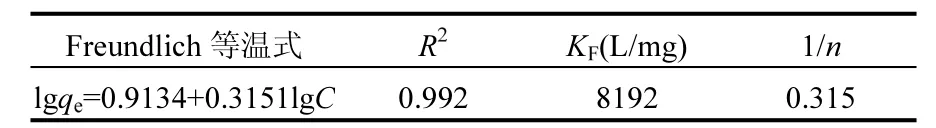
表4 铁锰氧化物吸磷的Freundlich吸附等温式Table 4 Freundlich isothermal result of adsorption of phosphate on iron and manganese oxides
图 4是铁锰氧化物吸附磷后在 0.01mol/L KNO3介质中解吸磷的解吸量和解吸率关于单位吸附量的变化曲线.由图4可以看出,铁锰氧化物的磷解吸量均随磷吸附量的增加而增加,且有很好的线性关系,相关系数为 0.984,达到显著水平.由图4还可看出,铁锰氧化物吸附磷的解吸率较低,先随吸附磷量的增加而快速增加,之后解吸率增加的趋势逐渐变缓.这可能是由于在平衡溶液磷浓度较低时,铁锰氧化物表面的吸附位点相对充足,磷优先与高活性表面位点结合,专性吸附居多,磷酸根作为配位体,与铁锰氧化物表面的—OH或—H发生配位体交换而保持在铁锰氧化物表面的吸附,具有某种程度的专一性,难以被其他阴离子所代换,因此解吸率较低;随着平衡溶液磷浓度增高,铁锰氧化物的吸附位点逐渐饱和,与低活性位点结合的非专性吸附量及其他吸附方式的吸附量增加,吸附结合能力降低,导致解吸变得容易,解吸量增加;平衡溶液磷浓度继续增高,吸附位点接近饱和,一部分磷会扩散进入铁锰氧化物的孔隙结构中,使得解吸率趋于稳定.
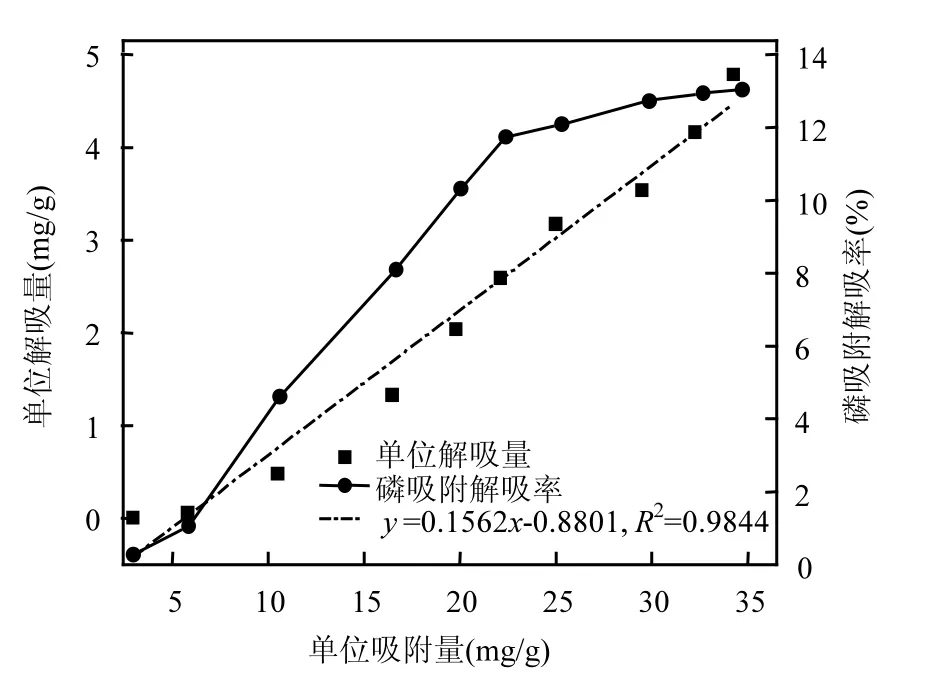
图4 磷解吸量及解吸率随吸附量变化曲线Fig.4 Curves of desorption amount and the ratio of desorbed P versus P adsorption amount
Kuo等[23]和Beauchemin等[24]提出,土壤磷的饱和度可作为磷潜在吸附能力的一个指标.借由这个概念,可认为铁锰氧化物在吸附平衡过程中对磷的吸附与释放所表现的双重作用很可能与其对磷吸附的饱和度有关.即磷吸附饱和度较高时,表现为对磷的释放作用;磷吸附饱和度较低时,表现为对磷的吸附作用.以吸附磷量除以铁锰氧化物对磷的最大吸附量作为该点吸附平衡时的磷吸附饱和度,得到磷吸附饱和度与磷解吸量的关系曲线,如图5所示.可以发现,磷吸附饱和度在30%以下时,几乎没有吸附的磷解吸;饱和度超过30%以后,磷解吸量随吸附饱和度的增大开始增加.经分析认为,磷吸附饱和度在30%以下时,铁锰氧化物对磷的吸附主要是专性吸附,其活性表面表现为增强对磷的吸附作用,吸附的磷不易解吸;之后铁锰氧化物对磷的吸附中非专性吸附及其他吸附方式的比例增大,铁锰氧化物即开始出现磷的解吸作用,且逐渐增强.由此可以得出,若该种铁锰氧化物运用到除磷工艺时,控制其吸附饱和度不超过30%,有助于其吸附能力达到最优值.
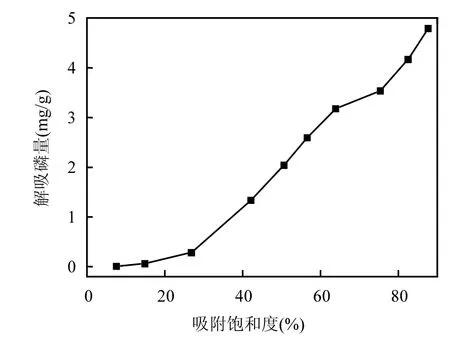
图5 磷吸附饱和度与磷解吸量的关系曲线Fig.5 Relation curve between P adsorption saturation and P desorption
2.3 吸附动力学研究
铁锰氧化物在初始磷溶液浓度较低(10mg/L)和较高(40mg/L)情况下吸附磷的动力学曲线分别如图6和图7所示.无论在哪种初始磷溶液浓度下,吸附的开始阶段,铁锰氧化物的磷吸附量均随时间急剧上升,在经过一定时间后逐渐趋于平缓,直至达到吸附平衡状态.并且,相同条件下,初始磷溶液浓度较高的铁锰氧化物,其吸附量也较高,吸附速率也较快.经分析可知,初始磷溶液浓度越高,可供铁锰氧化物吸附的磷就越多,同时,溶液中磷浓度与铁锰氧化物外表面液膜的膜内磷浓度之间的浓度差越大,磷在铁锰氧化物表面迁移的动力也就越大.初始磷溶液浓度越高,溶液达到吸附平衡所需的时间越长.如初始磷溶液浓度10mg/L时,溶液达到吸附平衡只需1h,而初始磷溶液浓度为40mg/L时,约需24h溶液才能达到吸附平衡状态.此外,初始磷溶液浓度为 10mg/L时,铁锰氧化物对磷的去除率在很短时间内就能达到 95%以上,而生活污水中磷的浓度一般不超过10mg/L,这说明2种铁锰氧化物作为吸附剂在生活污水除磷中将有很好的应用潜力.
采用准二级动力学模型对铁锰氧化物在不同初始磷溶液浓度下吸附磷的动力学过程进行拟合分析.准二级动力学模型的微分方程表达式为:
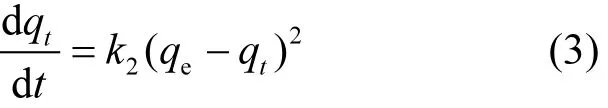
积分后得
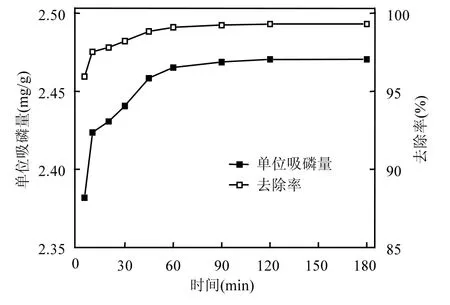
图6 初始磷溶液浓度10mg/L的吸附动力学曲线Fig.6 Adsorptionkineticscurve in the initial phosphate concentration of 10mg/L solution
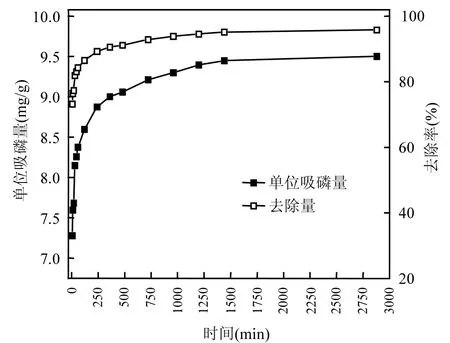
图7 初始磷溶液浓度40mg/L的吸附动力学曲线Fig.7 Adsorption kinetics curve in the initial phosphate concentration of 40mg/L solution
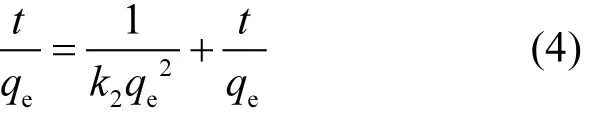
式中:qe和qt分别为理论平衡时和任意时刻时的吸附量,mg/g;k2为准二级动力学模型的吸附速率常数,g/(mg·h);准二级动力学模型的初始吸附速率为h=k2qe2[mg/(g·h)].
由表 5中可以看出,铁锰氧化物拟合的相关系数为 0.999,达到 1%的显著水平,且由拟合方程得出的qe理论值均与试验值十分相近,说明2种铁锰氧化物对磷的吸附过程符合准二级动力学模型.比较初始磷溶液浓度较低和较高 2种情况,铁锰氧化物的初始吸附速率由49.51mg/(g·h)增加至526.3mg/(g·h),提高了9倍,说明在较高初始磷浓度下,铁锰氧化物也会有较高的初始吸附速率.
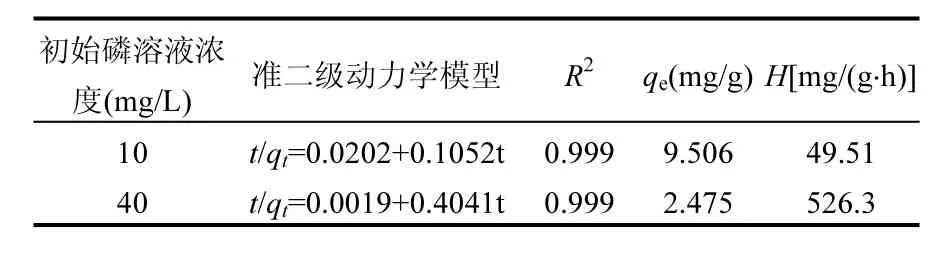
表5 准二级动力学模型Table 5 The pseudo-second-order kinetic models
2.4 影响因素研究
2.4.1 离子强度对吸附磷的影响 图 8是铁锰氧化物在初始磷溶液浓度为 10,40mg/L条件下,以背景电解质 KNO3为试验对象,离子强度分别为0.1,0.01,0.001mol/L时2种铁锰氧化物吸附磷的情况.初始浓度 10mg/L时,离子强度对铁锰氧化物吸附磷的影响较小,吸附量没有明显差异,变化率为0.904%;初始浓度40mg/L时,吸附量随离子强度增大而增加,离子强度为0.1mol/L时的磷吸附量比0.001mol/L时上升9.406%.
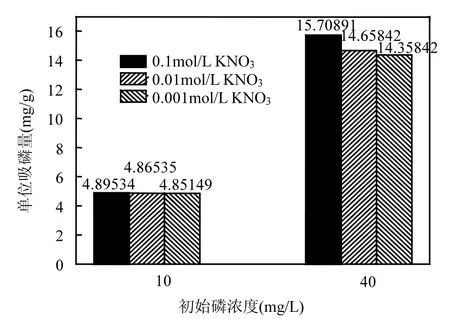
图8 不同离子强度下铁锰氧化物对磷的吸附Fig.8 Adsorption of phosphorus ontoiron and manganese oxides at different ionic strength
Mohapatra等[25]指出,一般把吸附行为不受离子强度影响或吸附量随离子强度增加而增加作为是内层配位及专性吸附的判断证据.前文分析过,初始浓度较低时,铁锰氧化物对磷的吸附以专性吸附居多,有较强的选择性和不可逆性,所以吸附不受离子强度的影响;初始浓度较高时,被吸附的磷酸根离子之间更加接近,吸附会被它们之间的静电排斥作用所阻碍,而较高的离子强度会削弱这种排斥作用,使得吸附量随离子强度增加而增加.生活污水中磷的浓度一般不超过10mg/L,在这种情况下,铁锰氧化物对磷的专性吸附不受离子强度的影响,会有很好的除磷效果.
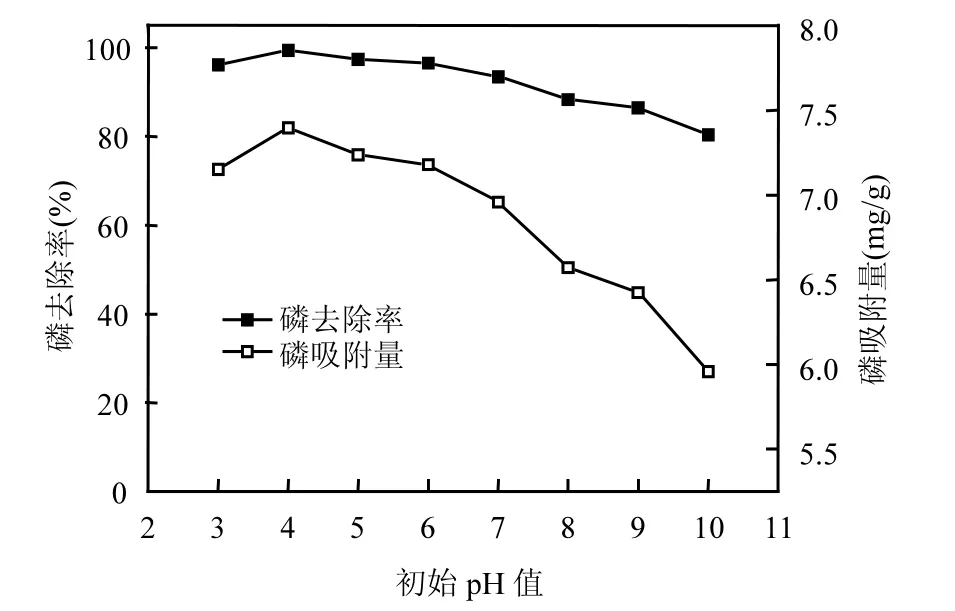
图9 不同pH值条件下铁锰氧化物吸附磷变化曲线Fig.9 Curve of phosphorus adsorption ontoiron and manganese oxides under different pH conditions
2.4.2 pH值对吸附磷的影响 由图9可见,铁锰氧化物的吸附量随pH值变化的趋势一致,pH值较低时铁锰氧化物对磷的吸附较好,在pH=4时,吸附量最大,去除率达到99.45%,随着pH值的升高,铁锰氧化物表现出磷吸附量下降的趋势.经分析认为:铁锰氧化物更适合于处理酸性、中性的废水.这是因为pH值的改变,会影响铁锰氧化物表面带有的正负电荷数量[26].pH值较低时,铁锰氧化物表面带有的正电荷较多,使得阴离子即磷酸根与铁锰氧化物之间有较强的亲和力,铁锰氧化物对磷酸根产生的吸引作用较强;而在碱性条件下,铁锰氧化物表面携带了大量的负电荷,对带负电荷的磷酸根的吸引力大大减弱,同时溶液中的OH-逐渐增多,与磷酸根竞争吸附位点,从而使吸附量减少.
2.4.3 温度对吸附磷的影响及吸附热力学研究 由图 10可见,在初始磷溶液浓度较低时(<20mg/L),温度对吸附的影响较小,吸附量无明显差异;当初始磷溶液浓度>20mg/L时,随着温度的升高,吸附量逐渐增大.这表明铁锰氧化物的除磷过程是吸热过程.当温度由15℃上升到25℃时,温度对铁锰氧化物吸附磷的影响较为明显,而当温度由25℃上升到35℃时,吸附量增加较少.结合上文分析,在初始磷溶液浓度较低的情况下,铁锰氧化物对磷的吸附有较强的选择性和不可逆性,因此受温度影响较小;而当初始磷溶液浓度较高的情况下,温度的升高不仅使溶液中磷元素克服铁锰氧化物表面液膜阻力的能力增强,而且有利于铁锰氧化物表面吸附的磷元素沿微孔向其内部迁移,从而使可供使用的吸附位增多,吸附量增大.
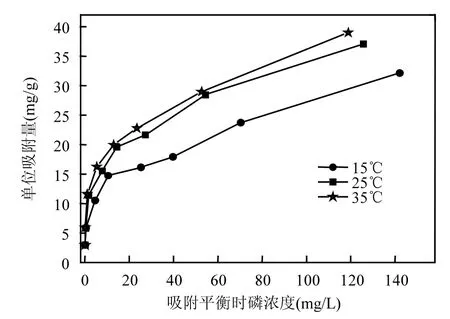
图10 不同温度条件下的等温吸附曲线Fig.10 Isothermal adsorption curve in different temperature
为了进一步研究不同温度下铁锰氧化物的吸附除磷效果及规律,进行了吸附热力学的分析.固液界面吸附过程中表征热力学特性的主要有标准反应焓变(△H0)、标准反应熵变(△S0)和标准吉布斯自由能变(△G0),它们与固—液分配系数KD之间的关系分别为:
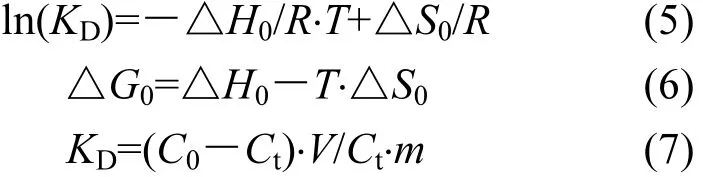
式中:C0为溶液初始浓度;Ct为t时刻溶液浓度;V为溶液体积;m为铁锰氧化物质量;T为绝对温度,R为理想气体常数.
先求出不同温度及不同初始磷溶液浓度下,铁锰氧化物对磷吸附的固—液分配系数 KD,以ln(KD)对1/T做图得到数条直线(图11).之后,根据直线的斜率及截距,求得△H0和△S0,进而得出△G0,计算结果见表6.由表6看出,铁锰氧化物吸附磷的所有吸附焓变△H0均为正值,说明其吸附磷是吸热反应.反应的吉布斯自由能变△G0均为负值,说明该反应是自发进行的,即铁锰氧化物对磷的作用力大于吸附剂与被吸附剂之间的能量势垒.随着温度的升高,△G0的绝对值也相应增大,说明高温有利于吸附过程.
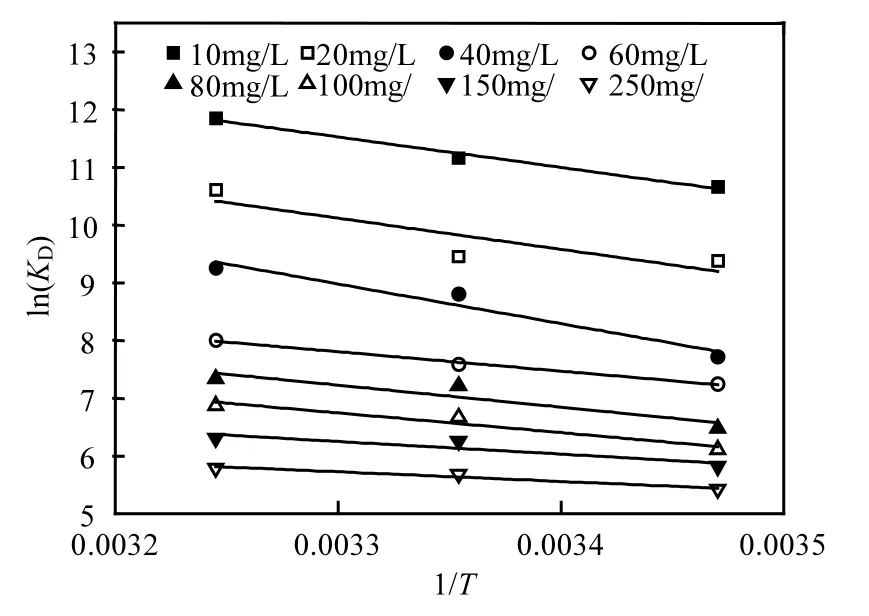
图11 不同初始磷浓度下KD与1/T关系Fig.11 Relationship between KDand 1/T in different initial concentrations of phosphorus
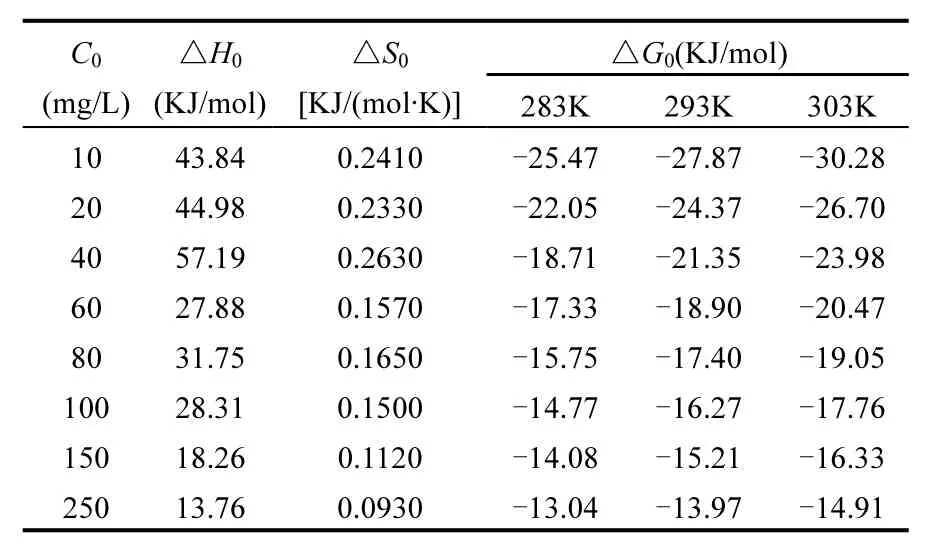
表6 铁锰氧化物吸附磷的热力学参数Table 6 Thermodynamic parameters of phosp horusad sorption ontoiron and manganese oxides
对于固液界面吸附,是固体表面上溶质和溶剂同时被吸附,吸附过程总熵变△S0是溶质的吸附(伴随熵减少即自由度减少)与溶剂的脱附(导致熵增加即自由度增加)两者的总合,它取决于溶质和溶剂与固体表面作用的强弱及共分子体积的大小[27].在本研究的吸附体系内,铁锰氧化物吸附磷的熵变△S0均为正值.这是因为在体系中铁锰氧化物对磷的吸附伴随着水分子的脱附,而磷被吸附的熵值减少量小于水分子脱附产生的熵值增加量,导致整个体系的△S0>0,说明该吸附过程中铁锰氧化物对磷具有亲和力.综上可知,铁锰氧化物的吸附除磷过程是吸热过程,高温有利于吸附的进行.△G0为负值,说明该反应是自发进行的,该种铁锰氧化物对磷有很强的吸附性能.
3 结论
3.1 供试铁锰氧化物以球形颗粒聚合体形式存在,微孔发达,比表面积分别为 285.6m2/g.对于水溶液中的磷具有显著吸附效果,单位铁锰氧化物的最大磷吸附量分别为 39.06mg/g.吸附饱和度在30%以下时,铁锰氧化物吸附的磷均不易解吸.
3.2 试验条件下,初始磷溶液浓度10mg/L时,铁锰氧化物对磷的吸附在5min内能达到95%以上,且符合准二级动力学模型.初始磷溶液浓度 10mg/L下,初始吸附速率为49.51mg/(g·h);初始磷溶液浓度40mg/L下,初始吸附速率为526.32mg/(g·h).
3.3 铁锰氧化物对于磷的吸附效果与离子强度大小和温度高低均呈正相关性,但吸附最佳 pH值为4左右.
[1] Nor I. China aims to turn tide against toxic lake pollution [J]. Science, 2011,333(6047):1210-1211.
[2] Qu J, Fan M. The current state of water quality and technology development for water pollution control in China[J]. Critical Reviews in Environ. Sci. Technol., 2010,40(6): 519-560.
[3] Guo L. Doing battle with the green monster of Taihu Lake [J]. Science, 2007,317(5842):1166.
[4] Smith V H, Tilman G D, Nekola J C. Eutrophication: impacts of excess nutrient inputs on freshwater, marine, and terrestrial ecosystems [J]. Environmental Pollution, 1999,100(1):179-196.
[5] Li B, Brett M T. The impact of alum based advanced nutrient removal processes on phosphorus bioavailability [J]. Wat. Res., 2012,46(3):837-844.
[6] Lee C C, Lin S D. Handbook of environmental engineering calculations [M]. New York: McGraw-Hill, 2000.
[7] 郝晓地.可持续污水—废物处理技术 [M]. 北京:中国建筑工业出版社, 2006.
[8] Hano T, Takanashi H, Hirata M, et al. Removal of phosphorus from wastewater by activated alumina adsorbent [J]. Water Science and Technology, 1997,35(7):39-46.
[9] özacar M. Adsorption of phosphate from aqueous solution onto alunite [J]. Chemosphere, 2003,51(4):321-327.
[10] Seida Y, Nakano Y. Removal of phosphate by layered double hydroxides containing iron [J]. Wat. Res., 2002,36(5):1306-1312.
[11] Zeng L, Li X, Liu J. Adsorptive removal of phosphate from aqueous solutions using iron oxide tailings [J]. Wat. Res., 2004,38(5):1318-1326.
[12] Chitrakar R, Tezuka S, Sonoda A, et al. Phosphate adsorption on synthetic goethite and akaganeite [J]. Journal of Colloid and Interface Science, 2006,298(2):602-608.
[13] Khare N, Martin J D, Hesterberg D. Phosphate bonding configuration on ferrihydrite based on molecular orbital calculations and XANES fingerprinting [J]. Geochimica et Cosmochimica Acta, 2007,71(18):4405-4415.
[14] Antelo J, Fiol S, Pérez C, et al. Analysis of phosphate adsorption onto ferrihydrite using the CD-MUSIC model [J]. Journal of Colloid and Interface Science, 2010,347(1):112-119.
[15] 李 冬,张 杰,陈立学,等.生物除铁除锰在地下水处理厂的应用 [J]. 中国给水排水, 2004,20(12):85-88.
[16] 李 冬,杨 宏,张 杰.首座大型生物除铁除锰水厂的实践 [J].中国工程科学, 2003,5(7):53-57.
[17] 曾辉平.生物除铁除锰滤池长期运行后除锰能力下降原因的探究 [D]. 哈尔滨:哈尔滨工业大学, 2007.
[18] Jambor J L, Dutrizac J E. Occurrence and constitution of natural and synthetic ferrihydrite, a widespread iron oxyhydroxide [J]. Chemical Reviews, 1998,98(7):2549-2586.
[19] 王小明,孙世发,刘 凡,等.铁(氢)氧化物悬液中磷酸盐的吸附-解吸特性研究 [J]. 地球化学, 2012,41(1):89-98.
[20] Abou Hassan A, Sandre O, Neveu S, et al. Synthesis of goethite by separation of the nucleation and growth processes of ferrihydrite nanoparticles using microfluidics [J]. Angewandte Chemie, 2009, 121(13):2378-2381.
[21] 邵兴华,章永松,林咸永,等.三种铁氧化物的磷吸附解吸特性以及与磷吸附饱和度的关系 [J]. 植物营养与肥料学报, 2006, 12(2):208-212.
[22] Holford I, Mattingly G. A model for the behaviour of labile phosphate in soil [J]. Plant and Soil, 1976,44(1):219-229.
[23] Kuo S, Jellum E J, Pan W L. Influence of phosphate sorption parameters of soils on the desorption of phosphate by various extractants [J]. Soil Sci. Society of America J., 1988,52(4): 974-979.
[24] Beauchemin S, Simard R R. Soil phosphorus saturation degree: Review of some indices and their suitability for P management in Quebec, Canada [J]. Canadian J. Soil Sci., 1999,79(4):615-625.
[25] Mohapatra D, Mishra D, Chaudhury G R, et al. Arsenic adsorption mechanism on clay minerals and its dependence on temperature [J]. Korean J. Chemi. Engin., 2007,24(3):426-430.
[26] Cornell R M, Schwertmann U. The iron oxides: Structure, properties, reactions, occurrences and uses [M]. Wiley. com, 2003.
[27] 赵振国.吸附作用应用原理 [M]. 北京:化学工业出版社, 2005.
Phosphorus adsorption oniron and manganese biological sludge.
LI Dong1*, SUN Yu1, ZENG Hui-ping1, CAN Yan-an1, ZHANG Jie1,2
(1.Key Laboratory of Beijing for Water Quality Science and Water Environment Recovery Engineering, Beijing University of Technology, Beijing 100124, China;2.State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, China). China Environmental Science, 2014,34(10):2528~2535
The biogenic iron and manganese oxide applied were gained by backwashing from the biological iron and manganese removal filter columns. The research reported in this paper focused on its characteristics and adsorptiondesorption properties on phosphorous. The results indicated that the oxide was spherical particle polymer with a developed pore structure mostly in the form of micropore, with a specific surface area of 285.6m2/g. The adsorption isotherm could be well described by Langmuir equation and Freundlich equation with a correlation coefficient larger than 0.9 and a high adsorption capacity of 39.06mg/g. The desorption percentage of adsorbed phosphorus was 13.04% in a neutral electrolyte of KNO3under maximum phosphorous adsorption conditions. The adsorption enthalpy change △H0was positive, which indicated the adsorption process was endothermic, meanwhile the minus Gibbs free energy change △G0suggested it was spontaneous. It was found that the phosphorous adsorption kinetics fitted pseudo-second-order kinetic models.
t:iron and manganese oxides;phosphorus;adsorption
X703.1
:A
:1000-6923(2014)10-2528-08
李 冬(1976-),女,辽宁丹东人,教授,博士,主要从事水质科学与水环境恢复关键技术研究.发表论文100 余篇.
2013-12-17
新世纪优秀人才支持计划(NCET-10-0008);国家自然科学基金(51222807);中国博士后科学基金(2012M510299)
* 责任作者, 教授, lidong2006@bjut.edu.cn

