蜡蚧霉的固体发酵动力学研究
张莹玲,楚占龙,金凡,张玲玉,薛皎亮,谢映平
(山西大学 生命科学学院,山西 太原 030006)
蜡蚧霉(Lecanicillium lecanii(Zimmermann))是一种寄生蚧虫、蚜虫、粉虱等害虫的病原真菌[1-2],用蜡蚧霉制备生物杀虫剂在害虫的生物防治中具有广泛的应用前景[3]。真菌杀虫剂生产过程中主要采用液-固双相发酵[4],固体发酵是其中的关键环节。但目前固体发酵过程存在培养方式粗放,培养基的碳源和氮源消耗与菌种的孢子产量等指标不易监测和定量,不同批次之间的质量难以控制等问题。
发酵动力学是研究发酵过程中环境因素与微生物代谢活动相互作用随时间变化的规律[5],建立发酵动力学模型并对发酵过程的数据进行分析有助于为工业化生产提供理论依据。Wang等[6]建立了关于径向分布温度在底物床上生产乙醇的旋转式生物反应器的模型,此模型与实验数据拟合度高,可以作为有效的方法去探讨固态发酵的扩大化生产过程;Mitchell等[7]采用时序模型的方法评估多层次的填充床生物反应器作为固体发酵过程潜在的有利条件,从而提高生物反应器的性能。Mazutti等[8]研究了马克斯克鲁维酵母(Kluyveromyces marxianus)增长和菊粉酶(inulinase)产量的动力学,表明动力学模型有助于放大和优化菊粉酶的产量。Rodriguez-Fernandez等[9]采用数学模型描述了黑曲霉(Aspergillus niger)在以橘柑皮作为培养基的固态发酵中产生的果胶酶和木聚糖酶产量的动态参数。此外,张新刚等[10]对费氏链霉菌的分批发酵动力学进行了研究,表明动力学模型对费氏链霉菌产新霉素的发酵生产具有实际意义;郑丽雪等[11]对酿酒酵母生产谷胱甘肽分批发酵动力学进行了研究,发现实验建立的发酵动力学模型能较好地反应谷胱甘肽的分批发酵过程。
国内外发酵动力学的研究多集中于工业产品开发和液体发酵方面,关于蜡蚧霉固体发酵的培养基和发酵技术虽有少量报道[12-16],但关于其固体发酵动力学的研究还未见报道。本文研究蜡蚧霉V3.4505菌株固体发酵过程中的代谢动力学特性,定量描述发酵过程中菌体孢子产量与碳源、氮源消耗之间的关系,建立了动力学模型,获得模型参数,以期为蜡蚧霉固体发酵过程相关指标的动态监测,各批次之间的质量控制,规模化生产提供依据。
1 材料和方法
1.1 菌种
蜡蚧霉V3.4505菌株,购于中国科学院微生物研究所国家菌种保藏中心,原寄主为稻褐飞虱(Nilaparvata lugens (Stdl))。
1.2 菌株的种子液制备
将培养好的斜面菌种孢子悬浮于无菌的体积分数0.1%吐温-80水中,制成5.0×107个/m L的孢子悬液。按体积分数5%的接种量接入无菌的液体培养基中(可溶性淀粉40 g;酵母浸出膏10 g;蛋白胨10 g;蒸馏水1 L)(装量:200 m L/1,000 m L三角瓶),25℃,150 r/min,摇床培养56 h。
1.3 固体发酵
配置固体培养基5 kg(质量分数:稻谷壳50%;麦麸35%;玉米粉15%;蒸馏水250 m L/kg),高压灭菌后(121℃,30 min),将发酵培养好的二级种子液,接入固定体培养基中(0.759×107个/g),搅拌均匀,分别装入5个提前消过毒的培养筐中,培养筐为通气的塑料筐(尺寸:长39.5 cm宽28 cm高15 cm),将培养基平散的铺在筐内纱布上(厚度约3 cm)。在25℃,70%RH的无菌培养室中连续培养15 d。
1.4 检测方法
1.4.1 产孢量的测定:培养过程中,每隔36 h取样1次。将取得的样品在40℃下烘3 h,取1 g干菌粉,加人50 m L无菌的0.1%吐温-80水中(150 m L锥形瓶),搅拌均匀,用血球计数板测定悬液中的孢子数量(设定5个平行实验)。
1.4.2 总糖的测定:每隔36 h取样1次,测定培养基中的总糖含量。采用3,5-二硝基水杨酸比色法[17](设定5个平行实验)。
1.4.3 总氮的测定:每隔36 h取样1次,测定培养基中的总氮含量。采用凯氏定氮法[18-19](设定5个平行实验)。
2 结果与分析
2.1 发酵过程的特征
观察发现,培养1 d后,固体培养基中表面可见少量的白色菌丝;1.5 d后产生少量的孢子;3 d后培养基的表面被白色的菌丝和孢子覆盖;培养5~6 d时,培养基内也布满了菌丝和孢子。
2.2 菌株产孢量随培养时间的变化
通过对菌株产孢量的连续检测,发现菌株生长经历了缓慢生长期、对数生长期、稳定生长期3个阶段(图1)。从接种后培养到第1.5天,菌体生长较慢,孢子产量增长只有0.510 8×107个/g,为缓慢生长期;第1.5天到第9天菌体生长很快,为对数生长期,孢子产量很快增长到8.901 2×107个/g;第9天开始进入稳定生长期,菌体的生长速率变缓,呈现较为稳定的特点。
2.3 底物消耗的变化
菌株固体培养过程中碳源和氮源的消耗测定结果显示(图2),在菌体缓慢生长期,碳源和氮源的消耗也较少,分别为3%和10%;进入对数生长期,菌体生长对底物的消耗量急剧加大,碳源消耗迅速,到第6天其消耗率高达38%;从7.5 d后开始进入稳定期,底物消耗的速度也变得缓慢,较为稳定,碳源消耗率一直保持在3%以内,这与菌体生长曲线的3个阶段相对应。氮源的快速消耗出现在前3天,其消耗率达到17%。第3天后氮源的消耗量减少,处于动态平衡的趋势,消耗率一直保持在5%以内。这可能是由于菌体在生长过程中对氮源的利用比碳源相对较少引起的。

Flg.1 Spore production curve in the solid-state fermentation by Lecanicillium lecanii图1 蜡蚧霉固体发酵产孢量变化曲线

Fig.2 Substrate consumption curve in the solid-state fermentation by Lecanicillium lecanii图2 蜡蚧霉固体发酵底物变化曲线
2.4 发酵动力学模型的建立
根据以上的数据可以建立菌体的产孢量的增长与底物消耗之间相关性的动力学模型。菌体在对数生长期生长迅速,所以消耗底物的速度最快,特别是对碳源的消耗量大。在菌体稳定生长期,底物的消耗量减少,碳源和氮源消耗的变化都趋向于一个稳定的状态。由此可以得出,菌体在发酵过程中的生长速率和底物的消耗速率是相关的。在此对蜡蚧霉V3.4505菌体生长和底物(总糖和总氮)消耗动力学进行拟合研究。
2.4.1 菌体生长动力学拟合:Verhulst-Pearl提出的Logistic方程能够很好地反映分批发酵过程中菌体生长的一般规律,常用于菌体生长动力学描述,是目前应用较为普遍的方程之一[20-21]。由于蜡蚧霉生长曲线为S形,由此可得菌体生长的Logistic方程[22]:

式中,Um为菌体最大比生长速率;Cx为菌体浓度;Cm为菌体最大浓度。Um、Cm为常数。
当t=0时,Cx=C0,方程积分变换为:

当初始条件t=0时,菌丝体浓度Cx等于接种后的菌丝体浓度。而最大比生长速率Um是以ln[Cx/(Cm-Cx)]对t作图所得到的直线斜率,截距为ln[Cx/(Cm-Cx)]。
则Um=0.748 5 d-1.
整理后,发酵菌体生长动力学模型为:

式中,t的单位为d表示。将模拟计算值与实验数据进行比较。

Fig.3 Comparison of the kinetic model of spore production with experimental data图3 产孢量动力学模型与实验数据比拟
2.4.2 底物消耗动力学拟合:由蜡蚧霉培养曲线(图1)可知,随着菌体的培养,底物中总糖和总氮含量不断下降,总糖含量的下降显示培养基为菌体生长提供了所需的碳源。把糖和氮作为限制性底物,在此基础上底物消耗的动力学方程可表示为[23-24]:
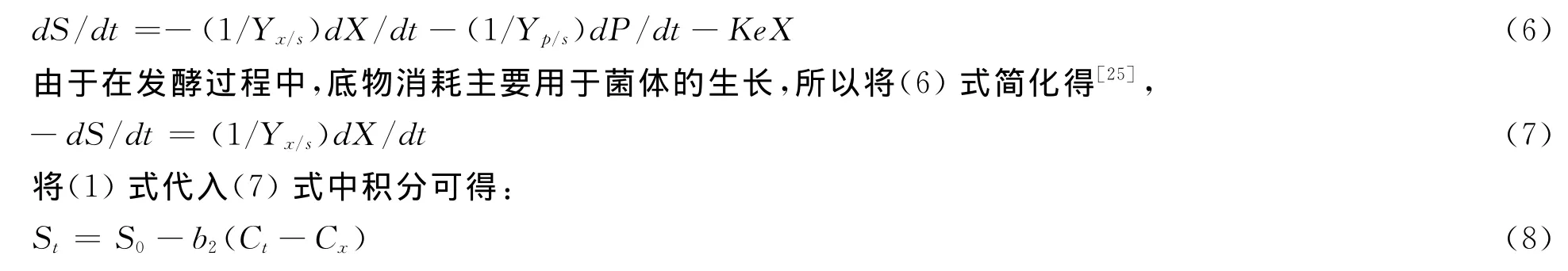
其中b2=1/Yx/s,式中的Yx/s是菌体对底物得率,1/Yx/s是底物对菌体的消耗率。
将实验数据进行非线性拟合,求出回归系数。依据菌体生长动力学模型参数,求得底物消耗动力学模型为:

根据以上动力学方程,绘制动力学模型与测定值比较曲线。
将蜡蚧霉V3.4505菌株固体发酵过程中的产孢量与底物中的总糖和总氮的实验值与模拟值列入表1,经计算后可以看出它们的实验值与模拟值之间的平均相对误差。在表1中以孢子产量结合底物的消耗的实验值与模拟值之间的误差大部分小于10%,但是其中3~6 d期间的误差较大,有的甚至达到17.5%,结合图4和图5可以看出,总糖和总氮的实验值与模拟值拟合度较高,分别为0.834 2和0.744 6.说明该模型能够较好地反应该菌体生长的实际情况和发酵过程中总糖和总氮的消耗关系。
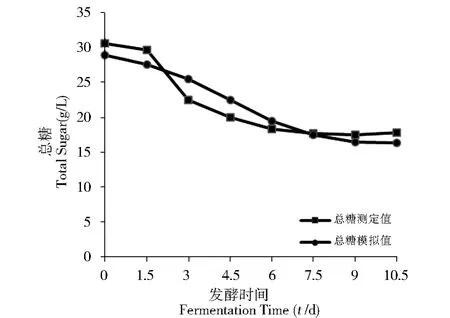
Fig.4 Comparison of kinetic model of total sugar with experimental data图4 总糖消耗动力学模型与实验数据比拟

Fig.5 Comparison of kinetic model of total nitrogen with experimental data图5 总氮消耗动力学模型与实验数据比拟

表1 产孢量和底物消耗测定值与模型计算值对比及误差表Table 1 Spore production and substrate consumption measured values calculated with the model comparison and error
3 讨论
考虑到菌种大批量生产的成本问题,固体培养基成分中稻谷壳占到50%。稻谷壳不仅为菌体生长提供营养,还改善了培养基的疏松度,利于通气和发酵过程中产生的热量散出,易于菌体生长。但是从蜡蚧霉菌体生长曲线(图1)看出,在发酵前期菌体要经历缓慢生长期,而稻谷壳中的纤维素含量较高,需要分解后才能被菌体吸收利用,因此,在实际工业化生产中可以考虑在培养基中加入适量的葡萄糖作为碳源,或其它能够帮助迅速降解培养基底物的酶类,以加速菌体前期的生长。研究中菌种固体培养是15 d,但从图1可以看出,菌体产孢量从第9天后进入稳定期;从图2可以看出,总糖的消耗量从7.5 d后进入稳定期,结合两张图可以得出在10 d时就可以进入蜡蚧霉的收获期,这可作为实际工业化生产中缩短菌体的培养周期和提高培养效率的参考。
本研究对蜡蚧霉V3.4505菌株发酵过程进行了初步的动力学研究,建立了以菌体产孢量为目标结合底物消耗的数学模型,其中总糖和总氮消耗模型的拟合度为0.834 2和0.744 6.结果表明所得模型较好地反映了菌株的生长动力过程及底物消耗情况,可以用来预测固体发酵过程中菌体生长、底物消耗的动力学关系,为实际生产中各项指标的监测和判断发酵是否正常提供了理论依据。
[1] Sung G H,Sung J M,Hywel-Jones N L.A Multi-gene Phylogeny of Clavicipitaceae(Ascom ycota,Fungi):Identification of Localized Incongruence Using a Combinational Bootstrap Approach[J].MolecularPhylogeneticsandEvolution,2007,44:1204-1223.
[2] Evans H C,Hywel-Jones N L.Entomopathogenic Fungi[M]//Ben-Dow Y,Hodgson CJ(Eds.),Soft Scale Insects:Their Biology,Natural Enemies and Control.Elsevier,Amsterdam & New York,1997,7B:15-16.
[3] Shah P A,Pell J K.Entomopathogenic Fungi as Biological Control Agents[J].Applied Microbiology Biotechnology,2003,61:413-423.
[4] Feng M G,Poprawski T J,Khachatourians G G.Production,Formulation and Application of the Entomopathogenic Fungus Beauveria Bassiana for Insect Control:Current Status[J].Biocontrol Science and Technology,1994,4(1):3-34.
[5] Zhao B,Wang L,Li F,et al.Kinetics of D-lactic Acid Production by Sporolactobacillus sp.Strain CASD using Repeated Batch Fermentation[J].Bioresource Technology,2010,101(16):6499-6505.
[6] Wang E Q,Li S Z,Tao L,et al.Modeling of Rotating Drum Bioreactor for Anaerobic Solid-state Fermentation [J].Applied Energy,2010,87:2839-2845.
[7] Mitchell D A,Cunha L E N,Machado A V L,et al.A Model-based Investigation of the Potential Advantages of Multi-layer Packed Beds in Solid-state Fermentation[J].Biochemical Engineering Journal,2010,48:195-203.
[8] Mazutti M A,Zabot G,Boni G,et al.Kinetics of Inulinase Production by Solid-state Fermentation in a Packed-bed Bioreactor[J].Food Chemistry,2010,120:163-173.
[9] Rodriguez-Fernandez D E,Rodriguez-Leon J A,de Carvalho J C,et al.The Behavior of Kinetic Parameters in Production of Pectinase and Xylanase by Solid-state Fermentation[J].Bioresource Technology,2011,102:10657-10662.
[10] 张新刚,史冠莹,陶科,等.费氏链霉菌 HTP6分批发酵动力学[J].微生物学通报,2009,36(3):311-315.
[11] 郑丽雪,王立梅,梅艳珍,等.酿酒酵母生产谷胱甘肽分批发酵动力学研究[J].食品科学,2011,32(1):158-161.
[12] Soni N,Prakash S.Larvicidal Effect of Verticillium Lecanii Metabolites on Culex Quinquefasciatus and Aedes Aegypti Larvae[J].Asian Pacific Journal of Tropical Disease,2012,2(3):220-224.
[13] Liu B L,Kao P M,Tzeng Y M,et al.Production of Chitinase from Verticillium Lecanii F091 Using Submerged Fermentation [J].Enzyme and Microbial Technology,2003,33(4):410-415.
[14] 李国霞,高希武,刘青春,等.蜡蚧轮枝菌的发酵技术及其代谢产物对害虫毒杀作用的初步研究[J].中国农业大学学报,1995,21(4):409-415.
[15] 谢明,邱卫亮,万方浩,等.蜡蚧轮枝菌的固体发酵培养基的筛选[C]//胡萃,陈家安.城市昆虫学进展.全国城市昆虫学术讨论会证文集.杭州:浙江大学出版社,2001:173-177.
[16] 李峰,阴华,蒋继宏,等.蜡蚧轮枝菌固体培养条件研究[J].江苏农业科学,2004,32(4):57-59.
[17] 黄翊鹏,祁静,郑亚军,等.3,5-二硝基水杨酸法测定椰子纳塔发酵液中总糖含量研究[J].广东农业科学,2009,12:171-174.
[18] 中华人民共和国卫生部,中国国家标准化管理委员会发布.食品中蛋白质的测定[S].中华人民共和国国家标准,GB/T5009.5-2003.北京:中国标准出版社,2004:35-41.
[19] 孔祥平,王娟,曲秋世,等.凯氏定氮法测定虾壳中氮含量[J].实验室研究与探索,2011,30(6):37-39.
[20] 张龙翔,张庭芳,李令媛.生化试验方法和技术[M].北京:高等教育出版社,1997:1-3.
[21] 殷祚云.Logistic曲线拟合方法研究[J].数理统计与管理,2002,21(1):41-46.
[22] 伦世仪.生化工程 [M].北京:中国轻工业出版社,1993:113-114.
[23] 房耀维,余勃,刘姝,等.有机溶剂稳定性蛋白酶发酵动力学研究[J].食品科学,2012,33(23):240-243.
[24] 林巧,李燕红,孙小波,等.樱桃果酒发酵动力学研究[J].中国酿造,2009,28(7):65-68.
[25] Weiss R M,Ollis D F.Extracellular Microbial Polysaccharides I.Substrate,Biomass,and Product Kinetic Equations for Batch Xanthan Gum Fermentation [J].Biotechnology and Bioengineering,1980,22(4):859-873.

