生物酶解法提取甘蔗糖厂滤泥中叶绿素的研究
李 宁,陈宝娣,刘洪波,郭继强
(大连工业大学生物工程学院,辽宁大连 116034)
叶绿素是一种天然色素,是植物进行光合作用的主要色素,它是由能与多种金属原子结合的叶琳与镁原子结合的产物[1]。叶绿素作为一种天然食用色素,如叶绿素的衍生物叶绿素铜钠盐,广泛应用于食品行业。叶绿素也可以作为医药产品上的着色剂并且有一定的医疗用途,叶绿素有极好的消炎、促进愈合作用,还保肝护肝功能[2-4]。目前,叶绿素药物非常之多,这些产品的开发为社会创造了很大的经济效益。因此对于叶绿素的研究具有极大的价值和意义。
甘蔗糖厂在制糖过程中产生大量的滤泥,如若长期堆弃,不仅污染环境,而且会造成资源的浪费。滤泥中有大量的叶绿素,至今还未很好利用,多数糖厂只是将其出售给农民做肥料。若能将滤泥中的叶绿素提取出来,将大大提高糖厂的经济效益[5]。叶绿素存在于甘蔗糖厂滤泥中甘蔗渣细胞中。在甘蔗糖厂滤泥叶绿素提取过程中,由于甘蔗细胞壁的束缚作用,叶绿素不易溶出[6]。甘蔗细胞壁主要由纤维素和果胶组成。纤维素酶和果胶酶能将组成细胞壁的纤维素和果胶骨架降解进而破坏细胞壁骨架结构,增加细胞内叶绿素的溶出。
本实验通过外源添加纤维素酶、果胶酶并结合溶剂萃取提取叶绿素,研究混合酶比例及用量、混合酶酶解温度、混合酶酶解时间以及料液比对甘蔗糖厂滤泥中叶绿素提取的影响,并应用响应面法优化其提取工艺,旨在提高甘蔗糖厂滤泥的利用价值。为甘蔗糖厂工业化提取叶绿素提供一定的理论参考。
1 实验材料与方法
1.1 材料与仪器
甘蔗糖厂滤泥:广西合浦西场永鑫糖业有限公司;纤维素酶(35u/mg):上海源叶生物科技有限公司;果胶酶(40u/mg):solarbio公司;95%乙醇分析纯:天津市科密欧化学试剂有限公司。
搅拌机:广东美的精品电器制造有限公司;YP402N电子天平:上海精密科学仪器有限公司;恒温振荡器:巩义市英峪予华仪器厂;循环水式真空泵:巩义市英峪予华仪器厂;UV-2000型紫外可见分光光度计:龙尼柯(上海)仪器有限公司。
1.2 实验方法
1.2.1 叶绿素测定
本实验采用分光光度法测定叶绿素含量,主要是以Arnon计算法为基础。叶绿素质量浓度的Arnon 法计算公式:
Ca/(mg/L)=12.7A663-2.69A645
Cb/(mg/L)=22.9A645-4.68A663
C总/(mg/L)=Ca+Cb
式中Ca、Cb为叶绿素a、b的质量浓度;C总为总叶绿素的质量浓度;A663、A645分别为叶绿素溶液在波长663nm和645nm处的吸光度。
1.2.2 生物酶解法提取甘蔗糖厂滤泥中叶绿素的方法
称取2g干燥且粉碎成粉末的甘蔗糖厂滤泥,置于100mL三角瓶中,按不同料液比加入95%乙醇,然后加入一定量的纤维素酶和果胶酶,在恒温振荡器中,一定酶解温度和一定酶解时间下水浴振荡。真空抽滤得到提取液,收集滤液,滤渣用同浓度提取溶剂反复洗涤几次,滤出洗液至提取液中,记录提取液的总体积,通过紫外可见分光光度计测出663、645nm处的吸光度,根据Arnon 公式即可计算出提取液中叶绿素的总含量。
1.2.3 单因素试验
选取纤维素酶用量、果胶酶用量、混合酶比例、混合酶酶解温度、混合酶酶解时间、料液比6个因素进行研究,利用单因素实验选取各个因素的较优水平。
1.2.3.1 纤维素酶用量 称取粉碎后的干滤泥粉末 2g分别放入 5个 100ml三角瓶中,按料液比1∶8加入95%乙醇,固定酶解温度为50℃,酶解时间为3 h,分别以加入纤维素酶的量 0.2、0.4、0.6、0.8、1.0g/100g为实验点,每组三个平行,考察加入纤维素酶的量对叶绿素提取的影响。
1.2.3.2 果胶酶用量 参考实验步骤1.2.3.1,加入果胶酶的量分别为0.2、0.4、0.6、0.8、1.0g/100g,每组三个平行,考察加入果胶酶的量对叶绿素提取的影响。
1.2.3.3 纤维素酶和果胶酶混合比例 称取粉碎后的干滤泥粉末 2g分别放入7个100ml三角瓶中,按料液比1∶8加入95%乙醇,固定酶解温度为50℃,酶解时间为3 h,加入总酶量为1.6g/100g,分别以加入纤维素酶和果胶酶酶质量比 4:1、3:1、2:1、1:1、1:2、1:3、1:4为实验点,每组三个平行,考察纤维素酶和果胶酶混合比例对叶绿素提取的影响。
1.2.3.4 混合酶酶解温度 称取粉碎后的干滤泥粉末2g分别放入6个100ml三角瓶中,按料液比1∶8加入95%乙醇,固定酶解时间为3 h,纤维素酶和果胶酶混合比例为2:1,混合酶总量为1.6g/100g,分别以混合酶酶解温度20、30、40、50、60、70 ℃为试验点,每组三个平行,考察不同酶解温度对叶绿素提取的影响,
1.2.3.5 混合酶酶解时间 参考实验步骤 1.2.3.4,固定酶解温度为 50℃,以混合酶酶解时间1、2、3、4、5、6h为试验点,每组三个平行,考察不同酶解时间对叶绿素提取的影响。
1.2.3.6 料液比 参考实验步骤 1.2.3.4,固定酶解温度为 50℃,酶解时间为 3h,以料液比 1 ∶7、1 ∶8、1 ∶9、1∶10、1∶11、1∶12 为试验点,每组三个平行,考察不同料液比对叶绿素提取量的影响。
1.2.4 响应面法实验设计
在单因素实验基础上,根据中心组合实验设计原理对提取条件进行优化。设计三因素三水平的响应分析实验,选取混合酶酶解温度、混合酶酶解时间和料液比,分别以X1,X2 ,X3表示,每一个自变量的低、中、高实验水平分别以-1,0,1进行编码,以叶绿素提取量(mg.g-1)为响应值(Y),利用响应面实验结果,确定叶绿素最佳提取工艺[7-10]。实验因素与水平见表1。
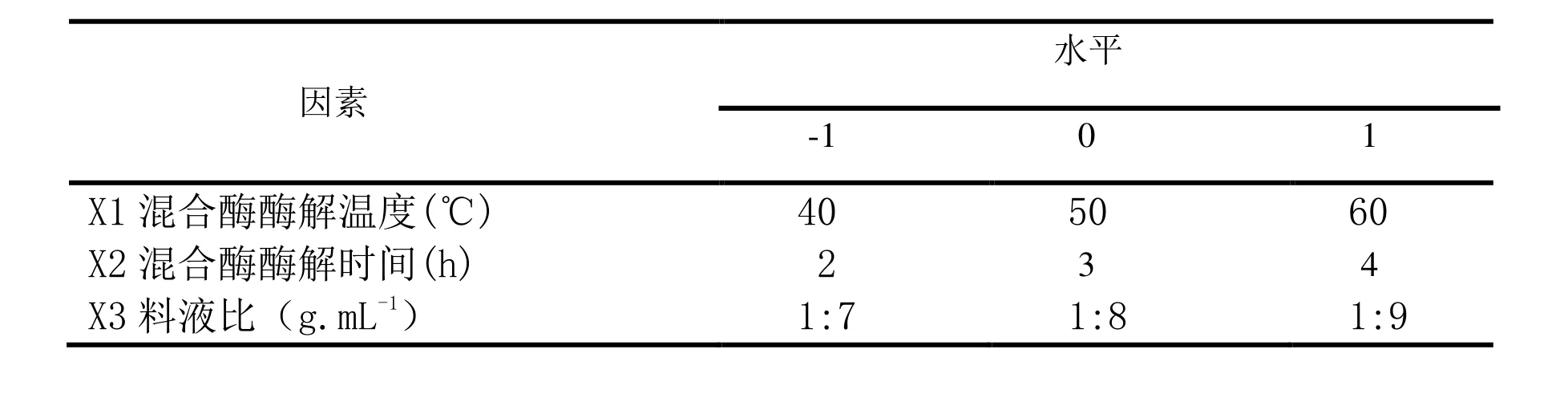
表1 响应面分析因子和水平表Table 1 Factors and levels of response surface experiments
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 纤维素酶对叶绿素提取量的影响

图1 纤维素酶对叶绿素提取量的影响Fig.1 Effects of cellulase on extraction yield of chlorophyll
从图1可以看出,当纤维素酶质量分数在0.2%~0.8%之间时, 叶绿素的提取量随着纤维素酶质量分数的增加而增加,0.8%时叶绿素提取量达到最大,0.8%以后叶绿素的提取量随着纤维素酶质量分数的增加而减少。可能是因为纤维素酶用量较低时,纤维素酶对细胞壁的破坏程度随用量的增大而增大,细胞内膜的通透性增大,叶绿素的提取量增大。当超过最佳值时,造成纤维素酶分子过饱和,部分酶分子无法与底物结合,底物水解速度降低造成叶绿素提取量减少[11]。
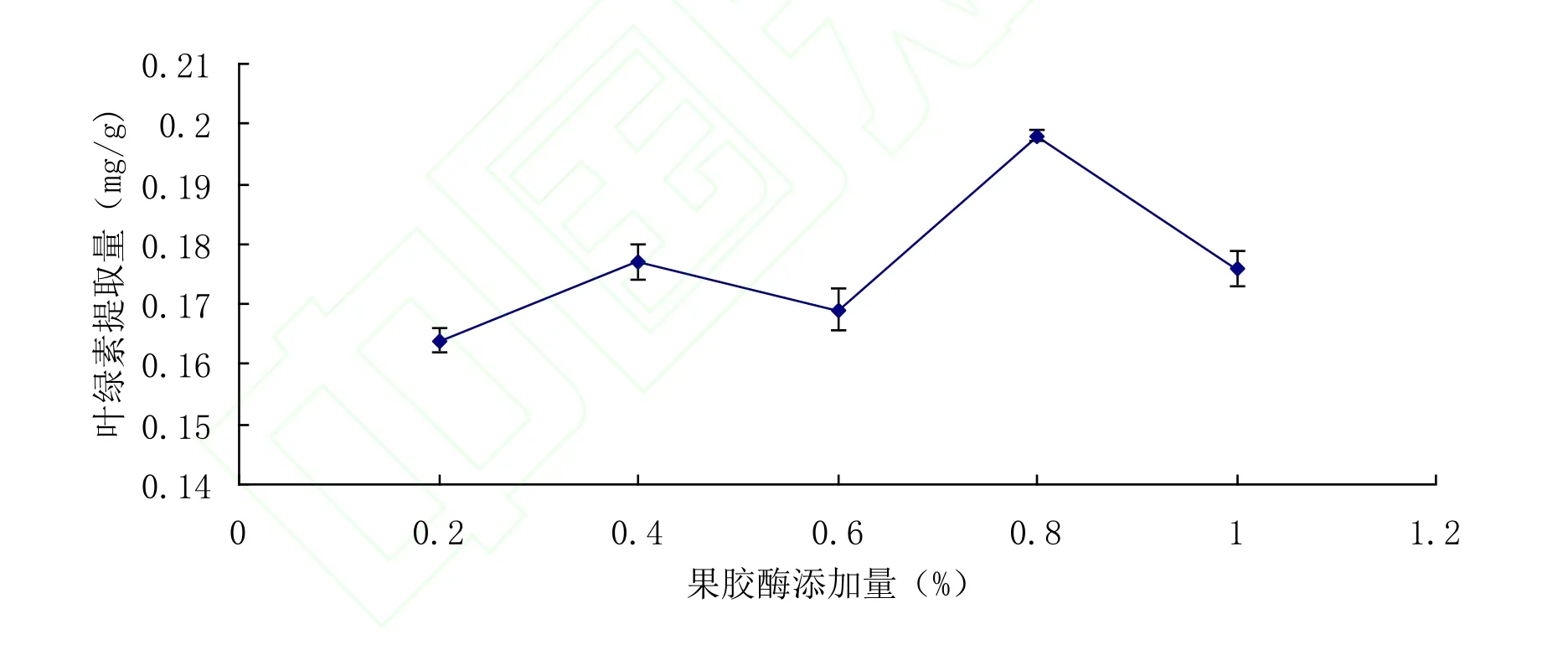
图2 果胶酶对叶绿素提取量的影响Fig.2 Effect of pectinase on extraction yield of chlorophyll
2.1.2 果胶酶对叶绿素提取量的影响从图2可以看出,果胶酶质量分数为0.8%时叶绿素的提取量最高。这是因为在实验条件下,酶量低于最佳值时,酶解反应未进行完全;达最佳值时酶解反应进行较完全,此时如果继续加大酶量,底物浓度不能对酶达到饱和导致酶的作用受到抑制[12]。
2.1.3 纤维素酶和果胶酶混合比例对叶绿素提取量的影响

图3 混合酶比例对叶绿素提取量的影响Fig.3 Effect of Mixed enzyme proportion on extraction yield of chlorophyll
从图3可以看出,不同质量比的混合酶效果不相同,其中纤维素酶和果胶酶质量比为2:1时叶绿素的提取量最高。说明复合酶两者的协同作用可以加速甘蔗细胞结构的崩解,改变细胞壁通透性,有利于叶绿素从细胞内溶出。从而提高了叶绿素的提取量。因此,取最佳纤维素酶和果胶酶质量比为2:1。可能是因为甘蔗细胞壁中纤维素含量多于果胶的含量,也可能是因为纤维素酶较果胶酶而言不容易充分发挥功效。
2.1.4 混合酶酶解温度对叶绿素提取量的影响

图4 混合酶酶解温度对叶绿素提取量的影响Fig.4 Effect of enzymolysis temperature of Mixed enzyme on extraction yield of chlorophyll
从图4可以看出,开始阶段随着温度的升高,叶绿素提取量迅速升高,当温度达到 50℃时,叶绿素的提取量达到最大,50℃以后叶绿素的提取量呈下降趋势。这是因为温度对酶具有双重作用。温度升高时,酶的活化分子数增多,有利于酶催化反应的进行,酶解反应速度加快,温度继续升高时,会导致酶变性失活,造成酶活性降低[13]。因此选择混合酶反应最佳温度为50℃。
2.1.5 混合酶酶解时间对叶绿素提取量的影响
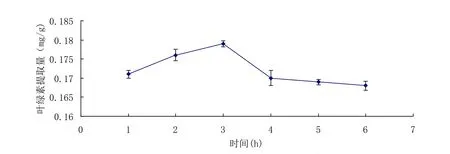
图5 混合酶酶解时间对叶绿素提取量的影响Fig.5 Effect of enzymolysis time of Mixed enzyme on extraction yield of chlorophyll
从图5可以看出,反应时间在1~3h时,叶绿素的提取量随时间的延长而迅速升高,3h时叶绿素提取量达到最大,3h后叶绿素提取量随时间延长而逐渐下降。3h时叶绿素提取量达到最大值是因为随着酶解时间的延长,酶活力得到充分利用,酶解反应进行得较完全,叶绿素提取量达到最大[14]。3h后叶绿素提取量逐渐下降是因为叶绿素本身不稳定,受周围环境的影响,长时间处于此环境中导致其分解。因此混合酶最佳反应时间为3h。
2.1.6 料液比对叶绿素提取量的影响

图6 料液比对叶绿素提取量的影响Fig.6 Effect of material to liquid ratio on extraction yield of chlorophyll
从图6可以看出,当料液比为1:7~1:8时,叶绿素的提取量随着料液比的增加而升高,1:8时叶绿素提取量达到最大,1:8之后,叶绿素的提取量反而逐渐下降。这是因为当酶用量固定时,随着料液比的增加,液体在甘蔗渣细胞内扩散能力增强,利于酶对细胞壁结构的降解,使细胞组织迅速被破坏,叶绿素得以释放[15]。但随着固液比的增加,酶的浓度随之降低,叶绿素提取量也随之降低。
2.2 响应面分析法对生物酶解法提取甘蔗糖厂滤泥中叶绿素工艺的优化
2.2.1 响应面分析实验方案及结果
在单因素实验基础上,选择混合酶酶解温度(X1)、混合酶酶解时间(X2)、料液比(X3)为自变量,叶绿素提取量(Y)为响应值,利用统计软件Design-Expert.V8.0.6 设计三因素三水平试验对生物酶解法提取甘蔗糖厂滤泥中叶绿素工艺进行优化。实验方案与结果见表2。
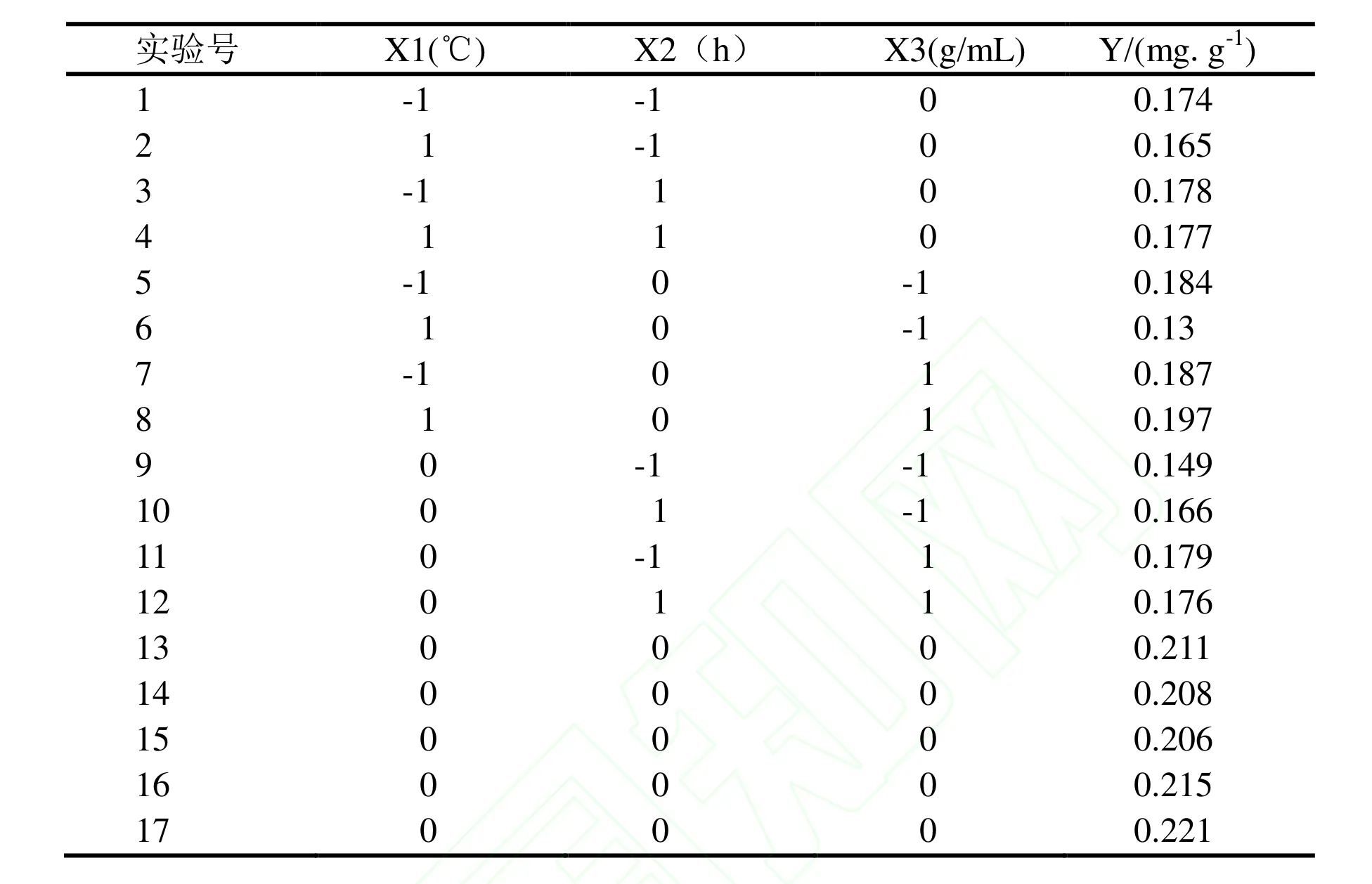
表2 响应面试验设计及结果Table 2 Response surface experimental design and results
2.2.2 拟合回归方程的建立
利用Design-Expert.V8.0.6软件对表2 中的试验数据进行多项式回归拟合,得到叶绿素提取量( Y) 对混合酶酶解温度( X1)、混合酶酶解时间( X2)、料液比( X3)3 个因素的二次多项回归方程如下:

表3为以上二次多项回归方程的方差分析和显著性检验结果。由表3可以看出回归模型达到极显著水平(0.01〉P=0.0005),失拟项不显著( 0. 05 <P= 0.2080),表明该二次多项回归方程对实验拟合情况好,实验误差小。并且该模型的R2= 95.74%,显示该方程可靠性较高,C.V=4.12,C.V较低,显示实验稳定性越好。综上说明该模型与实际实验拟合较好,自变量与响应值之间线性关系显著,可以用于生物酶解法提取甘蔗糖厂滤泥中叶绿素实验条件的预测。由表3方差分析结果表明,方程的一次项X3和四个二次项X12,X22。X32,X1X3对方程的影响极显著,一次项X1对方程的影响显著,表明实验中各因素对甘蔗糖厂滤泥中叶绿素提取量的影响不是简单的线性关系。实验因素的 F值可以反映出因素对实验指标的重要性,F值越大,表明对实验指标的影响越大,即重要性越大。从方差分析表可知:FX1=6.37,FX2=1.97,FX3=26.45,即各因素对叶绿素提取量的影响顺序为:X3> X1> X2,即料液比影响最大,混合酶反应温度次之,最后为混合酶反应时间。
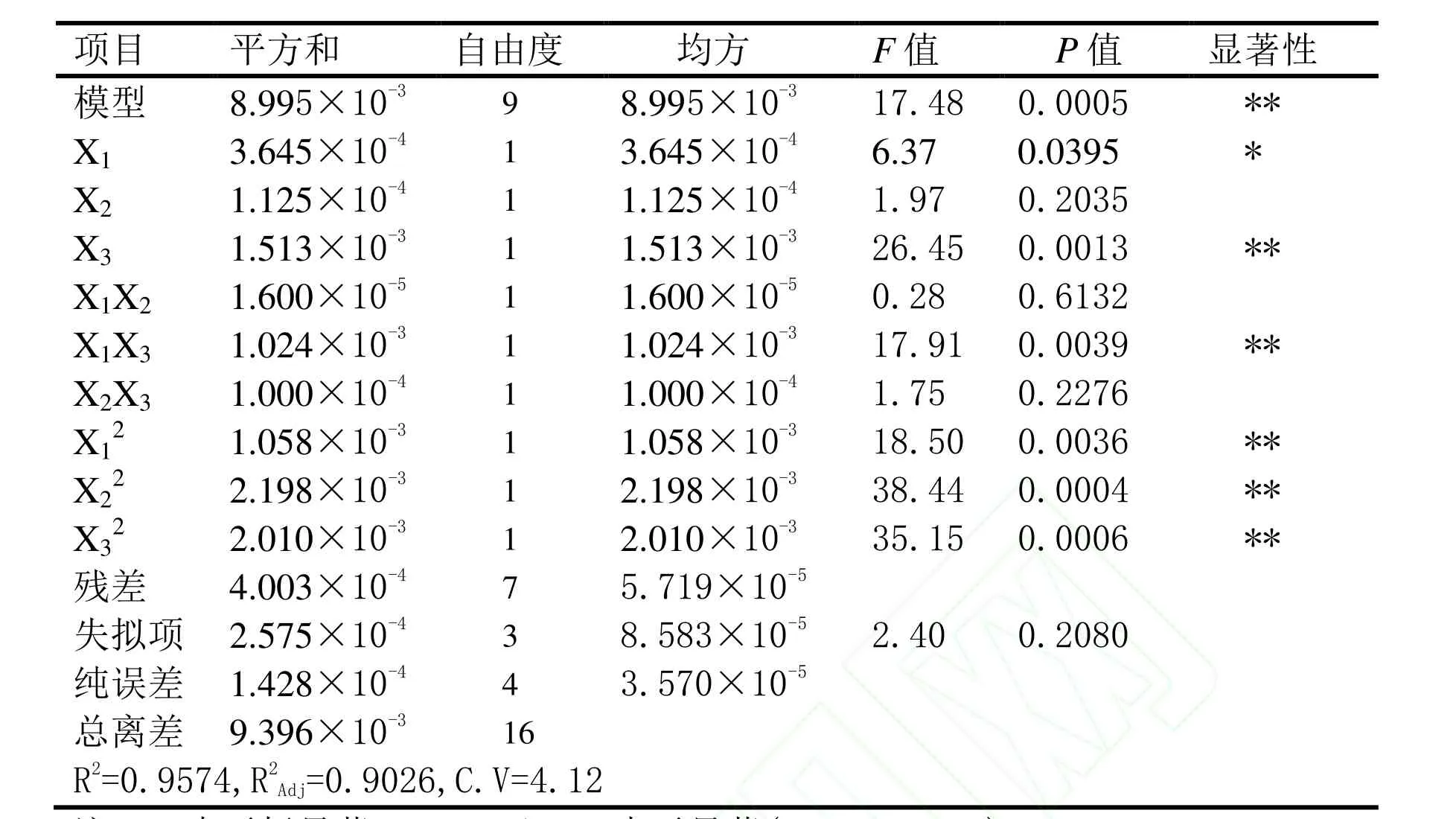
表3 回归方程方差分析表Table 3 Analysis results of regression and variance
2.2.3 响应面分析
根据回归方程做出相应的响应面分析图,来考察混合酶酶解温度、混合酶酶解时间、液料比3个因素对生物酶解法提取叶绿素的影响,结果见图7-9。

图7 混合酶酶解温度与混合酶酶解时间对叶绿素提取量影响的响应面图Fig.7 Response surface of mixed enzyme temperature and Mixed enzyme time on the yield of chlorophyll

图8 混合酶酶解温度和料液比对叶绿素提取量影响的响应面图Fig.8 Response surface of mixed enzyme temperature and the ratio of material to liquid on the yield of chlorophyll
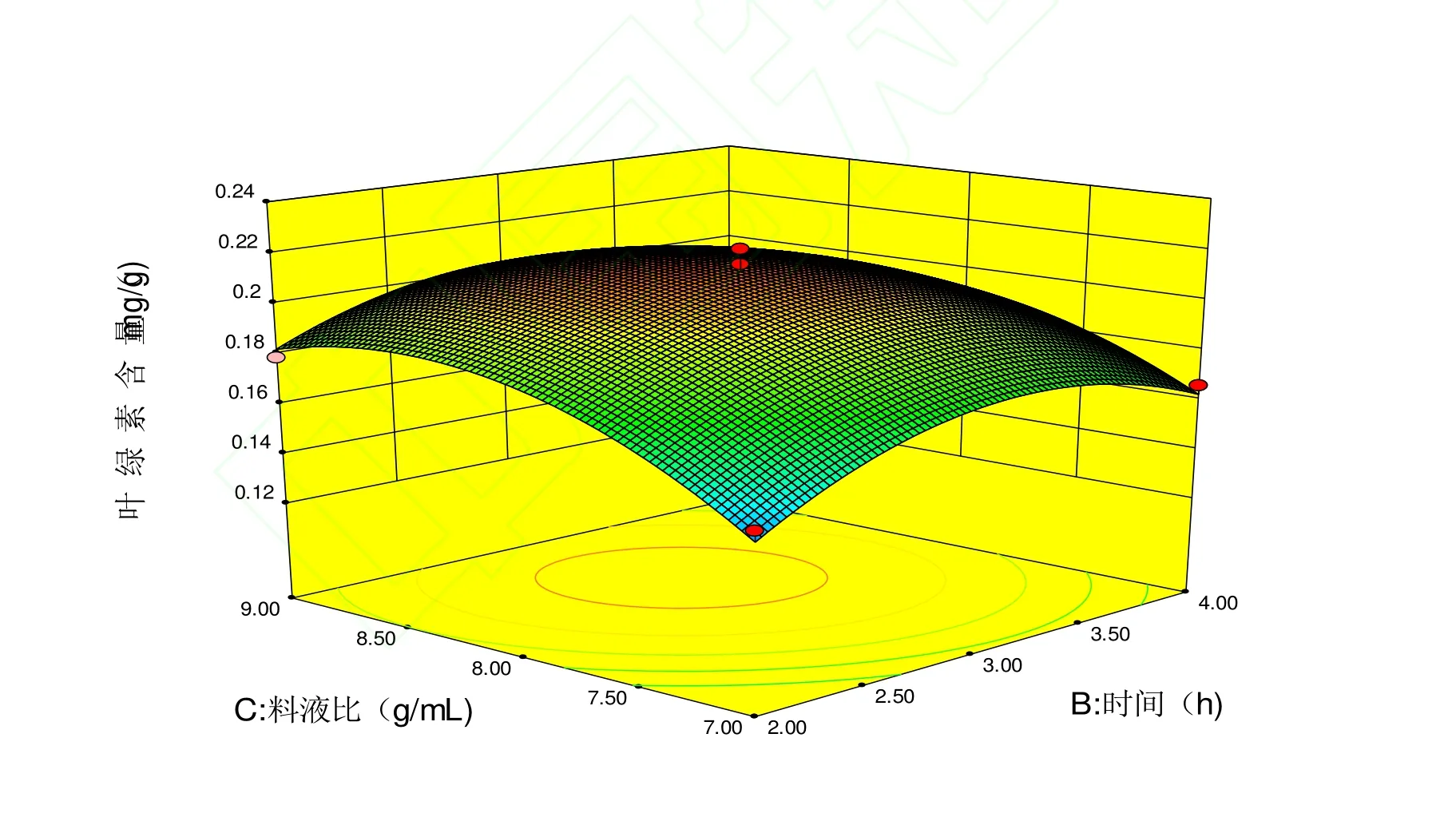
图9 混合酶酶解时间和料液比对叶绿素提取量影响的响应面图Fig.9 Response surface of mixed enzyme time and the ratio of material to liquid on the yield of chlorophyll
2.2.4 最优工艺条件的确定和实验验证
通过Design-Expert.V8.0.6软件对回归方程进行分析处理,获得最优工艺参数为:混合酶酶解温度49.35℃,混合酶酶解时间3.05h,料液比1∶8.29,在此最优工艺条件下叶绿素的提取量为0.215 mg.g-1。考虑到实际操作的可行性,将工艺参数修正为:混合酶酶解温度49℃,混合酶酶解时间 3h,料液比1:8,在此条件下进行3 次验证试验,测的叶绿素提取量的平均值为0.211 mg.g-1,与理论值相比,其相对误差为1.86%,说明响应面法优化生物酶解法提取甘蔗糖厂滤泥中叶绿素工艺条件切实可行。按响应面法优化得到的最佳生物酶解法提取条件和传统溶剂法提取甘蔗糖厂滤泥中的叶绿素,比较两种方法,结果见表4

表4 两种方法的叶绿素提取结果对比Table 4 Comparison of extraction rates of chlorophyll extracted by two methods
从表 4 可知,生物酶解法提取的叶绿素的量均高于传统溶剂提取法,通过计算平均值可以看出生物酶解法提取的叶绿素的量比传统溶剂法高出8%左右。
3 结论
本文在单因素实验的基础上,采用响应面分析法对生物酶解法提取甘蔗糖厂滤泥中叶绿素工艺进行了优化,结果表明各因素指标之间的关系不是简单的线性关系,而是二次关系。通过响应面法分析可知,混合酶酶解温度、混合酶酶解时间、液料比3个因素对叶绿素提取量的效应趋势,液料比对叶绿素提取量影响较大,混合酶酶解温度次之,最后为混合酶酶解时间。通过回归方程优化得出生物酶解法提取甘蔗糖厂滤泥中叶绿素的最佳工艺为:混合酶酶解温度 49℃,混合酶酶解时间3h,料液比1:8。Box-Behnken试验设计能充分发挥纤维素酶和果胶酶的酶解作用,有效提高甘蔗糖厂滤泥中叶绿素的提取量。采用响应面分析法得到的生物酶解法提取甘蔗糖厂滤泥中叶绿素工艺准确可靠,具有实用价值,为其在农业、医药和食品等领域的开发利用提供了依据。
[1]江波,杨瑞金,卢蓉蓉,等.叶绿素种类[J].食品化学,2006(2):264-267.
[2]杨熙鸿,纪平雄,黄自然.叶绿素及其衍生物的应用[J].广东蚕业,1998,32(2):53-58.
[3]David S,Stuart H.Extraction and quantification of chlorophyll a from freshwater green algae[J]. Water research,1998,32 (7):2220-2223
[4]Nuray K, Feryal K, Hande S B. Effect of pH on chlorophyll degradation and colour loss in blanched green peas[J]. Food Chemistry,2006,23(5):609 -615.
[5]郭海蓉,王晓飞,李媛媛.甘蔗糖厂滤泥中叶绿素微波辅助提取工艺优化[J].食品科学,2011,32(16):201-205.
[6]丁信红,孙杰,喻治霞,等. 纤维素酶辅助提取银杏叶总黄酮的工艺条件[J].林业科技开发,2009,23(4):66-68.
[7]刘剑青,肖小年,许英伟,等.响应面法优化藠头中皂苷的提取工艺研究[J].食品工业科技,2013,34(1):254-257.
[8]贾贵华,任雪峰,吴冬青,等.响应面分析法优化党参总黄酮提取工艺研究[J].中兽医医药杂志,2013(1):13-16.
[9]张维,李雪雁,张秀兰,等. 响应面分析法优化菊芋渣中蛋白的提取工艺[J].食品工业科技,2012,33(1):305-209.
[10]王瑛,张本印,牛江进,等. 响应面分析法优化乳白香青中绿原酸提取工艺[J].食品工业科技,2013,34(2):238-241.
[11]陈公德,何日柳,陈杰,等. 生物酶解法提取苦楝素工艺过程的研究[J].应用化工,2010,39(1):8-11.
[12]侯纯明,何 美,周华锋. 酶解法提取番茄红素的研究[J].沈阳化工学院学报,2006,20(2):89-91.
[13]徐玉霞,王华斌. 酶法提取海红果总黄酮工艺及海红果黄酮粗提物对 HeLa细胞的增殖作用[J].中国农业大学学报,2013,18(1):119-127.
[14]袁春龙,张 金. 纤维素酶和果胶酶对番茄红素提取的影响[J].食品科学,2010,31(13):100-104.
[15]赵玉红,苗雨,张立钢. 双酶法提取蓝靛果果渣中花色苷酶解条件的研究[J].中国食品学报,2008,8(4):75-79.

