内蒙古地区白刺属植物主要活性成分含量比较研究
薛焱,王同智,薛永志,刘欣媛,张东 ,李月玲,高洪波
(1.包头医学院基础学院,包头 014060;2.内蒙古大学生命科学学院,呼和浩特 010021)
白刺属(Nitraria L.)是蒺藜科(Zygophyllaceae)的一个古老小属[1],全世界约有13种,分布广泛,分布于亚洲、欧洲、非洲和澳大利亚的荒漠。我国有8种[2],主要分布于我国西北部及北部各省区。在内蒙古地区白刺资源十分丰富,分布有唐古特白刺(Nitraria tangutorum Bobr.)、西伯利亚白刺(Nitraria sibirica Pall)(即小果白刺)、齿叶白刺(Nitraria roborowskii Kom.)(即大果白刺)和球果白刺(Nitraria sphaerocarpa Maxim.)(即泡泡刺)等四种[3,4]。白刺果营养价值很高,其味甜带酸,兼有葡萄和樱桃香味,形状、大小都类似樱桃,故有“沙漠樱桃”之美称。白刺果实中含有黄酮、生物碱、氨基酸、维生素和矿物质元素等成分,药理学研究表明白刺除具有调血脂作用外,还有调节免疫、抗疲劳、抗氧化、抗疲劳、保肝及抗肿瘤抗癌等作用,其所含黄酮类和生物碱类化合物是其重要活性成分[4-6]。迄今未见对4种白刺总黄酮和生物碱类化合物的含量的比较研究,本研究以4种白刺为材料,通过其总黄酮和生物碱类化合物的含量的测定、比较和分析,希望为白刺活性物质及白刺资源开发利用的研究提供更多的科学依据。
1 材料与方法
1.1 材料与仪器
白刺于2010年7月分别采自内蒙古临河境内,经内蒙古大学生命学院植物教学研室鉴定为唐古特白刺、西伯利亚白刺、小果白刺和的球果白刺果实和叶片。每个区域选4种白刺分别选取20~30株生长良好的植株,在其中、上部位的东、南、西、北4个方向分别采集果实和叶,自然风干后干燥,粉碎并过50目筛备用;芦丁标准品 中国药品生物制品鉴定所(批号:100080-200707和100040-200710);硫酸阿托品标准品 中国药品生物制品鉴定所(批号:100080-200707和100040-200710);乙醇、亚硝酸钠、氢氧化钠、溴甲酚绿、邻苯二甲酸氢钾、碳酸钠、硫酸、氯仿 均为分析纯。
UV-3010紫外分光光度计 日本岛津;BS110S型电子分析天平 德国Startorius公司。
1.2.实验方法
1.2.1 白刺总黄酮的测定 4种白刺果实总黄酮的测定,以芦丁为标准品,利用紫外分光光度计进行测定,具体方法如下:
1.2.1.1 对照品溶液的制备 精密称取120℃干燥至恒重的芦丁对照品6.05mg,置25mL容量瓶中,加70%乙醇20mL,密塞,超声使其溶解,冷却后加70%乙醇定容至刻度,摇匀,获得浓度为0.242mg/mL芦丁标准溶液[7,8]。
1.2.1.2 标准曲线的绘制 将浓度为0.242mg/mL的芦丁标准溶液,精确量取0.0、0.2、0.5、1.0、2.0、3.0、4.0mL,分别置于10mL容量瓶中,加入5%的亚硝酸钠溶液0.4mL,摇匀,放置6min,再加入10%的硝酸铝溶液0.4mL,摇匀,放置6min,最后加入4%的氢氧化钠溶液4mL,振摇并加水至刻度,放置15min。在200~600nm波长范围进行吸收光谱扫描,以不加标准品同法制备空白对照,显示在503nm处有最大吸收,因此选择503nm为测定波长。
1.2.1.3 样品溶液的制备及测定 精密称取2.5g白刺样品,以料液比1:7加入70%的乙醇,浸泡12h,加热回流提取3次,每次2h,抽滤、合并3次滤液,并用少量70%乙醇洗涤,洗液并入滤液中,定容至50mL的容量瓶中,摇匀,作为待测原溶液。依1.2.1.2项中方法显色,测定。
1.2.2 白刺总生物碱含量测定
1.2.2.1 溴甲酚绿缓冲液的配制及对照品溶液的配制 称取溴甲酚绿125mg,用0.2mol/L的NaOH12.5mL溶解后,加入邻苯二甲酸氢钾2.55g,加少量蒸馏水溶解,转移至250mL容量瓶中,用蒸馏水稀释至刻度,摇匀,调pH4.42,备用。称取在120℃干燥至恒重的硫酸阿托品对照品25.0mg,置于25.0mL容量瓶中,加水溶解至刻度,摇匀。精密量取5.0mL置于100mL量瓶中,加水稀释至刻度,即得50.0μ g/mL对照品溶液[9]。
1.2.2.2 供试品溶液制备和测定 称取4种白刺果实和叶片样品各50.0g于500mL圆底烧瓶中,加300mL95%乙醇,置于80℃水浴回流提取3h,滤出提取液,再加300mL 95%乙醇同法提取 1次,过滤,合并滤液,旋转蒸发仪浓缩至糖浆状。提取物用 2%硫酸溶解,合并酸水液,过滤。滤液以5%碳酸钠碱化至pH9~10,用氯仿萃取3次,每次20mL,合并氯仿液并挥干,残留物以2%硫酸溶解,将pH值调为7.0,加水定容于100mL容量瓶中,即得供试品溶液[10]。
1.2.2.3 标准曲线的绘制 分别量取对照品溶液 0.0、1.0、2.0、3.0、4.0、5.0、6.0mL置于 25mL分液漏斗中,各加水至 7.0mL,加入溴甲酚绿溶液(pH=4.42)4.0mL,摇匀。再分别加入氯仿15.0mL,密塞瓶口振摇3min,静置1h后取澄清的氯仿液,置于25mL容量瓶中,定容,摇匀。按1.2.2.2制备方法操作制备对照液、供试液和空白液,移至1cm比色池中,在200~800nm波长范围内进行光谱扫描,对照品溶液和样品溶液显色后在418nm处均有最大吸收值,故选定418nm作为测定波长。以浓度为横坐标,吸光度为纵坐标绘制标准曲线。
2.结果与分析
2.1 白刺总黄酮的测定
2.1.1 方法学考察
2.1.1 精密度实验 取对照品溶液,按照“标准曲线”操作方法连续测定6次,结果见表1。RSD为1.66%。
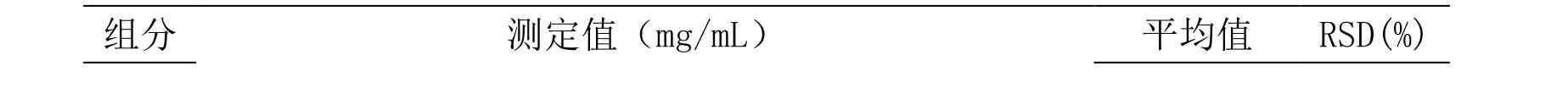
表1 精密度实验Table 1 Precision of the measured results

名称 1 2 3 4 5 6 (mg/mL)芦丁 0.0603 0.0598 0.0619 0.0603 0.0624 0.0609 0.0609 1.66
2.1.2 重复性实验 照上述方法,对同一供试品溶液样品进行5次平行试验,结果见表2。测得RSD为1.77%,表明此方法有良好的重复性。
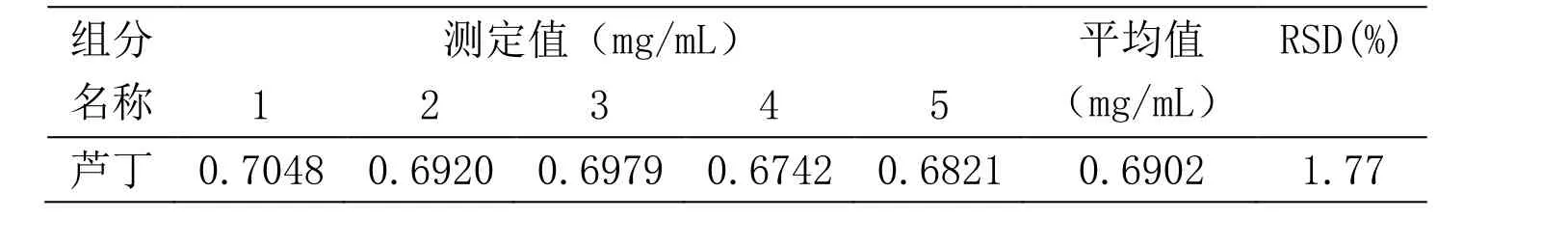
表2 重复性实验Table 2 Reproducibility of the measured results
2.1.3 稳定性实验 在室温条件下,将供试品溶液放置0、2、4、6、8、12h,按照上述方法进行测定,结果见表3。RSD为1.42%,说明供试品溶液在12h内稳定。

表3 稳定性实验Table 3 Stability of the measured results
2.1.4 加样回收率实验 采用加样回收法取已知含量的供试品溶液9份(三组),分别加入标准品溶液,依1.2.1.2项中方法显色、测定总黄酮的含量。结果见表4,显示平均回收率为98.84%,RSD=1.99%。

表4 总黄酮加样回收率测试结果Table 4 Recoveries of the measured results
2.1.5 四种白刺总黄酮含量得比较
根据在503nm波长处测定其吸光度值,计算得标准回归方程C=3.9067A+0.0031,r=0.9996,显示在0~96.8µg/mL范围内呈良好的线性关系。测得4种白刺果实和叶中总黄酮含量如表5,经单因素方差分析,果实中,唐古特白刺和小果白刺总黄酮含量差异显著,小果白刺总黄酮含量最高为 1.587%,唐古特白刺含量最低为 1.376%;叶中,4种白刺总黄酮含量差异显著,球果白刺叶的中总黄酮含量最高为 1.772%,唐古特白刺和和小果白刺次之,大果白刺含量最低。
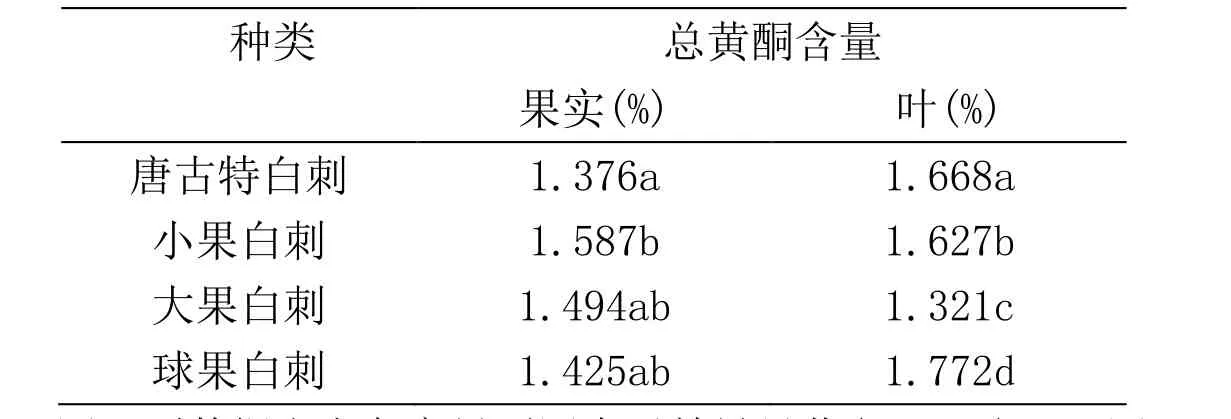
表5 4种白刺果实和叶中总黄酮含量的比较Table5 The content of total flavonoids in leaves and fruits of N.tangutorum、N.sibirica、N.roborowskii and N.sphaerocarpa
2.2 白刺总生物碱含量测定
2.2.1 精密度实验 取对照品溶液,按1.2.2.3测定方法进行测定,在418nm波长处重复测定5次。结果RSD=0.45%,表明本实验使用的仪器精密性良好。
2.2.2 重复性实验 照上述方法,对同一供试品溶液样品进行5次平行试验,测得RSD为1.77%,表明重现性良好。
2.2.3 稳定性实验 在室温条件下,将供试品溶液放置0、2、4、6、8、12h,按照上述方法进行测定,RSD为1.40%,结果表明供试品溶液在12h内稳定。
2.2.4 加样回收率实验 采用加样回收法取已知含量的供试品溶液9份(三组),分别加入标准品溶液,依1.2.2.3项中方法,在418nm处测定其吸光度,结果显示平均回收率为99.41%,RSD=1.99%。
2.2.5 四种白刺总生物碱含量得比较
根据绘制的标准曲线,计算出回归方程是:A=0.0543C-0.0117,r=0.9992,结果显示,当硫酸阿托品溶液浓度在 2.0~12.0μ g/L时,浓度与吸光值有良好的线性关系。4种白刺果实和叶中总生物碱含量如表6所示,经方差分析,4种白刺果实和叶中的总生物碱含量有显著差异,叶的总生物碱含量显著高于果实的。果实和叶中,都显示唐古特白刺总生物碱含量最高为0.058%和0.152%,小果白刺次之,大果白刺和球果白刺含量低。

表6 4种白刺果实和叶中总生物碱含量的比较Table 6 The content of total alkaloids in leaves and fruits of N.tangutorum 、N.sibirica 、N.roborowskii and N. sphaerocarpa
3 讨论
以硝酸铝-亚硝酸钠分光光度法测定总黄酮含量,采用酸碱提取法提取总碱,以硫酸阿托品为对照品,酸性染料比色法测定白刺总生物碱含量的方法,通过方法学考察,这两种方法操作简便,准确,适合于白刺总黄酮和总生物碱含量的测定。
生物碱和黄酮类化合物是在植物体内通过次生代谢途径合成的次生代谢产物,是药用植物的重要有效成分。在自然生长条件下,植物的种质和遗传适应性是影响植物次生代谢物含量的关键因素[11]。所以,不同种质必将导致植物次生代谢物含量的变化。通过对4种白刺的果实和叶总黄酮和总生物碱含量比较,叶中总黄酮和总生物碱的含量较高,而果实中含量较少,说明总黄酮和生物碱的积累和贮存主要是在叶中进行。小果白刺果实总黄酮含量最高,球果白刺叶的中总黄酮含量最高,而唐古特白刺总生物碱含量最高,其中小果白刺和唐古特白刺在内蒙古分布广泛,资源极为丰富,可选择作为提取白刺总黄酮和生物碱的原料。本研究仅对内蒙古临河地区分布的 4种白刺的果实和叶总黄酮和总生物碱含量进行初步测定的结果,对这4种白刺不同地域、不同生长期和其它部位总黄酮和总生物碱的积累规律还需进一步的研究。
[1]王彦阁,杨晓晖,于春堂,等.白刺属植物现状、生态功能及保护策略[J].水土保持研究,2007,6(14):75-79.
[2]努尔巴衣·阿布都沙力克,潘晓玲.白刺属植物化学成分分析及系统学意义[J].新疆大学学报(自然科学版),2003,20(1):50-54.
[3]索有瑞,王洪伦,汪汉卿.柴达木盆地唐古特白刺果实降血脂和抗氧化作用研究[J].天然产物研究与开发,2004,16(1):54-58.
[4]Liu B P L,Chong E Y Y,Cheung F W K,et al.Tangutorine induces p21 expression and abnormal mitosis in human colon cancer HT29 cells[J].Biochemical Pharmacology,2005,70(2):287-299.
[5]贾忠建,朱广军,王继和.唐古特白刺黄酮类化合物的研究[J].植物学报,1989,31(3):241.
[6]程江华,任琪,丁之恩.石榴皮和石榴叶的总黄酮含量及变化研究[J].食品工业科技,2010,(4):68-70
[7]朱金霞,刘萍.不同生境苦豆子种子中氧化苦参碱和总黄酮含量的比较研究[J],时珍国医国药,2012,23(4):848-850.
[8]邹慧琴,刘勇,闫永红,等.砂仁不同部位总黄酮的含量测定[J].中华中医药学刊,2013,31(2):376-378.
[9]李惠芬,卢继新.五种不同产地天仙子总生物碱的含量分析[J].中草药,1999,30(8):582-583.
[10]李方群,刘金荣,王鲁石.维药白刺总生物碱的含量测定[J].上海中医药杂志,2007,41(6):76-78.
[11]Spitale R R,Schlorhaufer P D,Ellmere R E P,et al.Altitudinal variation of secondary metabolite profiles in flowering heads of Arnica montana cv.[J].Phytochemistry,2006,67(4):409-417.

