酒类酒球菌31MBR β-D-葡萄糖苷酶超声提取工艺优化
董 梅,李亚辉,樊明涛,李爱霞,王盼雪
(西北农林科技大学食品科学与工程学院,陕西杨凌712100)
葡萄酒的酿造过程主要包括两个阶段:酵母主导的酒精发酵和乳酸菌主导的苹果酸-乳酸发酵,苹果酸-乳酸发酵对葡萄酒香气物质的形成具有重要作用[1-2]。
目前,酒类酒球菌是启动葡萄酒苹果酸-乳酸发酵最重要、应用最广泛的乳酸菌。酒类酒球菌能够适应葡萄酒中苛刻环境,较专一地进行苹果酸-乳酸发酵,大大改善葡萄酒的品质[3-4],近年来对此类菌的研究有大量报道[5-6]。葡萄酒的香气除了来自葡萄本身的果香外,很大一部分来自酒中结合态香气物质糖苷降解产生的游离态香气物质[7-8]。酶解具有高效、专一、条件温和等特点,在实际生产中一般采用此方法来降解葡萄酒中结合态呈香物质,产生挥发性香气物质,增加葡萄酒香气、改善葡萄酒风味。
β-D-葡萄糖苷酶是降解结合态香气物质的关键酶,它能催化水解芳基或烃基与糖基之间的糖苷键生成葡萄糖及挥发性物质[9]。酒类酒球菌31MBR是国内常用的一株酿酒乳酸菌,具有良好的苹果酸乳酸发酵性能,已有研究表明,此菌产生的 β-D-葡萄糖苷酶酶活较高,且为胞内可溶性酶[10]。对胞内酶检测需要进行细胞破碎处理,目前报道的物理研磨法、化学溶解法等,效果不是十分理想,酶活不能精确测定[11]。超声波破碎法对其他生物性材料酶提取的效果较好,本文系统地研究超声波对酒类酒球菌细胞的破碎效果和对β-D-葡萄糖苷酶酶活的影响,对乳酸菌属微生物葡萄糖苷酶的提取分离纯化具有一定指导意义。
1 材料与方法
1.1 材料与仪器
酒类酒球菌31MBR为实验室保存菌株。
对-硝苯-β-葡萄糖苷(p-NPG) 美国Sigma公司;所用其他试剂均为分析纯,西陇化学试剂。
ATB培养基:蛋白胨 10g/L,酵母浸粉 5g/L,MgSO4·7H2O 0.2g/L,葡萄糖 10g/L,MnSO4·4H2O 0.05 g/L,盐酸半胱氨酸0.5g/L,实验室自制番茄汁250mL/L,pH 调至 4.8,121℃灭菌20min。
HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;HS-840μ型水平层流单人净化工作台 苏州净化设备有限公司;UV-3802H紫外可见分光光度仪 上海尤尼柯仪器有限公司;VC-130超声波细胞破碎仪 美国Sonics&Materials公司。
1.2 实验方法
1.2.1 菌体制备 酒类酒球菌31MBR于ATB固体培养基中25℃静置培养,在ATB液体培养基中转接2次,分别培养40h至对数生长末期。取1mL菌液,离心收集菌体(4℃,5000×g,10min)。用 150mmol/L NaCl洗涤菌体,离心(4℃,5000 ×g,10min)弃上清液。重复洗涤三次,收集菌体备用。
1.2.2 葡萄糖苷酶提取方法
1.2.2.1 超声波破碎法 用1mL PBS缓冲液(NaCl 140mmol/L;KCl2.7mmol/L;Na2HPO410mmol/L;KH2PO41.8mmol/L;pH7.4)重新悬浮菌体,混匀,将菌体置于冰上,进行超声波破碎,破碎后离心(4℃,12000×g,10min),上清液即为粗酶液。
1.2.2.2 反复冻融法破碎细胞 菌体经洗涤后加入1mL PBS缓冲液,在-20℃冰箱中冻存20min,取出置于20℃水浴中溶解10min,如此重复5次。离心后所得的上清即为粗酶液[11]。
1.2.2.3 玻璃珠法破碎细胞 菌体经洗涤后加入1mL PBS破碎缓冲液,放入适量酸洗玻璃珠,冰浴。高速漩涡振荡30s,停30s,如此重复30min。离心后所得的上清即为粗酶液[11]。
1.2.3 葡萄糖苷酶活性测定 葡萄糖苷酶活性测定参照Barbagallo等所采用的方法[12],并略作修改。准确吸取0.5mL粗酶液,加入 0.5mL底物缓冲液(pH5.0),于30℃恒温水浴1h,反应结束后立即加入2mL 1mol/L Na2CO3终止反应,于400nm处测定吸光度。酶活定义:30℃时,每分钟每克干菌重生成对硝基苯酚的量(μmol)为1个酶活单位,即酶活单位为μmol/(min·g)。
1.2.4 蛋白含量测定 采用紫外吸收法测定蛋白含量。配制不同浓度的牛血清蛋白,并分别测定其在280nm处的吸光值。以牛血清蛋白浓度x为横坐标,吸光值A为纵坐标绘制标准曲线,其回归方程为A=0.7092x-0.0086,R2=0.9996,为高度显著。测定粗酶液在280nm处的吸光值,对照标准曲线即可得到粗酶液蛋白浓度。
1.2.5 超声波破碎条件确定 实验分为单因素实验和响应面优化两部分,单因素实验时,分别考察破碎时间(5、10、15、20、25、30、35min)、破碎功率(90、100、110、120、130W)、菌体浓度 (OD 值分别为1.202、1.387、1.608、1.792、2.044)对葡糖糖苷酶的影响。以单因素实验为基础,按照Box-Behnken原理设计实验,利用Design-Expert软件对实验数据进行回归拟合,采用响应面优化最终确定超声波破碎提取酶的最佳工艺条件。实验设计中的水平及编码表见表1。

表1 响应面分析实验因素水平表Table 1 Factors and levels of response surface analysis
2 结果与分析
2.1 超声波破碎条件单因素研究
2.1.1 破碎时间对提取葡萄糖苷酶的影响 超声波破碎时间对酶提取效果的影响如图1所示。当破碎功率为130W,菌体密度OD600为2.0时,可以看出随着时间的延长,总蛋白和总酶活力都呈上升趋势,但是比活力在10min以后增加得不明显,甚至有降低的趋势。酶的纯度可由比活力表示,破碎时间延长,细胞内总蛋白释放量增加,目的蛋白也有所增加,但是比活力并没有因此提高。破碎时间延长,导致破碎体系内热量增多,可能是由于目的蛋白对热敏感,使其催化活性部位受到损害,使酶的比活力下降[13]。所以选择的破碎时间范围为10、15、20min。
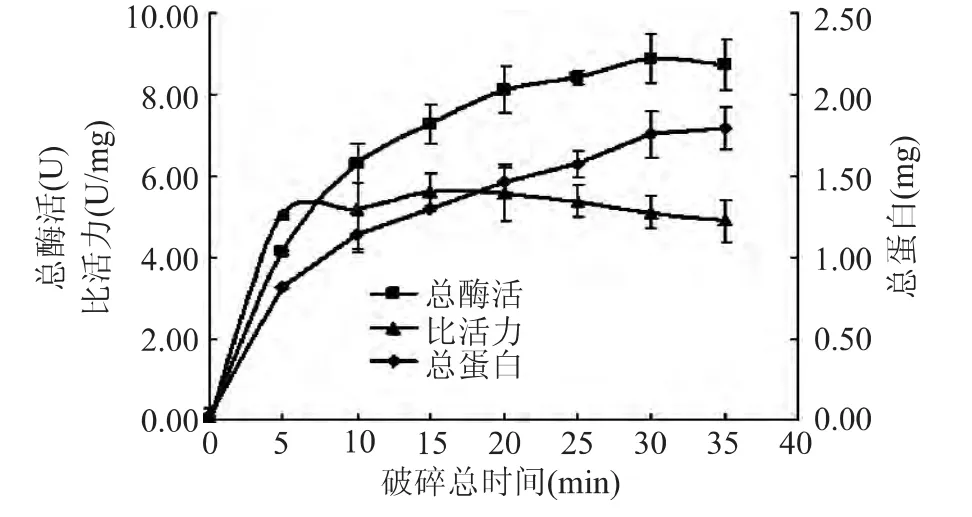
图1 超声波破碎时间对酶提取的影响Fig.1 Effect of ultrasonic time on extraction of glucosidase
2.1.2 破碎功率对提取葡萄糖苷酶的影响 破碎功率对酶提取效果的影响如图2所示。当破碎时间为15min,菌体密度OD600为2.0时,可以看出随着功率的增加,总蛋白和总酶活都有增加,说明破碎功率增大有助于细胞的破碎,但是比活力在120W的输出功率时达到最大,在最大功率130W有降低的趋势,原因可能是破碎功率上升导致热量增大,破坏了酶活。所以破碎功率为110~130W。

图2 超声波功率对酶提取的影响Fig.2 Effect of ultrasonic power on extraction of glucosidase
2.1.3 菌体密度对提取葡萄糖苷酶的影响 将不同浓度的菌体在超声波功率为130W的条件下处理15min,结果如图3所示。从图中可以看出,虽然酶的总活力一直在升高,但是酶的比活力在OD600值大于1.6后基本不变。菌体浓度会影响超声波的空化作用,当菌浓度高的时候,超声波破碎难以形成空化效应,而能量大多被转化为热量,不但不能破碎,反而破坏了样品中的酶活性。所以选择的菌体浓度OD600为 1.6、1.8、2.0。
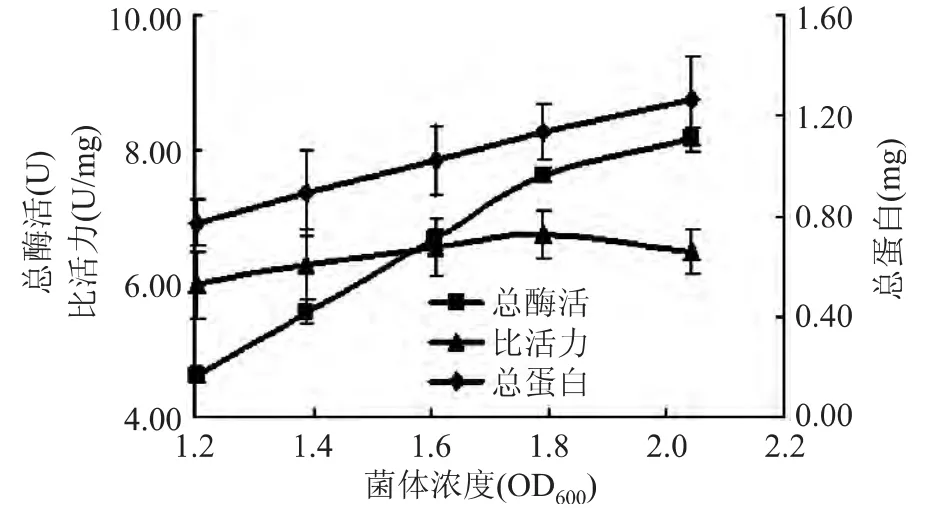
图3 菌体密度对酶提取的影响Fig.3 Effect of cell concentration on extraction of glucosidase
2.2 葡萄糖苷酶提取条件的优化
以破碎时间、破碎功率、菌体浓度为响应变量,根据单因素实验确定上下水平后,按Box-Behnken原理设计实验,进行优化分析。实验设计及结果见表2。利用Design-Expert软件对表2实验数据进行回归拟合,得到葡萄糖苷酶活力对破碎时间、破碎功率和菌体浓度三个因素的二次多项回归模型为:
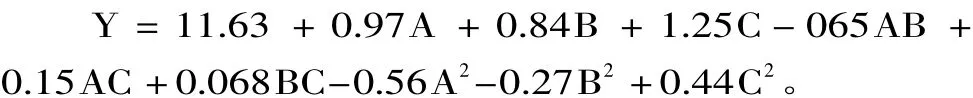
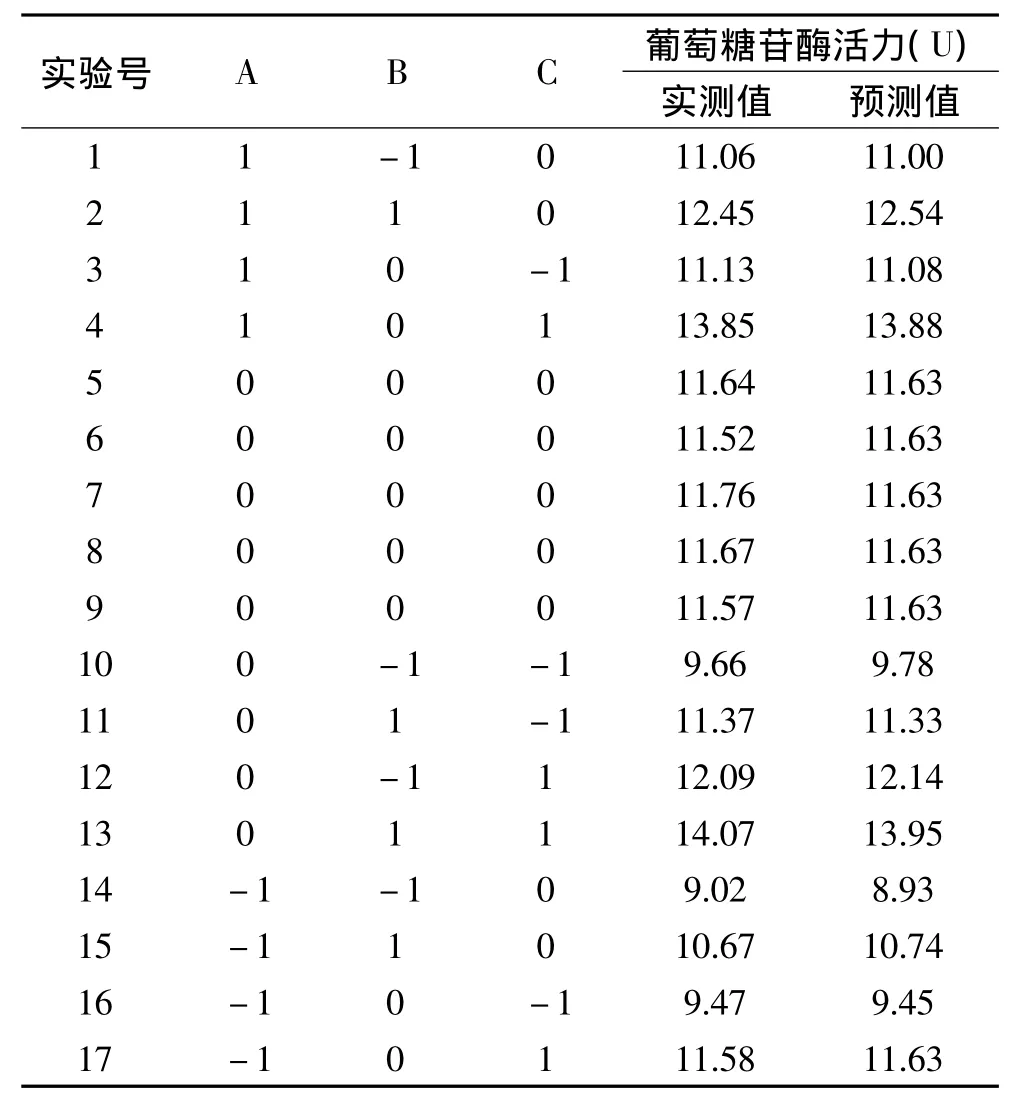
表2 Box-Behnken实验设计及结果Table 2 Test design and results of Box-Behnken
对该模型的数学回归分析结果见表3。其中回归模型的p值<0.0001,表明回归模型极显著;一次项均极显著,二次项均极显著;交互项AB、BC不显著,AC显著,这表明各种影响因素对葡萄糖苷酶的活性的影响不是简单的线性关系。失拟项p值为0.1901,大于0.05,不显著,相关系数 R2=0.9964,说明模型拟合程度良好,可用此模型来分析和预测葡萄糖苷酶的最佳提取条件。通过对三个因素F值的比较,可以得出三个因素对酶活力的影响:C>A>B,即菌体浓度>破碎总时间>破碎功率。
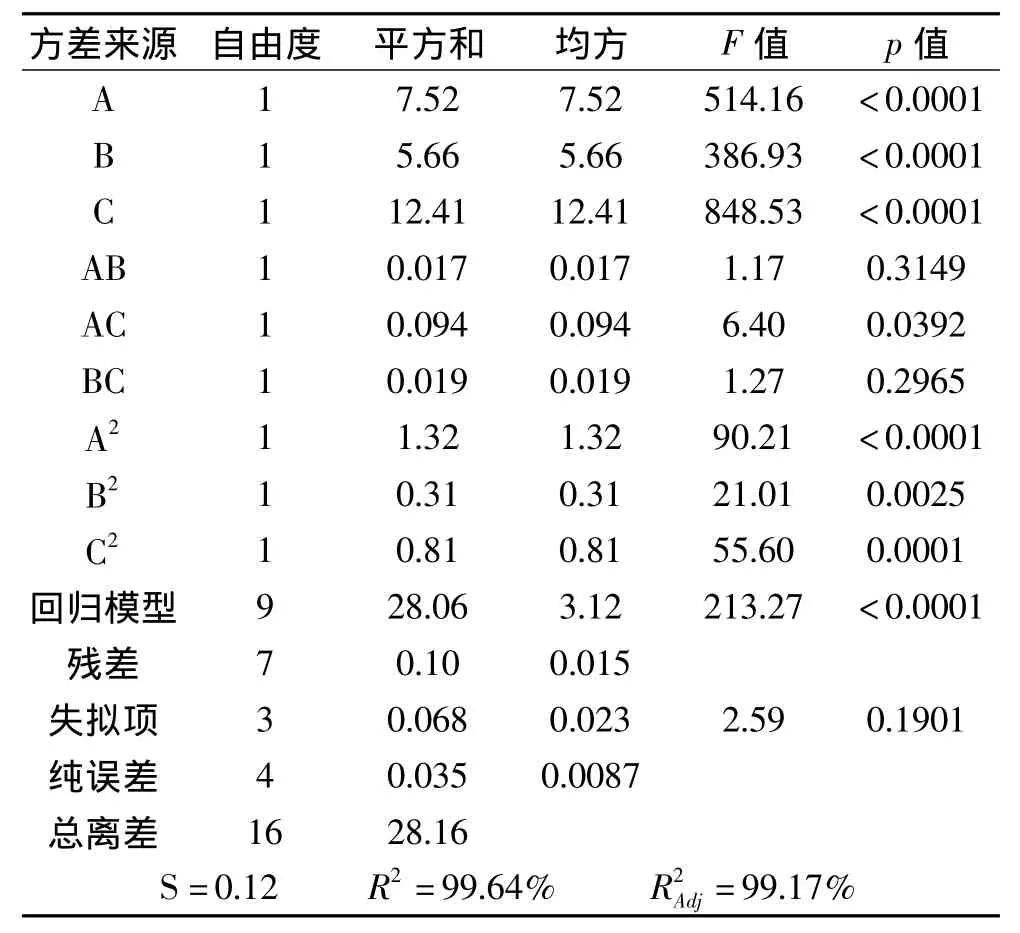
表3 回归方程方差分析表Table 3 Analysis results of regression and variance
2.3 实验因素对酶活力的影响
破碎时间和破碎功率的交互作用对酶提取效果影响如图4所示,由图中可以看出这两个因素交互作用对酶活的影响不显著(p=0.3149),酶活力随着时间的延长呈现增大的趋势,也随破碎功率的增大呈现增大趋势,而且破碎时间的响应面曲线更陡一些,说明时间对酶活的影响更显著。
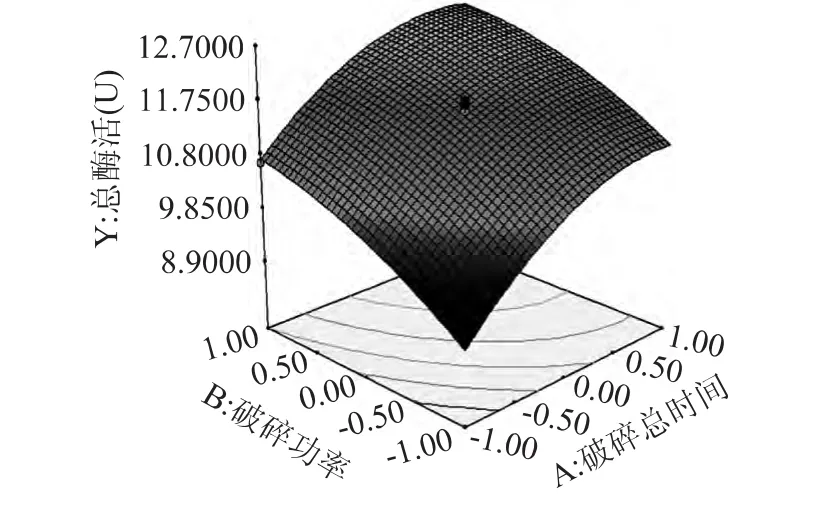
图4 Y=(A,B)响应面立体图Fig.4 Y=(A,B)response surface stereogram
破碎功率和菌体浓度交互作用对酶提取效果的影响如图5所示。可以看出,这两个因素交互作用对酶活的影响不显著(p=0.2965),酶活力随着这两个因素的各自增大都呈现增大趋势,与破碎功率相比,菌体密度的响应曲面更陡,说明对酶提取的影响更显著。

图5 Y=(B,C)响应面立体图Fig.5 Y=(B,C)response surface stereogram
破碎时间和菌体浓度交互作用对酶提取效果的影响如图6所示。这两个因素交互作用对酶活的影响显著(p=0.0392),酶活力受到这两个因素共同作用的影响。且菌体密度的响应曲线更陡,说明菌浓度对酶提取的影响更显著。
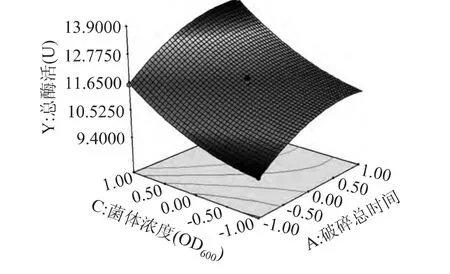
图6 Y=(A,C)响应面立体图Fig.6 Y=(A,C)response surface stereogram
根据回归方程绘出响应面分析图,用软件分析后,得到最适的葡萄糖苷酶提取条件为:A=0.94,B=1,C=1,经转换后,得出三因素的值分别为:破碎总时间19.7min,破碎功率130W,菌体浓度为OD600=2.0。在此条件下,预测值最大酶活为14.45U。考虑到实际可操作性,选择破碎总时间为20min,破碎功率为130W,菌体浓度OD600=2.0,实际测得的酶活为13.89U,与预测值相近。
2.4 超声波破碎法与其他破碎方法的比较
利用优化的超声波破碎条件进行糖苷酶提取,并比较了该方法与反复冻融法和玻璃珠法对酶提取效果的不同,结果如图7所示。可以看出用优化的方法得到的酶活显著高于其他两种方法。
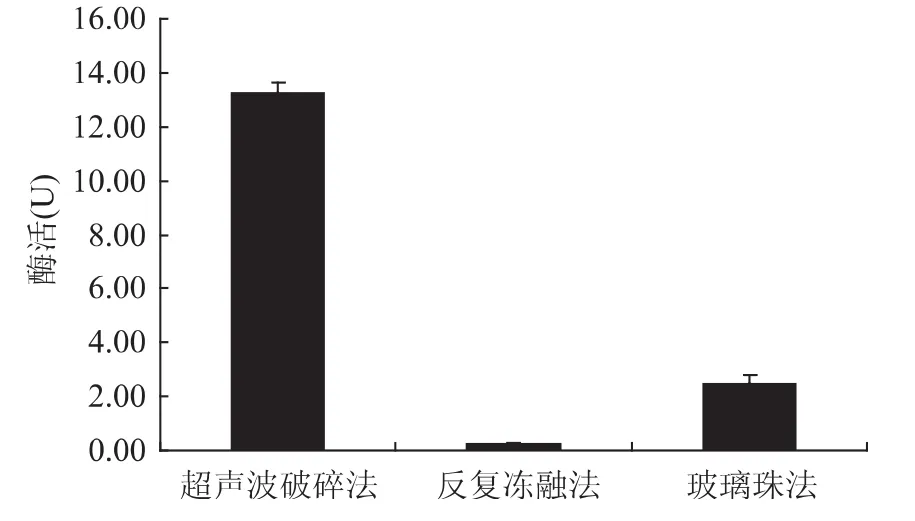
图7 三种破碎方法对酶活的影响Fig.7 Enzyme activity of β-Glucosidase by three methods
本实验结果表明,与其他破碎方法相比,超声波可以很好地破碎酒类酒球菌31MBR细胞壁,从而释放β-D-葡萄糖苷酶。超声波有强烈的生物学效应,进行超声波处理时,超声波的高频振动与微生物的振动不协调,造成细胞周围环境局部真空,使细胞膜产生空化作用,从而使之破碎[14-15]。
破碎时间和破碎功率主要会影响体系中的热量,时间越长,功率越大产生的热量越多,可能会因此导致酶失活。菌体浓度主要会影响到超声波破碎的空化效应,菌体太多,难以形成足够的水泡使细胞破裂,所以也会影响蛋白的释放量,不能空化则会产生大量的热,导致酶失活[15-16]。本实验系统地研究了超声波对酒类酒球菌的破碎效率,并比较了三种方法对酶活的影响,为后续实验提供了理论和技术支持。
3 结论
本研究所得超声波破碎法提取酒类酒球菌31MBR胞内β-D-葡萄糖苷酶的最佳条件为:破碎总时间20min,破碎功率130W,菌体浓度为OD600=2.0。按此方法得到粗酶液的总酶活为13.89U,与预测值相近。用优化的方法得到的酶活显著高于用反复冻融法和玻璃珠法得到的酶活。
[1]Mesas JM,Rodrı'guez MC,Alegre MT.Basic characterization and partial purification of β-glucosidase from cell-free extracts of Oenococcus oeni ST81[J].Applied Microbiology,2012,55:247-255.
[2]Spano G,Rinaldi A,Ugliano M,et al.A beta-glucosidase gene isolated from wine Lactobacillus plantarum is regulated by abiotic stresses[J].Journal of Applied Microbiology,2005,98(4):855-861.
[3] RuizP,Izquierdo PM,Seseña S,etal.Selection of autochthonous Oenococcus oeni strains according to their oenological[J].International Journal of Food Microbiology,2010,137:230-235.
[4]Ugliano M,Genovese A,Moio L.Hydrolysis of Wine Aroma Precursors during Malolactic Fermentation with Four Commercial Starter Cultures of Oenococcus oeni[J].Journal of Agricultrue and Food Chemistry,2003,51:5073-5078.
[5]刘树文,余东亮.酒类酒球菌不同菌株的16S+rDNA+PCR-RFLP 分析[J].西北农业学报,2010,19(6):181-186.
[6]CappelloMS,ZapparoliG,StefaniD.Molecularand biochemical diversity of Oenococcus oeni strains isolated during spontaneous malolactic fermentation of Malvasia Nera wine[J].Systematic and Applied Microbiology,2010,33:461-467.
[7]Michlmayr H,Nauer S,Brandes W,et al.Release of wine monoterpenes natural precursors by glycosidases[J].Food Chemistry,2012,135:80-87.
[8]Michlmayr H,Schu¨mann C,Barreira NM,et al.Isolation and basic characterization of a β-glucosidase from a strain of Lactobacillus brevis isolated from a malolactic starter culture[J].Journal of Applied Microbiology,2010,108:550-559.
[9]高丽.葡萄(霞多丽)浆果中糖苷酶分布的研究[D].杨凌:西北农林科技大学,2007.
[10]Li YH,Fan MT,Ran JJ,et al.Influence of abiotic stress on β-D-glucosidase activity of two typical Oenococcus oeni strains in China[J].African Journal of Microbiology Research,2012,6(37):6685-6692.
[11]张国强,樊明涛,刘晓娇,等.酒类酒球菌蛋白质提取方法研究[J].中国酿造,2010,9:39-41.
[12]Barbagallo RN,Spagna G,Palmeri R,et al.Assessment of β-glucosidase activity in selected wild strains of Oenococcus oeni formalolactic fermentation[J] .Enzyme and Microbial Technology,2004,34:292-296.
[13]蒋立科,罗曼.生物化学实验设计与实践[M].北京:高等教育出版社,2007:93-94.
[14]梁蕊芳,徐龙,翁鸿珍.超声波对食品污染性菌种破碎效果的影响[J].安徽农业科学,2012,40(10):6180-6182.
[15]郭宇星,潘道东.超声波破碎法提取瑞士乳杆菌氨肽酶条件的优化[J].食品科学,2008,29(8):140-144.
[16]刘果,何永红,万呼春,等.超声破碎变异链球菌后蛋白质提取条件的优化研究[J].重庆医学,2012,29:3051-3053.

