敲除MIG1同时过表达MAL62面包酵母的发酵性能
张翠英,林 雪,孙 溪,肖冬光
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
面包酵母是面食制作过程中必不可少微生物发酵剂和疏松剂[1–2].在无糖面团中,麦芽糖是主要的可发酵糖,因此麦芽糖代谢能力是影响无糖面团中面包酵母发酵能力的主要因素[3–4].酵母利用麦芽糖需要 3种基因产物,典型的为 MAL61(MAL6T)编码的麦芽糖通透酶、MAL62(MAL6S)编码的麦芽糖酶和
MAL63(MAL6R)编码的正调节蛋白[5].麦芽糖通透酶将麦芽糖运输到胞内,经麦芽糖酶水解为两分子葡萄糖后进入糖酵解途径,供细胞利用.本实验室[6–7]前期实验表明,在麦芽糖代谢过程中麦芽糖酶的作用较为关键.因此,提高MAL62基因的表达量是加快麦芽糖代谢、提高面包酵母无糖面团发酵力的有效途径.
实际上,在无糖面团中含有少量的葡萄糖、果糖等可发酵糖,葡萄糖的存在对一些糖代谢相关基因的表达存在抑制作用,从而降低了其代谢速度[8–9].Mig1蛋白是一种锌指状 DNA结合蛋白,是 SUC2、GAL和 MAL基因的阻遏子[10],Mig1蛋白复合体和MAL-激活蛋白(Mal63)之间的复杂作用被认为是葡萄糖阻遏麦芽糖代谢的主要步骤.Hu等[11]发现MIG1的破坏或在 MAL63启动子上 Mig1蛋白结合位点的敲除会增加MAL63的表达.因此敲除MIG1,去除葡萄糖阻遏效应也是提高面包酵母无糖面团发酵力的另一有效途径.
本实验对敲除MIG1同时整合过表达MAL62的面包酵母工业重组菌 BPM-M 进行了酶活、耗糖、葡萄糖阻遏以及无糖面团发酵力的测定.
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
面包酵母工业菌株 BY-14由天津科技大学天津市工业微生物重点实验室保藏;BY-14a是亲本菌株BY-14的a型单倍体菌株[12].
质粒 pUC-MKAB[12]和 pUC-P[13]由本实验室前期构建、保藏,pUC-P质粒携有酿酒酵母3–磷酸甘油酸激酶基因(PGK1)强启动子.
1.1.2 培养基
细菌培养基(LB):10,g/L胰蛋白胨,5,g/L酵母粉,10,g/L 氯化钠,pH 7.0.
糖蜜培养基:将30~35,Brix的糖蜜稀释至10~12,Brix,添加酵母粉 5,g/L、硫酸铵 0.5,g/L,pH 5.0.
酵母培养基(YEPD):蛋白胨 20,g/L,酵母粉10,g/L,葡萄糖20,g/L.
液体模拟面团培养基(LSMLD):
(1)葡萄糖 LSMLD:葡萄糖 40,g/L,硫酸铵2.5,g/L,尿素 5,g/L,磷酸二氢钾 16,g/L,磷酸氢二钠5,g/L,硫酸镁 0.6,g/L,烟酸 22.5,mg/L,泛酸5.0,mg/L,维生素 B12.5,mg/L,维生素 B61.25,mg/L,维生素B21.0,mg/L,叶酸0.5,mg/L,蒸馏水配制.
(2)麦芽糖 LSMLD:以 38,g/L麦芽糖代替40,g/L葡萄糖,其他成分不变.
(3)混合糖 LSMLD:以 33.25,g/L 麦芽糖、5,g/L葡萄糖代替40,g/L葡萄糖,其他成分不变.
1.1.3 设备与仪器
Precellys24细胞破碎仪,法国 Bertin Technologies公司;发酵力测定仪,瑞典 SJA公司;1100系列高效液相色谱仪,美国安捷伦科技有限公司;SynergyTM,4多功能酶标仪,美国Biotek公司.
1.2 方法
1.2.1 引物
实验中所用引物见表1.

表1 BPM-M突变株构建所用引物Tab.1 Primers used in the construction of the recombined strain BPM-M
1.2.2 重组质粒的构建
以面包酵母 BY-14a染色体 DNA为模板,利用引物 Mal62-up和 Mal62-down PCR扩增目的基因MAL62;将 MAL62插入到 pUC-P质粒的 XhoI酶切位点,得到质粒 pUC-PM;以 pUC-PM 为模板,利用引物PGK-up和PGK-down PCR扩增PM片段,连接到 pUC-MKAB质粒 BamHI酶切位点,构建质粒pUC-MKABM.
1.2.3 醋酸锂方法转化与转化子的鉴定
以质粒 pUC-MKABM 为模板,用引物 MA-up和 MB-down进行 PCR扩增,得到 MA-KanMX-(PGK1P+MAL62+PGK1T)-MB重组盒;通过醋酸锂转化法[7]将重组盒转化酵母单倍体 BY-14a.转化后的细胞涂布于含有 G-418的 YEPD平板,30,℃培养48,h.获得的转化子再通过PCR进行验证.
1.2.4 鲜酵母的制备
挑取 1环酵母菌接种于5,mL的 YEPD液体培养基中,30,℃静置培养 36,h,间歇摇动;以 10%接种量接入糖蜜培养基,30,℃、180,r/min培养至稳定期,静置2,h使酵母状态利于下一步发酵;4,000,r/min离心5,min,洗涤2次后收集菌体备用.
1.2.5 糖蜜处理
废糖蜜先用硫酸调糖蜜 pH至 4.5(添加量约为糖蜜质量的 0.5%),加热至沸腾后保持0.5~1,h以驱除有害气体;待晾凉后加石灰乳调节pH至5.0,使杂质沉淀排除;静置24,h以上,过滤取上清液.
1.2.6 酶活力测定
按照参考文献[14]进行麦芽糖酶活力的测定.每个实验重复 3次,取平均值.麦芽糖酶活力单位为每分钟每毫克蛋白释放对硝基苯酚的物质的量(µmol/(min·mg)).
1.2.7 残糖的测定
配制LSMLD培养基,100,℃煮沸30,min后冷却至 30,℃.每 100,mL LSMLD 培养基接入 2,g鲜酵母,30,℃静置培养 4,h.每隔一定时间取样,–20,℃保存,待发酵完毕进行一次性测定.葡萄糖与麦芽糖含量测定采用高效液相色谱法[7].高效液相色谱条件为:Bio-Red的 Aminex HPX-87H 色谱柱(300,mm×7.8,mm,9,µm),流动相为 5,mmol/L 的稀硫酸,流量为 0.6,mL/min,柱温为 65,℃,检测器为示差折光检测器,检测器温度为 45,℃.样品稀释到合适的质量浓度(低于1.000,g/L)并用0.22,µm的滤膜过滤,进样量为 20,µL.
1.2.8 葡萄糖阻遏程度的测定
在混合糖模拟面团培养基中,以葡萄糖含量由0.5%降至 0.1%时所消耗的总糖量算作酵母的总糖利用量,计为u1(mmol);再计算相同时间内单麦芽糖模拟面团培养基中麦芽糖的消耗量,计为u2(mmol);由式(1)可以计算出葡萄糖的阻遏程度I,[12].

1.2.9 无糖面团发酵力的测定
面团发酵力根据GB/T 20886—2007《食品加工用酵母》[15]的方法测定:面粉 280,g、水 150,mL、氯化钠4,g和鲜酵母(含水量75%)9,g在(30±0.2)℃条件下快速均匀搅拌 5,min,放入发酵力测定仪,记录30,℃下90,min内的CO2产气量.实验重复3次取平均值.
2 结果与分析
2.1 重组菌株BPM-M的构建
将 MA-KanMX-(PGK1P+MAL62+PGK1T)-MB重组盒转化酵母单倍体 BY-14a,同源重组过程如图1所示.获得的G-418抗性转化子经PCR验证,结果如图2所示.

图1 同源重组过程Fig.1 Homologous recombining process
在重组菌株 BPM-M 基因组上,利用 3对引物M-S/M-X、M-S/K-S-B、M-X/PGK1T(IN)-up 都能够PCR扩增分别得到明显的一条片段,大小与预期结果(6,470,bp、2,454,bp和 533,bp)一致;而利用引物M-S/K-S-B和 M-X/PGK1T(IN)-up在亲本菌株 BY-14a基因组上则不能 PCR扩增获得明显片段.这些结果证明,在重组菌株 BPM-M 基因组上,重组盒MA-KanMX-(PGK1P+MAL62+PGK1T)-MB 重组整合正确.
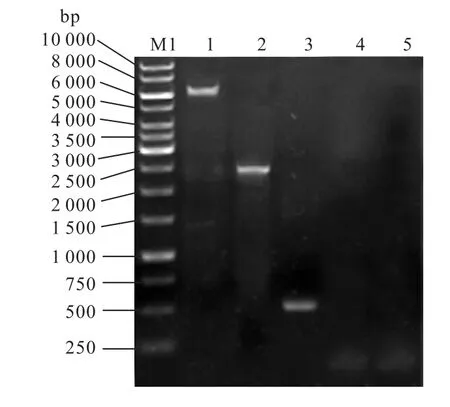
图2 重组菌株BPM-M基因组验证Fig.2 Verification of the recombined strain BPM-M
2.2 发酵性能
2.2.1 酶活力
不同碳源 LSMLD培养基中菌株 BY-14a和BPM-M的麦芽糖酶活力如图3所示.
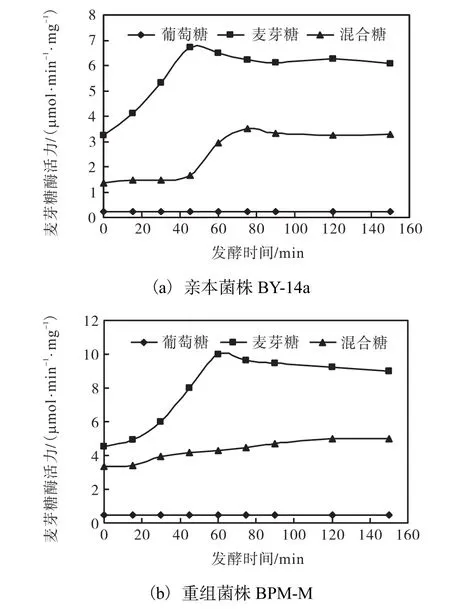
图3 不同碳源 LSMLD培养基中菌株 BY-14a和 BPMM的麦芽糖酶活力Fig.3 Maltase activity of BY-14a and BPM-M in LSMLD medium of different carbon sources
在3种不同碳源LSMLD培养基中,与亲本菌株BY-14a相比,整合过表达 MAL62基因的重组菌BPM-M,其麦芽糖酶活力均有提高.在混合糖LSMLD培养基中,尽管存在一定程度的葡萄糖阻遏效应,但重组菌BPM-M最大麦芽糖酶活力比亲本菌株 BY-14a高 42.9%;在麦芽糖 LSMLD培养基中,BPM-M 的最大麦芽糖酶活力比亲本菌株 BY-14a高49.3%;在葡萄糖LSMLD培养基中,尽管两菌株的麦芽糖酶活力均低于 0.5,µmol/(min·mg),但是重组菌BPM-M 的最大麦芽糖酶活力仍然高出亲本菌 BY-14a 100.0%.这些结果证明整合过表达 MAL62使重组菌株麦芽糖酶活力显著提高,从而提高菌株在细胞内分解麦芽糖的能力.
2.2.2 液体模拟面团培养基中的残糖及葡萄糖阻遏程度
通过 HPLC测定了混合 LSMLD培养基中葡萄糖和麦芽糖浓度随时间的变化,结果如图4所示.

图4 混合糖 LSMLD培养基中菌株 BY-14a和 BPM-M的麦芽糖及葡萄糖残糖质量浓度Fig.4 Concentration of residual maltose and glucose of BY-14a and BPM-M during shaking cultivation in maltose-glucose LSMLD media
经过一级培养,两菌株在接入麦芽糖与葡萄糖为碳源的混合糖LSMLD模拟面团培养基后,均立即出现麦芽糖与葡萄糖共同吸收的现象.然而在亲本菌株BY-14a中麦芽糖的吸收因为葡萄糖的存在延滞了一段时间.在重组菌株BPM-M中葡萄糖利用速率显著加快,同时葡萄糖阻遏现象明显减轻,麦芽糖利用速率明显加快,发酵240,min麦芽糖利用速率较亲本提高29.1%. 同时,通过式(1)计算得到两菌株的葡萄糖阻遏程度. 亲本菌株 BY-14a受葡萄糖阻遏程度为 59%,重组菌株 BPM-M 受葡萄糖阻遏程度为36.1%.与亲本菌株 BY-14a相比,重组菌株 BPM-M的葡萄糖阻遏程度降低了 38.8%.这些结果证明,面包酵母重组菌株 BPM-M 具有较高的抗葡萄糖阻遏能力、较快的麦芽糖利用能力.Klein等[16]将敲除MIG1、表达 MALT、MALS以及敲除 MIG1同时表达MALT、MALS的 3株酿酒酵母重组菌株分别与亲本菌株比较发现:在葡萄糖存在时,3株重组菌的葡萄糖阻遏明显减弱,麦芽糖利用速率均有明显提高,甚至表达MAL的重组菌对麦芽糖摄取已经超过对葡萄糖的摄取.本研究结果则证明敲除 MIG1仅同时过表达一个麦芽糖利用的酶——麦芽糖酶编码基因MAL62(MALS)就可以使面包酵母葡萄糖阻遏作用减弱,麦芽糖利用速率提高.2.2.3 无糖面团发酵力
面团发酵力根据单位干质量的菌体在单位时间内产生 CO2的体积确定.不同菌在无糖面团中的CO2产量如图5所示.

图5 不同菌在无糖面团中的CO2产量Fig.5 CO2 production of the strains in lean dough
亲本菌株BY-14a在80,min时 CO2产量达到最大,无糖面团发酵力为(108.5±0.3)mL/(h·g).而重组菌株BPM-M在发酵50,min时就可以达到同等效力,且最大产气量较亲本菌株BY-14a提高10.2%,其无糖面团发酵力为(163.4±0.8)mL/(h·g),比亲本菌株提高了50.6%.该结果表明,面包酵母重组菌株BPM-M 具有较高的麦芽糖利用能力,可以在较短的时间内获得较大的 CO2产量.Higgins等[4]在对麦芽糖酶活力与麦芽糖通透酶活力对“迟滞”与“非迟滞”面包酵母产气能力的探究中发现,酶活力与CO2产量两者之间有关联性,麦芽糖酶活力的提高使产气量也明显增加,这与本研究结果一致.
3 结 论
本实验利用同源重组的原理,在面包酵母菌株中实现了敲除 MIG1基因同时过表达 MAL62基因.面包酵母重组菌株 BPM-M 具有较高的麦芽糖利用能力和无糖面团发酵力.敲除MIG1仅同时过表达一个麦芽糖利用的酶——麦芽糖酶编码基因MAL62就可以使面包酵母葡萄糖阻遏作用减弱、麦芽糖利用速率提高、无糖面团发酵力提高.
[1] Bell P J,Higgins V J,Attfield P V. Comparison of fermentative capacities of industrial baking and wild-type yeasts of the species Saccharomyces cerevisiae in different sugar media[J]. Letters Applied Microbiology ,2001,32(4):224-229.
[2] 李红民,黄仁泉. 激光诱变选育面包酵母菌的研究[J].光子学报,2001,30(11):1381-1384.
[3] Salema-Oom M,De Sousa H R,Assuncão M,et al.Derepression of a baker’s yeast strain for maltose utilization is associated with severe deregulation of HXT gene expression[J]. Journal of Applied Microbiology,2011,110(1):364-374.
[4] Higgins V J,Braidwood M,Bell P,et al. Genetic evidence that high noninduced maltase and maltose permease activities,governed by MALx3-encoded transcriptional regulators,determine efficiency of gas production by baker’s yeast in unsugared dough[J]. Applied and Environmental Microbiology,1999,65(2):680-685.
[5] Hu Z,Gibson A W,Kim J H,et al. Functional domain analysis of the Saccharomyces MAL-activator[J]. Current Genetics,1999,36(1/2):1-12.
[6] Jiang Tianxiao,Xiao Dongguang,Gao Qiang. Characterisation of maltose metabolism in lean dough by lagging and non-lagging baker’s yeast strains[J]. Annals of Microbiology,2008,58(4):655-660.
[7] Sun X,Zhang C,Dong J,et al. Enhanced leavening properties of baker’s yeast overexpressing MAL62 with deletion of MIG1 in lean dough[J]. Journal of Industrial Microbiology & Biotechnology,2012,39(10):1533-1539.
[8] Nehlin J O,Carlberg M,Ronne H. Control of yeast GAL genes by MIG1 repressor:A transcriptional cascade in the glucose response[J]. EMBO Journal,1991,10(11):3373-3377.
[9] Cao H L,Yue M,Li S G,et al. The impact of MIG1 and/or MIG2 disruption on aerobic metabolism of succinate dehydrogenase negative Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology,2011,89(3):733-738.
[10]Horák J. Regulations of sugar transporters:Insights from yeast[J]. Current Genetics,2013,59(1/2):1-31.
[11]Hu Z,Nehlin J O,Ronne H,et al. MIG1-dependent and MIG1-independent glucose regulation of MAL gene expression in Saccharomyces cerevisiae[J]. Current Genetics,1995,28(3):258-266.
[12]Zhang Yan,Xiao Dongguang,Zhang Cuiying,et al. Effect of MIG1 gene deletion on glucose repression in baker’s yeast[J]. Advanced Materials Research,2011,396/397/398:1531-1535.
[13]Zhang Jianwei,Zhang Cuiying,Dai Longhai,et al. Effects of overexpression of the alcohol acetyltransferaseencoding gene ATF1 and disruption of the esteraseencoding gene IAH1 on the flavour profiles of Chinese yellow rice wine[J]. International Journal of Food Science & Technology,2012,47(12):2590-2596.
[14]Houghton-Larsen J,Brandt A. Fermentation of high concentrations of maltose by Saccharomyces cerevisiae is limited by the COMPASS methylation complex[J]. Applied and Environmental Microbiology,2006,72(11):7176-7182.
[15]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB/T 20886—2007 食品加工用酵母[S]. 北京:中国标准出版社,2007.
[16]Klein C J L,Olsson L,Ronnow B,et al. Glucose and maltose metabolism in MIG1-disrupted and MAL-constitutive strains of Saccharomyces cerevisiae [J].Food Technology and Biotechnology,1997,35(4):287-292.

