以食品级原料进行植物乳杆菌发酵及其抗真菌活性的研究
王海宽,陈 冲,王应东,沈发迪
(工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
乳酸菌用于食品和饲料中有着悠久的历史,其可以通过降低食品 pH和产生有机酸、蛋白质类活性物质、羟基脂肪酸和酚类化合物等抑菌物质,抑制腐败菌和病原微生物的生长[1].研究发现,部分乳酸菌具有抑制真菌生长的功能.植物乳杆菌属于乳酸菌,据报道,也有类似抑菌功能.袁晶[2]用双层平板拮抗法测定植物乳杆菌 ZJ316对烟曲霉有明显的抑制作用.Crowley等[3]将植物乳杆菌作为发酵剂应用到酸奶和橙汁中,发现植物乳杆菌可延迟腐败真菌黏质酵母(R. mucilaginosa)的生长.Gerez 等[4]从 95 株乳酸菌中筛选出 4株具有抑制青霉菌属、镰孢菌属、曲霉菌属(霉菌来源于被污染的面包)的乳酸菌,分别为植物乳杆菌 CRL778、罗伊式乳杆菌 CRL1100、短乳杆菌 CRL772和 CRL796,并将酵母与筛选出的乳酸菌混合加入面团进行发酵,使生产出的面包保质期延长了3,d.Yang等[5]将植物乳杆菌AF1的上清液浓缩4倍后喷到黄豆表面,与对照相比,可使黄豆表面的黄曲霉延缓7,d萌发.
以食品级原料为培养基经乳酸菌发酵后抗菌活性高的发酵液进行冻干浓缩等处理作为抗真菌防腐剂直接加入食品中,由于菌株及原料皆为安全的,因此产生的物质也可直接食用.这不仅满足了消费者对食品防腐剂的安全性要求,同时节省了新型防腐剂投入使用前进行的安全性实验.此外,由于原料单一、后续操作简单等原因使得其有利于大规模工业化生产.植物乳杆菌作为出发菌株用于酸奶和酸豆奶中已有研究[6–7],本实验以脱脂奶粉及大豆蛋白为发酵培养基,筛选出1株对娄地青霉具有明显抑制作用的植物乳杆菌,并对其产生的抑菌物质特性进行了初步探索.
1 材料与方法
1.1 菌种
60株植物乳杆菌(Lactobacillus plantarum)均来自内蒙古农业大学“乳品生物技术与工程”教育部重点实验室;娄地青霉菌(Penicillium roqueforti)购于中国普通微生物菌种保藏中心,保藏编号为 CGMCC 3.07903.
1.2 培养基
乳酸菌活化培养基采用 MRS培养基:蛋白胨10,g,牛肉膏 10,g,酵母膏 5,g,KH2PO42,g,柠檬酸三铵 2,g,乙酸钠 2,g,葡萄糖 20,g,吐温 80 1,mL,MgSO4·7H2O 0.5,g,MnSO4·4H2O 0.25,g,蒸馏水 1,L,pH 6.5、115,℃灭菌 20,min.
大豆蛋白培养基:20,g/L大豆蛋白,20,g/L葡萄糖,115,℃灭菌 15,min.
脱脂奶粉培养基:100,g/L脱脂奶粉,115,℃灭菌15,min.
真菌培养基采用 PDA培养基:取马铃薯 200,g洗净去皮切块,加蒸馏水 1,L煮沸约 30,min,用纱布过滤,定容至 1,L,再加葡萄糖 20,g和琼脂 8,g充分溶解后,121,℃灭菌 20,min.
1.3 植物乳杆菌的活化培养和发酵液、孢子悬液的制备
1.3.1 菌株活化
取少量保存于30%甘油内的活菌于MRS琼脂平板上划线,挑取单菌落用 MRS固体斜面培养基进行菌种活化传代,从活化的 MRS固体斜面培养基上挑取适量菌体接入MRS液体培养基中,37,℃静置培养20,h.
1.3.2 植物乳杆菌发酵液的制备
从活化的种子液中按 5%接种量接种于发酵培养基内,37,℃恒温培养48,h后即得到乳酸菌发酵液.1.3.3 孢子悬液的制备
将接种娄地青霉的PDA斜面培养1周,用无菌水洗下孢子,3层擦镜纸过滤除去菌丝得到孢子悬液.用血球记数板进行计数,确定孢子悬液的浓度.
1.4 抑菌活性检测方法
1.4.1 双层平板点接法[8]
按 2%接种量将活化后的菌株接种于 MRS液体培养基中,在厌氧箱中 37,℃液体培养 48,h后,吸取5,µL点在MRS固体平板中央,37,℃再培养48,h后,在平板上倒10,mL的PDA培养基(含有娄地青霉菌的孢子 106,mL–1),28,℃培养 48,h,测量抑菌圈半径,每个样品 3个平行.该方法用于菌株的筛选和植物乳杆菌 IMAU10014抗真菌物质生成的发酵特性优化中抑菌活性的测定.
1.4.2 琼脂平板扩散法[9]
在灭菌的平板中倒 1层 10,mL的 PDA培养基(含有娄地青霉菌的孢子 106,mL–1),待其凝固后在表面放入无菌的牛津杯(d=7.64,mm),将浓缩后的乳酸菌发酵上清液 100,µL接入牛津杯中,28,℃培养48,h,测量抑菌圈半径,每个样品 3个平行.该方法用于植物乳杆菌发酵浓缩上清液抑菌活性的检测.
1.5 抗真菌活性物质的基本性质
1.5.1 发酵浓缩上清液的制备
从活化的种子液中按 5%接种量接种于大豆蛋白培养基内,37,℃恒温培养 48,h后,4,℃、10,000,r/min离心 15,min去除菌体,将上清液用 0.45,µm 无菌滤膜过滤后,–70,℃预冻 4,h后,冷冻干燥机冷冻36,h,悬浮在水中,浓缩到原始浓度的20倍,4,℃冰箱保存备用.用琼脂平板扩散法测定其抑娄地青霉活性.1.5.2 pH对抗真菌活性物质的影响
将原始的浓缩上清液用氢氧化钠溶液分别调至pH 4.0、5.0、6.0、7.0,每个处理 3 个平行,尽量降低因调解 pH而引起的活性物质浓度的变化,考察环境酸碱度对抗菌物抑菌活性的影响.
1.5.3 酶处理对抗真菌活性物质的影响
用氢氧化钠溶液将浓缩上清液调节 pH至 7.0,分别用胰蛋白酶、中性蛋白酶和蛋白酶K处理,使之在37,℃水浴条件下反应2,h,然后在100,℃水浴加热10,min使蛋白酶变性.以不加酶处理的浓缩液作为对照,每个处理 3个平行,用琼脂平板扩散法测定经过酶处理的样品和对照的抑菌活性.
1.5.4 温度对抗真菌活性物质的影响
将500,µL浓缩上清液放入1.5,mL的离心管内,分别在不同温度下加热1,h及121,℃加热20,min,每个处理3个平行,将经过以上处理的样品和未经处理的样品分别用琼脂平板扩散法测抑菌活性.
由图1可知:当pH<6.5时,乳酸菌发酵液的抑菌活性随着pH升高而递增;当pH达到6.5时,抑菌活性最高,其抑菌圈半径为15.2,mm.
2.2.2 培养温度对发酵液抑菌活性的影响
其他条件不变,在不同温度下培养 48,h后测定发酵液的抑菌活性,结果如图 2所示.乳酸菌发酵液的抑菌活性随着温度升高而递增,温度达到 37,℃左右抑菌活性最高,抑菌圈半径为15.3,mm.

图2 温度对抑菌活性的影响Fig.2 Influence of temperature on the antifungal activity
2 结果与讨论
2.1 菌种筛选
从60株植物乳杆菌中筛选出对娄地青霉抑菌圈半径>14,mm 的 8株乳酸菌:IMAU80107、IMAU 80091、IMAU80163、IMAU80105、IMAU80158、IMAU80161、IMAU80104、IMAU10014.将其在脱脂奶粉培养基和大豆蛋白培养基中进行复筛.
当乳酸菌的培养基由MRS培养基改为脱脂奶粉培养基后,其抑菌圈均在 14,mm 以下.当培养基由MRS培养基改为大豆蛋白培养基时乳酸菌的抑菌活性也有所降低,仅有植物乳杆菌IMAU10014的抑菌圈半径在14,mm以上,因此选取植物乳杆菌 IMAU 10014且培养基为大豆蛋白培养基进行后续实验.
2.2 植物乳杆菌 IMAU10014抗真菌物质生成的发酵特性优化
为提高植物乳杆菌 IMAU10014的抑菌活性,分别选取了可能影响其抑菌效果的 pH、温度、葡萄糖含量及大豆蛋白含量 4个因素进行单因素实验和正交优化实验.该实验中菌种发酵液的抑菌活性通过
1.4.1 节双层平板点接法测定.
2.2.1 培养基初始pH对发酵液抑菌活性的影响
保持其他条件不变,调节培养基初始 pH,分别培养48,h后测定发酵液的抑菌活性,初始pH对抑菌活性的影响如图1所示.
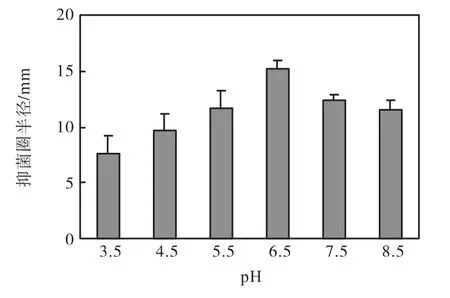
图1 培养基初始pH对抑菌活性的影响Fig.1 Influence of initial pH on the antifungal activity
2.2.3 葡萄糖质量浓度对发酵液抑菌活性的影响
保持其他条件不变,培养 48,h后测定发酵液的抑菌活性,比较培养基中不同葡萄糖质量浓度对抑菌活性的影响,结果如图 3所示.乳酸菌发酵液的抑菌活性在葡萄糖质量浓度为 20,g/L时达到最高,继续增加葡萄糖的质量浓度会抑制其抑菌活性.

图3 葡萄糖质量浓度对抑菌活性的影响Fig.3 Influence of glucose concentration on the antifungal activity
2.2.4 大豆蛋白质量浓度对发酵液抑菌活性的影响
保持其他条件不变,培养 48,h后测定发酵液的抑菌活性,比较不同大豆蛋白质量浓度对抑菌活性的影响,结果见表 1.培养基中大豆蛋白质量浓度从10,g/L增加至 50,g/L,乳酸菌发酵液的抑菌活性无明显差异,大豆蛋白质量浓度在 20,g/L时其抑菌活性比其他质量浓度时的略高.
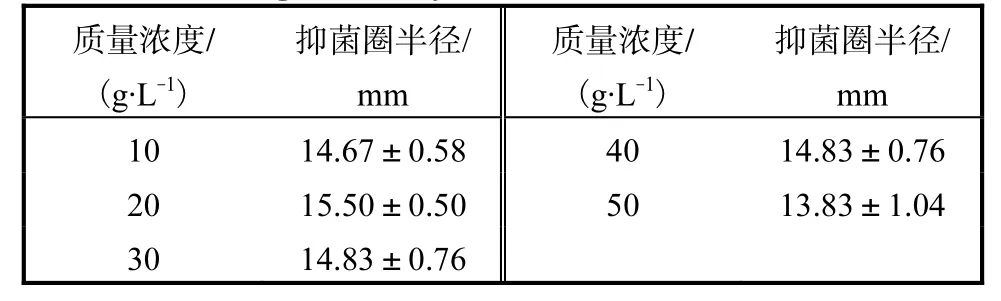
表1 大豆蛋白质量浓度对抑菌活性的影响Tab.1 Influence of soyabean protein concentration on the antifungal activity
2.2.5 正交实验确定最佳培养基成分及培养条件
为进一步提高植物乳杆菌 IMAU10014发酵豆乳培养基的抑菌活性,在上述单因素实验的基础上,选择各因素的3个最佳水平设计正交实验,结果见表2. 由表2可知:4个因素的F比均小于F临界值,因此 4个因素对其影响均不显著.由极差分析可得对植物乳杆菌 IMAU10014抑菌效果影响主次顺序是:温度>葡萄糖质量浓度>大豆蛋白质量浓度>pH,理论最佳组合为温度 37,℃、pH 6.5、葡萄糖 20,g/L、大豆蛋白5,g/L,此时抑菌效果最佳.

表2 大豆蛋白培养基及发酵条件正交实验结果Tab.2 Results of soy protein medium and fermentation condition orthogonal experiment
在此优化条件下进行验证实验,双层平板法检测其对娄地青霉的抑菌活性,最终抑菌圈半径为16.5,mm,抑菌效果与在MRS中的结果十分相近,相比于优化前的抑菌圈半径有显著提高.
2.3 抗真菌活性物质的基本性质
为进一步研究植物乳杆菌 IMAU10014产生抑菌物质的性质,IMAU10014发酵大豆蛋白培养基后,分别检测了不同 pH、温度及酶处理后浓缩上清液的抑菌活性.
2.3.1 pH对抗真菌活性物质的影响
pH对抗真菌活性物质抑菌活性的影响如图4所示.由图 4可知,未经处理的空白组其 pH在 3.5左右,浓缩上清液的抑菌活性随着pH的升高逐渐降低,当 pH为 7.0时最低,但仍有抑菌活性.这说明植物乳杆菌 IMAU10014发酵大豆蛋白培养基产生的抑菌物质除了酸类还有其他物质.这一点与李红娟等[10]报道的 pH对干酪乳杆菌产生的抗真菌物质的影响一致.

图4 pH对抑菌活性的影响Fig.4 Influence of pH value on the antifungal activity
2.3.2 酶处理对抗真菌活性物质的影响
酶处理对抗真菌活性物质抑菌活性的影响如图5所示.由图 5可以看出,中性蛋白酶处理后抑菌活性基本不变,而用蛋白酶 K和胰蛋白酶处理后活性有所降低.这说明此抑菌物质对中性蛋白酶不敏感,对蛋白酶K和胰蛋白酶敏感.因此,可初步断定植物乳杆菌 IMAU10014发酵大豆蛋白培养基产生的抗真菌活性物质中含有蛋白类物质.

图5 酶处理对抑菌活性的影响Fig.5 Influence of enzyme on the antifungal activity
有关产蛋白类抗真菌物质的乳酸菌的报道不多,报道的乳酸菌有以下几种:乳酸乳球菌乳酸亚种(Lc.lactis subsp.lactis)[11]、干酪乳杆菌假植物亚种(Lb.casei subsp.pseudoplantarum)[12]、小球片球菌(P. pentosaceous)[13]、副干酪乳杆菌(L. paracasei)[14]等.关于植物乳杆菌的也有报道,Ström 等[15]发现植物乳杆菌MiLAB393能产生抗真菌的环二肽.
2.3.3 温度对抗真菌活性物质的影响
温度对抗真菌活性物质抑菌活性的影响见表 3.由表3可知,植物乳杆菌IMAU10014发酵后的浓缩上清液分别于 60,℃加热 1,h、80,℃加热 1,h、100,℃加热 1,h、121,℃加热 20,min,抑菌圈大小基本不变.这说明发酵液中的抑菌物质有很好的热稳定性.

表3 温度对抑菌活性的影响Tab.3 Influence of temperature on the antifungal activity
3 结 语
本实验以MRS为培养基从60株植物乳杆菌中筛出8株抑菌活性较好的菌株,又以大豆蛋白和脱脂奶粉为培养基从 8株植物乳杆菌中进一步筛选出 1株具有较强抑菌活性的菌株 IMAU10014,并确定了其发酵培养基为大豆蛋白.对植物乳杆菌 IMAU10014的发酵培养基成分及培养条件进行优化,得到最佳培养基组合及培养条件:葡萄糖 20,g/L、大豆蛋白5,g/L、pH 6.5、温度 37,℃植物乳杆菌 IMAU10014发酵 48,h时抑菌效果最佳.分别检测了不同 pH、温度及酶处理对 IMAU10014发酵浓缩上清液的抑菌活性的影响,结果表明:浓缩上清液在 pH 3.5~7.0范围内均有抑菌活性,且随着 pH的升高抑菌活性逐渐降低.抑菌物质对温度不敏感.经过胰蛋白酶和蛋白酶K处理后抑菌活性有所降低.
[1] 成妮妮. 乳酸菌抗真菌生物防腐剂作用机理和前景展望[J]. 食品工业科技,2012,33(4):430-433.
[2] 袁晶. 植物乳杆菌作用及其应用初探[D]. 杭州:浙江工商大学,2011.
[3] Crowley S,Mahony J,van Sinderen D. Comparative analysis of two antifungal Lactobacillus plantarum isolates and their application as bioprotectants in refrigerated foods[J]. Journal of Applied Microbiology,2012,113(6):1417-1427.
[4] Gerez C L,Torino M I,Rollán G,et al. Prevention of bread mould spoilage by using lactic acid bacteria with antifungal properties[J]. Food Control,2009,20(2):144-148.
[5] Yang E J,Chang H C. Purification of a new antifungal compound produced by Lactobacillus plantarum AF1 isolated from kimchi[J]. International Journal of Food Microbiology,2010,139(1/2):56-63.
[6] 于志会,张雪,李盛钰,等. 植物乳杆菌 C88在酸奶中的应用[J]. 中国乳品工业,2013,41(7):27-30.
[7] Rekha C R,Vijayalakshmi G. Bioconversion of isoflavone glycosides to aglycones ,mineral bioavailability and vitamin B complex in fermented soymilk by probiotic bacteria and yeast[J]. Journal of Applied Microbiology,2010,109(4):1198-1208.
[8] Dalié D K D,Deschamps A M,Richard-Forget F. Lactic acid bacteria-potential for control of mould growth and mycotoxins:A review[J]. Food Control,2010,21(4):370-380.
[9] Batdorj B,Trinetta V,Dalgalarrondo M,et al. Isolation,taxonomic identification and hydrogen peroxide production by Lactobacillus delbrueckii subsp. lactis T31,isolated from Mongolian yoghurt:Inhibitory activity on foodborne pathogens[J]. Journal of Applied Microbiology,2007,103(3):584-593.
[10] 李红娟,刘鹭,张书文,等. Lactobacillus casei AST18抗真菌特性及其在酸奶保鲜中的应用[J]. 中国农业科学,2011,44(19):4050-4057.
[11] Roy U,Batish V K,Grover S,et al. Production of antifungal substance by Lactococcus lactis subsp. lactis CHD-28. 3[J]. International Journal of Food Microbiology,1996,32(1/2):27-34.
[12] Gourama H. Inhibition of growth and mycotoxin production of Penicillium by Lactobacillus species[J].LWT-Food Science and Technology,1997,30(3):279-283.
[13] Rouse S,Harnett D,Vaughan A,et al. Lactic acid bacteria with potential to eliminate fungal spoilage in foods[J]. Journal of Applied Microbiology ,2008 ,104(3):915-923.
[14] 楼秀玉,张晨,张小美,等. 抗烟曲霉乳酸菌菌株的筛选、鉴定及特性初步研究[J]. 浙江农业学报,2013,25(1):176-181.
[15] Ström K,Sjögren J,Broberg A,et al. Lactobacillus plantarum MiLAB 393 produces the antifungal cyclic dipeptides cyclo(L-Phe-L-Pro)and cyclo(L-Phe-trans-4-OH-L-Pro)and 3-phenyllactic acid[J]. Applied and Environmental Microbiology,2002,68(9):4322-4327.

