脂肪因子脂联素、瘦素在退行性瓣膜中的表达特点
陈集敏,谢霆,陈新忠
(1.海南省人民医院病理科,海南海口 570311;2.海南省人民医院心脏外科,海南海口 570311;3.华中科技大学附属协和医院心脏外科,湖北武汉 430022)
·临床病理·
脂肪因子脂联素、瘦素在退行性瓣膜中的表达特点
陈集敏1,谢霆2,陈新忠3
(1.海南省人民医院病理科,海南海口 570311;2.海南省人民医院心脏外科,海南海口 570311;3.华中科技大学附属协和医院心脏外科,湖北武汉 430022)
目的探讨脂肪因子脂联素、瘦素在退行性主动脉瓣的组织表达特点。方法收集2012年10月至2013年10月在海南省人民医院心外科因退行性主动脉瓣疾病行手术切除的主动脉瓣标本30例[男17例,女13例,年龄(55±6)岁],因夹层动脉瘤行Bentall手术切除正常主动脉瓣标本7例[男性4例,女性3例,年龄(41±8)岁]。经HE和免疫组织化学染色,观察退行性主动脉瓣的组织病理学改变,了解脂肪因子脂联素、瘦素在退行性主动脉瓣的表达特点。结果HE染色显示,与正常瓣膜比较,损伤的主动脉层内皮下可见大量炎症细胞聚集、纤维组织增生和结节性钙化灶形成,退行性主动脉瓣的厚度不同程度增加[重度(2.80±1.18)mm、中度(2.10±0.09)mm、轻度(0.92±0.13)mm、正常(0.75±0.07)mm],进一步的分析显示胶原层增厚明显,松质层厚度降低,而心室层无明显改变,免疫组织化学染色显示脂联素在正常瓣膜和退行性主动脉瓣中无表达;瘦素在正常瓣膜无表达,而在退行性主动脉瓣见新生血管以及血管周围有表达。结论退行性主动脉瓣病变中瘦素表达增加。
退行性主动脉瓣病变;脂肪因子;脂联素;瘦素
近年研究发现,脂肪组织不仅是一个能量储存器官,而且是一个具有内分泌功能的组织,它可以分泌多种调控机体代谢和能量平衡的活性因子,包括瘦素、肿瘤坏死因子、纤溶酶原激活物抑制剂、抵抗素、白介素、脂联素等。其中瘦素是最早发现的脂肪因子,瘦素能调节体重和促进动脉粥样硬化的发生发展。脂联素是脂肪组织特异性分泌的具有类似胶原结构的蛋白,被认为是胰岛素抵抗和动脉粥样硬化的保护性因子[1]。目前研究认为退行性主动脉瓣疾病的病理机制类似于主动脉粥样硬化[2],虽然证实脂肪因子参与了动脉粥样硬化的发生发展,但目前尚不清楚脂肪因子脂联素、瘦素是否参与退行性主动脉瓣的病理过程。
1 资料与方法
1.1 一般资料收集2012年10月至2013年10月在我院因退行性主动脉瓣疾病行手术切除的主动脉瓣(病变瓣膜组)标本30例[男性17例,女性13例,年龄(55±6)岁],因夹层动脉瘤行Bentall手术切除的正常主动脉瓣(正常瓣膜作为对照组)标本7例[男性4例,女性3例,年龄(41±8)岁]。排除标准:甲状旁腺疾病和肾功能衰竭等影响钙磷代谢以及炎症所致C反应蛋白和血沉升高的患者。所有组织标本均经患者及家属知情同意后采集,研究方案获医院伦理委员会批准。
1.2 方法本实验随机选取3个正常瓣膜和10个异常的瓣膜,在中部进行测量,所有标本选取最大直径进行测量,每一例标本分别测量心室层、松质层、胶原层厚度及瓣膜总厚度。正常瓣膜为一组,异常瓣膜按照瓣膜增厚呈度分为低、中、高三组,对这四组数据进行统计学分析,比较各组瓣膜不同层的差异。
1.2.1 主动脉瓣膜的制片与观察标本经10%中性甲醛固定,常规脱水、石蜡包埋、5 μm连续切片。为了更好地保存抗原,在切片前标本不行脱钙处理。常规HE染色,显微镜下观察瓣膜的厚度、组织结构、细胞的组成、钙化的部位以及钙化周围的改变。
1.2.2 免疫组织化学染色兔抗人脂联素及瘦素多克隆抗体购自北京博奥森生物技术有限公司,按1:200稀释,采用PV-9000通用型二步法试剂盒。具体操作按试剂盒说明操作,结果判读以出现棕黄色且高出背景色为阳性。
1.3 统计学方法应用SPSS19.0版本统计软件处理和分析数据,计量资料以均数±标准差(±s)表示,两两组间比较采用独立样本t检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 瓣膜组织肉眼观察正常的瓣膜呈半透明状,柔韧性好。病变的瓣膜可见不同程度的钙化,表现为瓣口的狭窄和瓣膜明显增厚、质硬。
2.2 HE染色结果与正常瓣膜比较[(0.75± 0.07)mm],损伤的主动脉层内皮下可见大量炎症细胞聚集、纤维组织增生和结节性钙化灶形成,退行性主动脉瓣的厚度不同程度增加[重度(2.80±1.18)mm,中度(2.10±0.09)mm,轻度(0.92±0.13)mm],重度、中度、轻度瓣膜狭窄患者分别与正常瓣膜厚度比较,重度瓣膜狭窄t值=22.60、P<0.001(双侧);中度瓣膜狭窄t值= 11.77、P<0.001(双侧);轻度瓣膜狭窄t值=3.13、P= 0.017(双侧),其差异均具有统计学意义,进一步的分析显示胶原层增厚明显,松质层厚度降低,而心室层无明显改变,见表1。
表1 正常瓣膜和退行性主动脉瓣组织厚度比较(mm,±s)
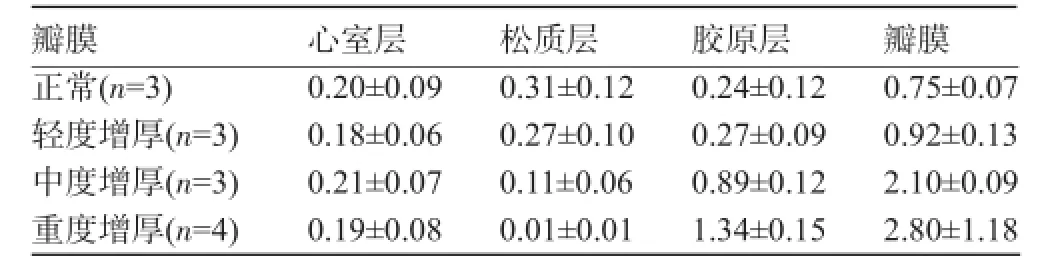
表1 正常瓣膜和退行性主动脉瓣组织厚度比较(mm,±s)
瓣膜心室层松质层胶原层瓣膜正常(n=3)轻度增厚(n=3)中度增厚(n=3)重度增厚(n=4) 0.20±0.09 0.18±0.06 0.21±0.07 0.19±0.08 0.31±0.12 0.27±0.10 0.11±0.06 0.01±0.01 0.24±0.12 0.27±0.09 0.89±0.12 1.34±0.15 0.75±0.07 0.92±0.13 2.10±0.09 2.80±1.18
2.3 脂联素或瘦素表达特点免疫组织化学染色显示,脂联素在正常瓣膜和退行性主动脉瓣中无表达;瘦素在正常瓣膜无表达,而在退行性主动脉瓣见新生血管以及血管周围有表达,见图1。
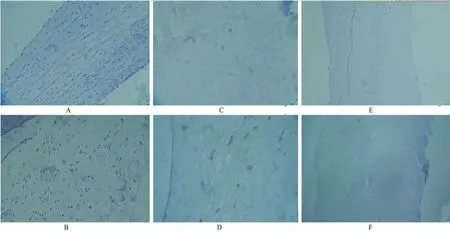
图1 正常和病变瓣膜脂联素和瘦素免疫组织化学染色
3 讨论
正常瓣膜主要由5层构成,依次为瓣膜主动脉面的内皮层、富含胶原纤维的胶原层、致密基质较少并排列疏松的间质细胞构成的松质层、有明显弹力纤维的心室层、瓣膜心室面的内皮层。正常的瓣膜中纤维排列整齐,无血管、炎性细胞浸润[3],退行性主动脉瓣较正常瓣膜增厚,损伤的主动脉瓣内皮下可见大量炎症细胞聚集,血管生成,在炎症细胞下方可见结节性钙化灶存在,由于炎症细胞浸润和钙化结节的挤压效应导致钙化下面的松质层消失,而炎症细胞刺激纤维增生导致病变瓣膜纤维增厚紊乱。
目前对退行性主动脉瓣疾病的研究显示,其致病机制类似于主动脉粥样硬化,在血流动力学冲击下瓣膜正常的结构受到破坏,导致主动脉瓣内皮层以及胶原纤维损伤、血脂积聚、炎性细胞浸润、泡沫细胞和血管生成,最终瓣膜钙化[2]。但目前脂肪因子和退行性主动脉瓣钙化之间的研究较少,尚不清楚脂肪因子是否参与了退行性主动脉瓣病变。既往脂肪组织被认为是一个无效的身体车厢,只作为储存能量。近年来越来越多的数据表明,脂肪组织是重要的内分泌和旁分泌器官,能够产生多种酶、激素和生长因子(统称为脂肪因子)。研究表明,脂肪因子除了调节影响葡萄糖、脂肪代谢,还与肥胖和代谢性疾病有关,如脂肪代谢异常密切相关的动脉粥样硬化,目前呈几何级增长的文献显示,脂肪因子影响了动脉粥样硬化的发生发展,调节血管中内皮细胞、平滑肌细胞、泡沫细胞、炎症细胞的活性[1,4]。
脂联素是经典的脂肪因子,在动物试验中通过药理或遗传方法升高血浆脂联素,能够减轻肥胖诱导的血管内皮功能障碍与高血压,还可以防止动脉粥样硬化、心肌梗塞和糖尿病性心肌病。此外,脂联素是保护心血管健康的血管扩张剂,在心脏和血管细胞起抗凋亡,抗炎和抗氧化活性[5],而本实验退行性主动脉瓣并未发现脂联素表达,且在正常瓣膜中也未见表达,这提示动脉粥样硬化可能与钙化性主动脉瓣存在不同的机制。
血液中脂肪因子瘦素升高是心肌梗死的危险因子[6],它与动脉粥样斑块里的C反应蛋白和可溶性IL-6受体正相关[7]。动物实验观察到瘦素导致血管平滑肌细胞增生和基质金属蛋白酶2产生,在动脉粥样硬化晚期促进粥样斑块的破裂[8-10];瘦素还可以促纤维化细胞因子分泌进而导致血管生成[11],增加人和小鼠巨噬细胞分泌促动脉粥样硬化的脂蛋白脂肪酶[12],加剧血小板聚集[13],诱导内皮细胞C反应蛋白表达[14]。在现有的研究中认为瘦素促进了动脉粥样硬化的发生发展。本实验病理标本检查发现,在正常瓣膜未见瘦素表达,而钙化瓣膜出现瘦素的表达,表明瘦素参与了瓣膜钙化的发生发展,同时实验也发现瘦素主要在新生血管以及血管周围表达,提示退行性主动脉瓣中的瘦素可能来源于血液中。
本实验研究表明,特定的脂肪因子与退行性瓣膜病变发生发展密切相关,为了解退行性瓣膜病变的机制研究提供了新的视角,也为以后的诊断治疗提供了可能的理论依据。
[1]Ntaios G,Gatselis NK,Makaritsis K,et al.Adipokines as mediators of endothelial function and atherosclerosis[J].Atherosclerosis. 2013,227(2):216-221.
[2]Otto CM.Calcific aortic stenosis—time to look more closely at the valve[J].N Engl J Med,2008,359(13):1395-1398.
[3]Otto CM,Kuusisto J,Reichenbach DD,et al.Characterization of the early lesion of'degenerative'valvular aortic stenosis.Histological and immunohistochemical studies[J].Circulation,1994,90(2): 844-853.
[4]Scotece M,Conde J,Gomez R,et al.Role of adipokines in atherosclerosis:interferences with cardiovascular complications in rheumatic diseases[J].Mediators Inflamm,2012,2012:125458.
[5]Hui X,Lam KS,Vanhoutte PM,et al.Adiponectin and cardiovascular health:an update[J].Br J Pharmacol,2012,165(3):574-590.
[6]Sierra-Johnson J,Romero-Corral A,Lopez-Jimenez F,et al.Relation of increased leptin concentrations to history of myocardial infarction and stroke in the United States population[J].Am J Cardiol,2007,100(2):234-239.
[7]Karaduman M,Oktenli C,Musabak U,et al.Leptin,soluble interleukin-6 receptor,C-reactive protein and soluble vascular cell adhesion molecule-1 levels in human coronary atherosclerotic plaque [J].Clin Exp Immunol,2006,143(3):452-457.
[8]Zeidan A,Purdham DM,Rajapurohitam V,et al.Leptin induces vascular smooth muscle cell hypertrophy through angiotensinⅡ-and endothelin-1-dependent mechanisms and mediates stretch-induced hypertrophy[J].J Pharmacol Exp Ther,2005,315(3):1075-1084.
[9]Li L,Mamputu JC,Wiernsperger N,et al.Signaling pathways involved in human vascular smooth muscle cell proliferation and matrix metalloproteinase-2 expression induced by leptin:inhibitory effect of metformin[J].Diabetes,2005,54(7):2227-2234.
[10]Park HY,Kwon HM,Lim HJ,et al.Potential role of leptin in angiogenesis:leptin induces endothelial cell proliferation and expression of matrix metalloproteinases in vivo and in vitro[J].Exp Mol Med, 2001,33(2):95-102.
[11]Quehenberger P,Exner M,Sunder-Plassmann R,et al.Leptin induces endothelin-1 in endothelial cells in vitro[J].Circ Res,2002,90 (6):711-718.
[12]Maingrette F,Renier G.Leptin increases lipoprotein lipase secretion by macrophages:involvement of oxidative stress and protein kinase C[J].Diabetes,2003,52(8):2121-2128.
[13]Corsonello A,Malara A,Ientile R,et al.Leptin enhances adenosine diphosphate-induced platelet aggregation in healthy subjects[J]. Obes Res,2002,10(4):306.
[14]Singh P,Hoffmann M,Wolk R,et al.Leptin induces C-reactive protein expression in vascular endothelial cells[J].Arterioscler Thromb Vasc Biol,2007,27(9):302-307.
Expression characteristics of adiponectin and leptin in degenerative valve.
CHEN Ji-min1,XIE Ting2,CHEN Xin-zhong3.1.Department of Pathology,People's Hospital of Hainan Province,Haikou 570311,Hainan,CHINA;2. Department of Cardiac Surgery,People's Hospital of Hainan Province,Haikou 570311,Hainan,CHINA;3.Department of Cardiac Surgery,Union Hospital Affiliated to Huazhong University of Science and Technology,Wuhan 430022,Hubei,CHINA
ObjectiveTo investigate the expression of adiponectin and leptin in degenerative aortic valve. MethodsThe aortic valve specimens from October 2012 to October 2013 were collected in cardiac surgery department of People's Hospital of Hainan Provincial,which included 30 cases of specimens removed from degenerative aortic valve disease[17 cases of males,13 cases of females,aged(55±6)years old]and 7 cases of normal aortic valve specimens with dissecting aneurysm underwent Bentall operation resection[4 cases of males,3 cases of females,aged(41±8)years old]. And then the histopathological changes of degenerative aortic valve were observed by HE and immunohistochemical staining to study the expression characteristics of adiponectin and leptin.ResultsBy HE staining,compared with the normal valve,collection of amount of inflammatory cells,fibrous tissue hyperplasia and nodular calcification in injury endothelium of aortic layer were noted,and the thickness of degenerative aortic valve increased in varying degrees[severe (2.80±1.18)mm,moderate(2.10±0.09)mm,mild(0.92±0.13)mm,normal(0.75±0.07)mm].Further analysis showed a increase in the thickness of collagen layer,and a decrease in the thickness of trabecular layer,with no obvious change in the ventricular layer.By immunohistochemical staining,there was no expression of adiponectin in normal and degenerative aortic valve and no expression of leptin in normal valve,but the expression of leptin could be observed in and around new vessels of the degenerative aortic valve.ConclusionThe expression of leptin increases in degenerative aortic valve.
Degenerative aortic valve disease;Adipokines;Adiponectin;Leptin
R36
C
1003—6350(2014)16—2455—03
10.3969/j.issn.1003-6350.2014.16.0958
2014-04-04)
国家自然科学基金(编号:81270265);海南省卫生厅基金(编号:2012-07)
谢霆。E-mail:masterxieting@hotmail.com