原发性胃淋巴瘤58例临床诊治及其预后影响因素分析
林煜光,李曦,吴子刚
(北京大学深圳医院消化内科,广东 深圳 518036)
·论著·
原发性胃淋巴瘤58例临床诊治及其预后影响因素分析
林煜光,李曦,吴子刚
(北京大学深圳医院消化内科,广东 深圳 518036)
目的探讨原发性胃淋巴瘤(PGL)的临床特征和影响预后的相关因素。方法回顾性分析我院58例原发性胃淋巴瘤患者的临床、胃镜、病理及随访资料,采用单因素和多因素方法分析影响预后的相关因素。结果本组患者胃镜下肿瘤好发于胃窦及胃体,黏膜相关淋巴组织淋巴瘤(MALToma)和弥漫大B细胞淋巴瘤(DLBCL)是主要病理类型,1、3、5年累积生存率分别为86.5%、76.1%和69.8%。单因素分析显示血清乳酸脱氢酶水平(LDH)、B症状、病理类型及临床分期是影响预后的相关因素(P<0.05),多因素分析显示B症状、病理类型、临床分期是影响预后的独立因素(P<0.05)。结论PGL临床表现缺乏特异性,B症状、病理类型、临床分期是影响预后的独立因素,在制定治疗方案及判断预后时应充分考虑上述因素。
原发性胃淋巴瘤;幽门螺杆菌;临床病理;预后;影响因素
原发性胃淋巴瘤(Primary gastric lymphoma,PGL)发病率很低,约占胃恶性肿瘤的2%~8%[1],其临床和内镜下的表现无特异性,极易误诊,预后较胃癌要好,但有关影响原发性胃淋巴瘤长期生存的预后分析国内研究较少。本文回顾性分析我院58例原发性胃淋巴瘤患者的临床资料,探讨其临床、胃镜下表现、病理资料及治疗方法与生存预后的关系。
1 资料与方法
1.1 资料收集收集我院2003年1月至2013年10月间收治的PGL患者的临床资料,共检索到63例,剔除资料不完整者5例,最终58例纳入本次研究。其中男性32例、女性26例,年龄22~79岁,平均(45.5±11.8岁)。临床资料包括患者的性别、年龄、有无伴随B症状、血清乳酸脱氢酶(LDH)水平、幽门螺杆菌(Helicobater pylori,Hp)感染情况、β2微球蛋白水平、胃镜下肿瘤位置、病理类型、临床分期及治疗方式。
1.2 诊断标准及临床分期全部病例均符合Dawson关于原发性胃淋巴瘤的诊断标准[2]。临床分期采用改良的Ann Arbor分期系统:I期(IE)肿瘤仅限于胃壁;Ⅱ期(ⅡE)除胃肿瘤外,腹腔淋巴结受累;Ⅲ期(ⅢE)除胃内肿瘤外,横膈两侧淋巴结受累;Ⅳ期(ⅣE)除胃内肿瘤外,全身各处被瘤组织侵犯[3]。Hp感染的诊断主要依靠13C/14C尿素呼气试验或胃镜下胃黏膜组织学检查。
1.3 随访预后情况通过返院复查或电话随访获得,以患者死亡或本文截稿时为随访终点。
1.4 统计学方法应用SPSS17.0统计软件,计数资料的分析采用χ2检查,应用Kaplan-Meier法计算生存率及生存期并进行单因素分析,多因素分析采用Cox比例风险回归模型进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 临床及胃镜下表现临床症状无特异性,大多起病隐匿,首发症状为腹痛42例(72.4%)、腹胀23例(39.6%)、反酸嗳气19例(32.8%)、呕血或黑便16例(27.6%)、恶心呕吐9例(15.5%)、腹部肿块8例(13.8%),有淋巴瘤B组症状(发热、盗汗或体重下降)者23例(39.7%),全部病例均无浅表淋巴结或肝脾肿大。52例患者行胃镜检查,病灶局限在胃窦21例(40.4%)、胃体12例(23.1%)、胃角6例(11.5%),同时侵犯2个部位12例(23.1%),1例侵犯全胃及贲门。胃镜下表现为溃疡型21例(40.4%),肿块型18例(34.6%),浸润型13例(22.4%)。
2.2 病理结果按2001年世界卫生组织(WHO)淋巴瘤诊断标准,全部病例均为非霍奇金淋巴瘤,其中弥漫大B细胞淋巴瘤(DLBCL)32例(55.2%),胃黏膜相关淋巴样组织(MALT)淋巴瘤25例(43.1%),T细胞淋巴瘤1例。43例(74.1%)提示存在Hp感染,其中DLBCL中20例(62.5%)存在Hp感染,MALT淋巴瘤中23例(92.0%)存在Hp感染,两者差异无统计学意义(χ2=1.313,P=0.32)。
2.3 临床分期根据胃镜、超声内镜、腹部CT或PET-CT、骨髓穿刺及术后病理,参照改良的Ann Arbor分期系统,本组患者Ⅰ期16例(27.6%),Ⅱ期15例(25.7%),Ⅲ期13例(22.4%),Ⅳ期14例(24.1%)。
2.4 治疗情况58例患者中手术治疗28例,其中根治性手术25例:全胃切除10例,远端胃大部切除术15例;姑息性手术3例。15例术后联合化疗。30例非手术患者中,16例早期(Ⅰ/Ⅱ期)MALT淋巴瘤仅给予根除Hp治疗,12例晚期患者及4例根除Hp无效或复发者给予化疗或局部放疗。根除Hp治疗方案首选质子泵抑制剂联合两种抗生素的三联或加用铋剂的四联疗法(如埃索美拉唑+阿莫西林+克拉霉素+胶体果胶铋,疗程7~14 d,若无效采用二线方案)。化疗患者中19例(61.3%)采用CHOP方案(环磷酰胺、阿霉素、长春新碱、泼尼松),7例(22.6%)采用COP方案(环磷酰胺、长春新碱、泼尼松),8例(25.8%)采用含氟达拉滨方案。化疗患者中15例(48.4%)联合应用利妥昔单抗。
2.5 生存分析本组患者随访时间2~96个月,中位随访时间为38个月。58例患者中41例(70.7%)存活,17例(29.3%)死亡(其中14例死于胃淋巴瘤,另外3例中有1例合并原发性肝癌,1例合并结肠癌,1例外科手术后合并感染性休克死亡)。Kaplan-Meier生存分析显示,本组患者的1、3、5年累积生存率分别为86.5%、76.1%和69.8%(见图1)。
2.6 影响预后的单因素分析结果将年龄、性别、胃镜下肿瘤位置、LDH水平、Hp感染情况、B症状、β2微球蛋白水平、病理类型、临床分期及治疗方式(手术、非手术)这10个指标纳入分析,结果显示LDH水平、B症状、病理类型、临床分期这4个变量在各分类间生存率差异有统计学意义(P<0.05),见表1。

图1 58例胃淋巴瘤患者总体生存曲线
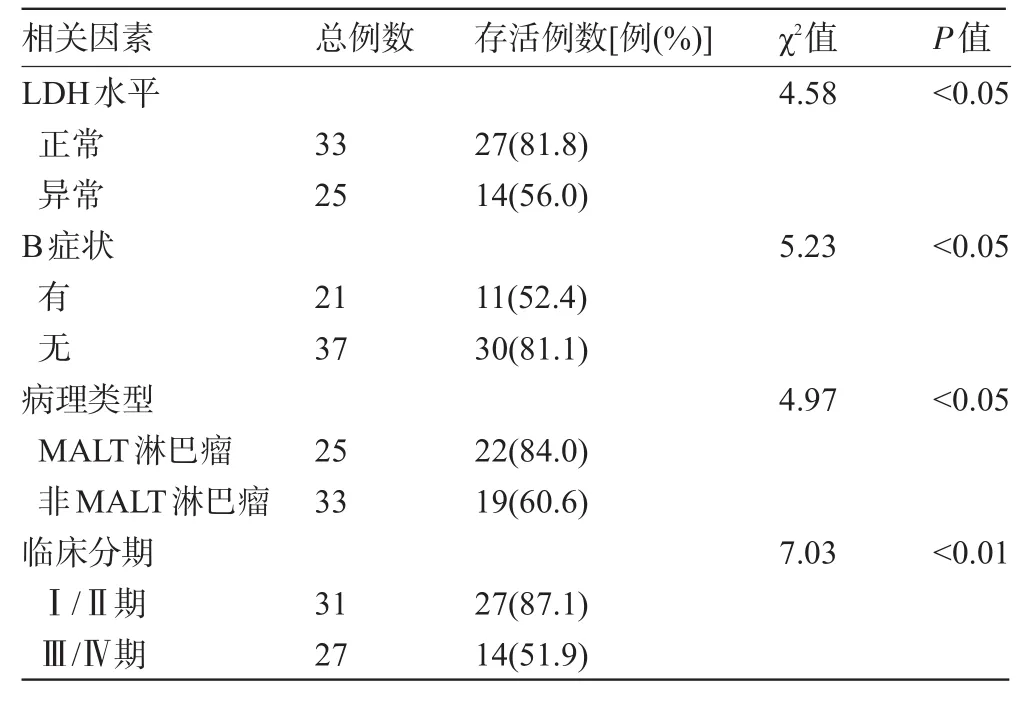
表1 影响胃淋巴瘤预后的单因素分析结果
2.7 影响预后的多因素分析结果将单因素分析中具有统计学意义的因素纳入Cox比例风险模型中进行多因素分析,结果显示B症状、病理类型、临床分期是影响预后的独立危险因素(见表2)。
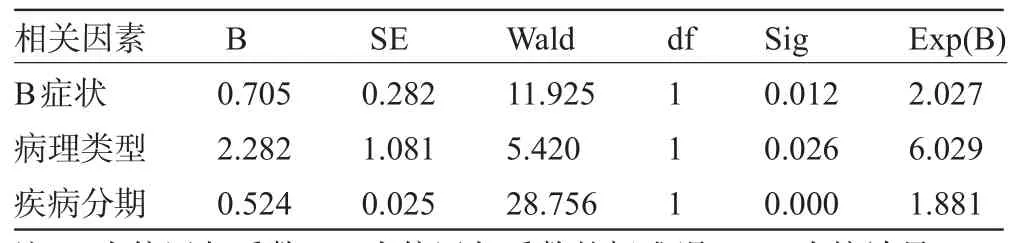
表2 多因素预后分析
3 讨论
原发性胃淋巴瘤是起源于胃黏膜下层淋巴组织的恶性肿瘤,多数病例病程长,进展缓慢,绝大多数为B淋巴细胞来源,MALT淋巴瘤和DLBCL为两种主要的组织学类型,T淋巴细胞来源的PGL较罕见[4]。本研究显示MALT淋巴瘤和DLBCL分别占43.1% (25/58)和55.2%(32/58),与文献报道相符[4]。PGL的临床表现以非特异性的胃肠道症状为主,常见的症状包括腹痛、腹胀、反酸、嗳气、呕血或黑便,本组出现淋巴瘤B组症状者23例(39.7%),仅占少部分。PGL早期病变位于黏膜下层,并于黏膜和肌层内沿纵轴浸润扩散,故常规胃镜检查不易发现。结合本组资料及文献报道,胃镜下PGL累及部位以胃窦、胃体多见,可能与Hp常定植于胃窦和胃体有关,常同时累及多个部位甚至全胃,多表现为溃疡型病变,肿块型及浸润型次之。胃镜下表现多形性、多灶性、弥漫性,故临床诊断困难,误诊率高,对临床疑似者进行活检时应强调多点、多次和深凿活检,或使用圈套器将黏膜及黏膜下组织提起后切割活检,并结合免疫组织化学以提高诊断率。对于反复活检未能明确诊断的病例,建议尽早行超声内镜检查及确定疑似病变部位,进而有目的地深取大块组织活检。
原发性胃淋巴瘤的治疗方法包括手术、化疗、放疗、根除Hp及免疫治疗等,目前在国内外尚无统一的最佳治疗方案。以往多数学者主张以手术切除为主,术后辅以化疗的综合治疗方案[5],但手术需要切除部分乃至全胃,有一系列的近期和远期并发症,影响患者生活质量。Papaxoinis等[6]的研究认为原发性胃肠淋巴瘤患者手术联合化疗的预后情况与单纯化疗无显著性差异。Koch等[7]在一项多中心临床研究中认为原发性胃肠道非霍杰金淋巴瘤患者手术联合放疗与化疗联合放疗的5年生存率相似。本组研究单因素分析也显示手术与非手术治疗对预后的影响无显著性差异。可见,手术方式并不是影响预后的关键因素。对于MALT淋巴瘤,大量的流行病学研究已经证实该病的发生发展与Hp感染密切相关,Hp感染率可高达90%。根除Hp为MALT淋巴瘤治疗的第一选择,能使70%~80%的患者完全缓解,手术治疗在该病中的地位已逐渐下降,仅用于出现穿孔、内镜下不能控制的出血等并发症的患者[8]。
原发性胃淋巴瘤的预后优于胃癌,5年生存率可高于60%,甚至有文献报道可高达80%以上[9],本组病例为69.8%,与文献报道相仿,生存率较高考虑与病例组中预后较好的MALT淋巴瘤比例较高有关。目前国内外关于影响原发性胃淋巴瘤预后相关因素的研究结果差异较大。Papaxoinis等[6]在一项包括128例非何杰金淋巴瘤的临床研究中认为主要的预后因素为疾病临床分期。Lv等[10]的研究结果显示消瘦、肿瘤位置、治疗方法、病理类型及肿瘤分期是影响PGL患者生存的独立因素。Oh等[11]的研究结果显示MALT淋巴瘤患者伴随B症状为预后不良的危险因素。本研究单因素分析显示LDH水平、B症状、病例类型及临床分期与预后相关,多因素分析结果显示B症状、病理类型、临床分期是影响PGL预后的独立危险因素,这一结果与上述部分文献的结果相符,提示伴随B症状者预后不佳,MALT淋巴瘤预后较非MALT淋巴瘤为好,临床分期I/II期的患者5年生存率优于Ⅲ/Ⅳ期患者。故建议对伴随B症状,病理类型为非MALT淋巴瘤、分期为Ⅲ/Ⅳ期的患者采取更加积极的治疗措施以提高疗效及生存率。LDH水平可反映PGL的肿瘤负荷,Medina-Franco等[12]的研究认为高LDH水平提示预后不良,单因素分析也显示不同LDH水平患者的生存率差异有统计学意义,但多因素分析未发现LDH是影响预后的独立危险因素,提示在不考虑其他因素的时候,LDH水平不同其预后也不同。
综上所述,PGL临床表现缺乏特异性,伴随B症状、病理类型、临床分期是影响预后的独立危险因素,临床上在制定治疗方案及预后判断时应充分考虑以上因素,综合分析制定个体化方案才能得到满意的疗效。由于本研究为回顾性研究,且病例数较少,不可避免存在各种偏倚,比如选择性偏倚、信息偏倚,尚需组织多中心、大样本的前瞻性随机对照研究来探讨相关因素对预后的影响。
[1]AI-Akwaa AM,Siddiqui N,Ai-Mofleh IA.Primary gastric lymphoma[J].World J Gastroenterol,2004,10(1):5-11.
[2]Dawson IM,Cornes JS,Morson BC.Primary malignant lymphoid tumours of the intestinal tract.Report of 37 cases with a study of factors influencing prognosis[J].Br J Surg,1961,49(1):80-89.
[3]Lister T,Crowther D,Sutcliffe SB,et a1.Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin's disease:Costwords meeting[J].J Clin Oncol,1989,7(11): 1630-1636.
[4]Rotaru I,Ciurea T,Foarfă C,et a1.The diagnostic characteristics of a group of patients with primary gastric lymphoma:macroscopic, histopathological and immunohistochemical aspects[J].Rom J Morphol Embryol,2012,53(2):343-350.
[5]Parvez T,Behani A,Ali A.Primary gastric lymphoma[J].J Coil Physicians Surg Pak,2007,17(1):36-40.
[6]Papaxoinis G,Papageorgiou S,Rontogianni D,et al.Primary gastrointestinal non-Hodgkin's lymphoma:a clinicopathalogic study of 128 cases in Greece.A Hellenic Cooperative Oncology Group study (HeCOG)[J].Leuk Lymphoma,2006,47(10):2140-2146.
[7]Koch P,del Valle F,Berdel WE,et al.Primary gastrointestinal non-Hodgkin's lymphoma:Ⅱ.Combined surgical and conservative or conservative management only in localized gastric lymphoma-Resultsof the prospective German Multicenter Study GIT NHL 01/92[J].J Clin Oncol,2001,19(18):3874-3883.
[8]Fischbach W.MALT lymphoma:forget surgery?[J].Dig Dis,2013, 31(1):38-42.
[9]Gospodarowicz MK,Pintilie M,Tsang R,et al.Primary gastric lymphoma:brief overview of the recent Princess Margaret hospital experience[J].RecentResultsCancer Res,2000,156:108-115.
[10]Lv Y,Wang XN,Liang H.Clinical analysis of 200 patients with primary gastric lymphoma[J].Zhonghua Wei Chang Wai Ke Za Zhi, 2012,15(2):157-160.
[11]Oh SY,Kim WS,Kim JS,et al.Multiple mucoca-associated lymphoid tissue organs involing marginal zone B cell lymphoma:organ-specific relationships and the prognostic factors.Consortium for improving survival of lymphoma study[J].Int J Hematol,2010,92 (3):510-517.
[12]Medina-Franco H,Germes SS,Maldonado CL.Prognostic factors in primary gastric lymphoma[J].Ann Surg Oncol,2007,14(8): 2239-2245.
Clinical treatment and prognosis of 58 cases of primary gastric lymphoma.
LIN Yu-guang,LI Xi,WU Zi-gang. Department of Gastroenterology,Shenzhen Hospital of Peking University,Shenzhen 518036,Guangdong,CHINA
ObjectiveTo analyze the clinical characteristics and prognosis of primary gastric lymphoma (PGL).MethodsWe retrospectively analyzed the clinical and endoscopic characteristics,pathology and follow-up data of 58 PGL cases,and tried to define possible factors that influence the prognosis by univariate and multivariate analysis.ResultsPrimary gastric lymphoma mostly occurred in gastric antrum and gastric body.MALT lymphoma and DLBCL were the most common pathological subtypes.Overall cumulative survivals of 1,3 and 5 years were 86.5%,76.1%and 69.8%respectively.The univariate analysis showed that LDH level,B symptoms,pathological types and clinical stages were prognostic factors(P<0.05).Multivariate analysis indicated that B symptoms,pathological types and clinical stages were independent prognostic factors(P<0.05).ConclusionThe clinical characteristics of PGL were non-specific.B symptoms,pathological types and clinical stages were independent prognostic factors, which was helpful to make treatments and evaluate prognosis.
Primary gastric lymphoma;Helicobacter pylori;Clinical pathology;Prognosis;Influence factor
R735.2
A
1003—6350(2014)13—1906—03
10.3969/j.issn.1003-6350.2014.13.0740
2014-02-16)
吴子刚。E-mail:31550662@qq.com

