4-哌啶乙酸乙酯的合成研究(2)
廖 戎
(西南民族大学化学与环境保护工程学院,四川 成都,610041)
1 前言
杂环化学有着悠久的历史,其主要任务是研究杂环化合物的结构、性质、合成及应用的一门重要学科。杂环化学在有机合成化学、分子生物学、医药化学、农药化学、染料化学等有着极其广泛的应用,因而杂环化学的研究引起了无数研究者的重视,是化学科学目前最活跃的一个研究领域[1]。
哌啶是一种非常重要的六元氮杂环化合物,许多天然产物中含有哌啶的结构单元。哌啶环是药物中最常见的一类杂环,哌啶可用于合成农业化学品和橡胶助剂,哌啶还可以合成多种重要的精细化工中间体,在精细化学品的分子中引入哌啶结构单元已成为开发新品的重要手段之一。哌啶酮结构是许多新开发药物及助剂的重要中间体。4-哌啶甲酸及其衍生物也是重要的农药、医药中间体,具有这类结构的化合物具有很好的反应活性和生物活性,因此广泛应用于药物合成中[2-5]。
本试验主要是对哌啶类化合物的一种衍生物4-哌啶乙酸乙酯的合成进行研究[6]。4-哌啶乙酸乙酯具有重要的生理活性,在医药、生化、临床上具有广阔的应用前景,是一种重要的医药、农药中间体,尤其在镇定类药物、抗心律失常类药物中大量使用,具有广泛的科研药用价值[5,7]。近年来,4-哌啶乙酸乙酯类化合物及其衍生物的合成和应用研究备受人们关注,进行这类化合物的合成是当前研究的重点之一。
2 实验结果与分析
前文根据以下合成路线,以4-哌啶甲酸为起始原料,进行了 N-Boc-4-哌啶甲醇的合成、N-Boc-4-哌啶甲醇的合成、N-Boc-4-哌啶甲醇 TS的合成、NBoc-4-哌啶甲氰的合成、N-Boc-4-哌啶乙酸的合成、4-哌啶乙酸乙酯盐酸盐的合成、4-哌啶乙酸乙酯的合成。
最后得到目标产物,产率为77.14%。下面就各合成步骤及处理过程进行分析讨论。
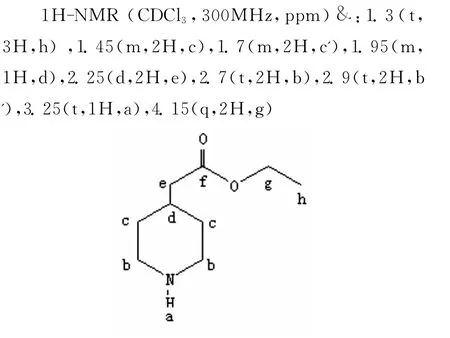
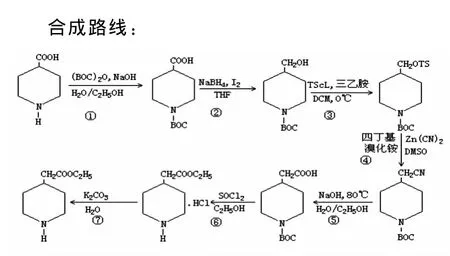
2.1 N-Boc-4-哌啶甲酸的合成及处理过程分析
合成路线①这步反应主要是在氮位上增加一个Boc基团,从而保护哌啶上的氨基,但由于Boc在酸性条件下极其不稳定,所以反应应在碱性条件下进行。加入NaOH时,由于NaOH溶解是一个放热反应且很剧烈,所以应缓慢加到反应液中,边加边搅拌。由于反应是一个放热过程,(Boc)2O应先用乙醇溶解后,再分批缓慢加到反应体系中,否则反应过于剧烈容易冲料。反应中(Boc)2O是过量的,同时N-Boc-4-哌啶甲酸中的Boc基团在强酸和高温条件下都容易被脱掉,所以应用2mol·L-1稀盐酸调pH值=3中和过量的(Boc)2O,此反应非常剧烈,会放出大量CO2气泡,应缓慢分批加入稀盐酸,同时冰水浴降温。反应中有大量白色固体析出,此固体就是N-Boc-4-哌啶甲酸。实验中采用大量水洗涤白色固体,目的是洗去固体中所含无机盐,再用石油醚洗涤,目的是洗去固体中所含水分。
2.2 N-Boc-4-哌啶甲醇的合成及处理过程分析
合成路线②这步反应是一个还原反应。在采用还原剂时[8],分别选用了LiAlH4和 NaBH4两种还原剂,从反应程度、反应时间、反应产物等进行了比较,如表1。

表1 还原剂对反应的影响
由表1可以看出,还原剂采用LiAlH4比NaBH4反应更剧烈、时间更短,但LiAlH4的还原性太强,将Boc脱掉不利于反应。综上分析,最终反应选用NaBH4作还原剂。
对反应②中的另一反应试剂,文献介绍可用浓硫酸或用碘单质[8],本试验分别从反应过程和反应结果进行了比较,如表2。

表2 反应试剂对反应的影响
由表2可知,用碘单质作反应试剂比浓硫酸效果更好,因此最终反应选用的是碘单质。
第②步实验过程分析:此反应是一个羧基被NaBH4还原为醇羟基的还原反应。因NaBH4会与水发生反应,所以整个反应是在无水环境下以重蒸四氢呋喃作溶剂进行的,由于Boc基团在温度很高时容易脱掉,所以整个反应都要用掺有氯化钠或乙醇的冰水浴来降温。NaBH4加到反应液中会放热并产生大量气泡,所以加入时应控制温度(T<5℃),并缓慢加入。加入碘单质时,NaBH4会和碘单质剧烈反应,也应缓慢加入。上述反应结束后,用水反应消耗掉过量的NaBH4,同时产物溶在水相和四氢呋喃中,先蒸掉四氢呋喃,再利用相似相溶原理用乙酸乙酯将产品从水相中萃取出来。
2.3 N-Boc-4-哌啶甲醇 TS的合成及处理过程的分析
合成路线③这步反应是一个醇解反应。反应需要在无水低温下进行,本实验分别从反应溶剂和反应试剂两个方面作了对比:
(1)反应溶剂对反应时间和产率的影响,如表3。

表3 反应溶剂对反应的影响
由表3可知,选用二氯甲烷作溶剂的产率要比丙酮高,本步实验选用二氯甲烷作反应溶剂。
(2)反应试剂对反应产率的影响,如表4。
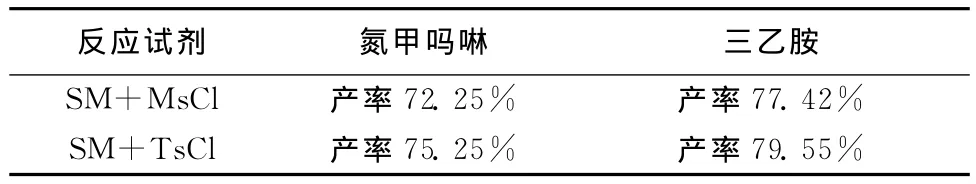
表4 反应试剂对反应产率的影响
由表4可知,溶剂选用二氯甲烷,实验中选用TsCl和三乙胺作试剂反应效果更好。
第③步反应液处理分析:因很难抽滤,所以最好用玻砂漏斗抽滤。第一次水洗滤液的目的是为了洗去有机相中所带的盐类杂质;第二次水洗滤液的目的一方面进一步洗去盐类杂质,另一方面是利用产物在水中溶解度很小的性质,使产物从水中析出,从而得到更纯的产物。
2.4 N-Boc-4-哌啶甲氰的合成及处理过程的分析
合成路线④这步反应是一个增碳反应。此反应要用到有毒物质氰化锌,氰化锌在有酸的情况下,容易生成剧毒物质氢氰酸,氢氰酸有很强的挥发性非常危险,所以整个反应不能有酸。加适量水的目的是为了增加氰化锌的溶解性以便更好的参加反应,有助于氰化锌更好的溶在DMSO中起到相转移的作用,从而使反应更好的进行,四丁基溴化铵是相转移催化剂。反应废液用NaOH调pH值=8.5~9,加入NaClO,不断搅拌,处理完毕再倒入单独的废液缸中。整个反应及处理过程都要注意防毒,避免氰化锌直接接触皮肤或吸入氰化锌粉尘。
2.5 N-Boc-4-哌啶乙酸的合成及处理过程分析
合成路线⑤这步反应是氰基在碱性条件下水解为羧酸的反应。
处理反应液:第一次旋蒸的目的是为了蒸出反应液中的乙醇,pH值调到8是为了使生成的钠盐溶解到水中,便于用乙酸乙酯和石油醚的混合液萃取反应液中的杂质。第二次旋蒸的目的是为了蒸出乙酸乙酯和石油醚,调酸的目的是为了使刚才形成的钠盐重新变为羧酸,用2mol·L-1稀盐酸调pH值至3,是为了防止酸性过强脱掉Boc基团,反应液要尽快处理不能长期放置。再次用乙酸乙酯萃取产品,萃完后用饱和食盐水洗涤的目的一方面是除去有机相中的杂质,另一方面是为了洗去有机相中掺杂的酸,使pH值从3变到5~6,从而避免酸性过强脱掉Boc基团。最终产品为白色固体,如是黄色油状物,说明含有大量杂质,应多次萃取,提纯。
2.6 4-哌啶乙酸乙酯盐酸盐的合成及处理过程分析
合成路线⑥这步反应是羧酸与醇发生的酯化反应。实验分别从飞歇尔酯化反应(浓硫酸作催化剂)、氯化亚砜作用下酯化反应、Steglich酯化反应、三甲基氯硅烷作用下的酯化反应等四种酯化反应进行了对比[9-10],如表5。
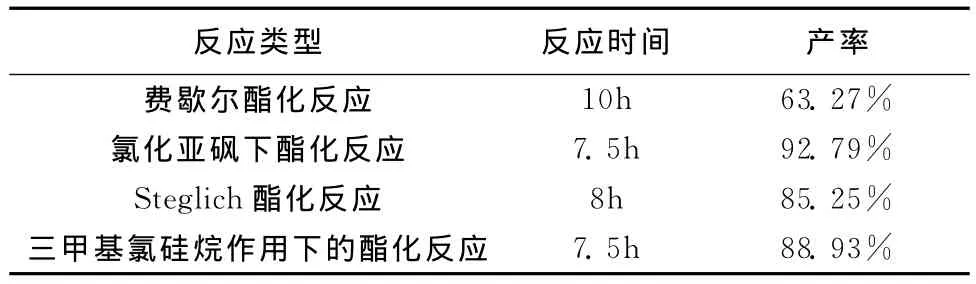
表5 酯化反应类型对反应的影响
根据表5分析对比,费歇尔酯化反应很缓慢,加热条件很难控制;Steglich酯化反应,反应试剂昂贵,反应液分离处理较麻烦;三甲基氯硅烷作用下的酯化反应,操作简单,但反应温度不好把握;氯化亚砜作用下的酯化反应,条件温和,操作方便,反应时间短,产率较高。综合对比后,本实验选用氯化亚砜酯化方法进行第六步的反应。
第⑥步的实验分析:此反应是一个酯化反应,采用二氯亚砜先将羧酸转化为酰氯的方法,大大提高了反应中羰基碳原子的活性,再与乙醇反应得到相应的酯,而且采用反应物乙醇作为溶剂,可以使得反应比较完全,收率比较理想,取得较好效果。反应中要用二氯亚砜,二氯亚砜有很强的刺激性,反应较剧烈,所以应控制滴加速度并保持在0℃以下。最终得到的产品不溶于乙酸乙酯,容易在乙酸乙酯中结晶出来。
2.7 4-哌啶乙酸乙酯的合成及处理过程分析
合成路线⑦这步反应是在弱碱条件下解去盐酸盐。该步需要在碱性环境中搅拌很长时间,才能将盐解掉,用二氯甲烷萃取产品多次才能萃净产品。由于解盐时间太长,而且解盐效率较低,最终导致产率不是很高,产率77.14%。
3 结束语
本实验以4-哌啶甲酸为原料,研究了4-哌啶乙酸乙酯的合成。整个实验过程无论是路线设计,试剂选取还是反应液处理,都是从工业化生产的角度,综合了实验成本、反应时间、反应设备、反应条件、安全生成等各方面的因素,使反应能在现有的条件下达到最好的收益,具有一定的经济效益和市场前景。每 步 反 应 的 产 率 依 次 为:99.43%,82.42%,78.59%,91.42%,67.39%,92.79%,77.14%。当然,实验中还存在若干问题如反应步骤多,反应液处理麻烦,总产率不高等,还有待我们继续研究。
[1]花文廷.杂环化学[M].北京:北京大学出版社,1990:1-5.
[2]T.艾歇尔,S.豪普特曼.杂环化学-结构、反应、合成与应用(李润涛,葛泽梅,王欣译)[M].北京:化学工业出版社,2005:310-312.
[3]梁诚.啶及其衍生物开发与应用[J].化工文摘,2004(3):30-31.
[4]李运波,唐凤翔,孟春,等.3-哌啶甲酸及其衍生物的合成与应用研究进展[J].有机化学,2009,29(7):1068.
[5]廖戎.N-叔丁氧羰基哌啶-3-乙酸的合成研究[J].西南民族大学学报,2012,38(4):587-591.
[6]廖戎.4-哌啶乙酸乙酯的合成研究(1)[J].四川化工,2013,16(3):11-13.
[7]周细根.哌啶类镇痛药构效关系的研究[J].井冈山医专学报,2002,9(6):28-29.
[8]于世钧,郭宏.LiAlH4和 NaBH4的还原反应[J].辽宁师范大学学报(自然科学版),2003.26(1):56-58.
[9]章月,蒋平平,董玉明,等.酯化反应催化剂研究进展[J].增塑剂,2011.22(2):20-23.
[10]杨晓章,蒋忠良,杜晓超.药物中间体4-羧酸乙酯哌啶的合成[J].精细与专用化学品,2007.15(8):18-19.

