骨髓间充质干细胞移植对急性肝功能衰竭大鼠肝组织miRNA-155和TNF-α表达的影响
郑盛 肖琼怡 殷芳 郭致平 刘汉屈 王建刚 朱为梅 王玉波
•论著•
骨髓间充质干细胞移植对急性肝功能衰竭大鼠肝组织miRNA-155和TNF-α表达的影响
郑盛 肖琼怡 殷芳 郭致平 刘汉屈 王建刚 朱为梅 王玉波
目的探讨骨髓间充质干细胞(BMSCs)移植对急性肝功能衰竭(ALF)大鼠肝组织中miRNA-155和TNF-α表达的影响,以及与BMSCs疗效间的关系。方法将SD大鼠随机分为健康对照组、ALF组、BMSCs治疗组和BMSCs预防组,其中ALF组予以900 mg/kgD-GalN + 10 μg/kg脂多糖腹腔注射建立模型;BMSCs治疗组在900 mg/kgD-GalN+10μg/kg脂多糖腹腔注射后2 h,予以尾静脉注射BMSCs 5.0×106;BMSCs预防组在900 mg/kgD-GalN + 10 μg/kg脂多糖腹腔注射前予以尾静脉注射BMSCs 5.0×106;健康对照组予以0.9﹪氯化钠溶液1 ml腹腔注射。给药7 h后每组处死大鼠,检测大鼠血清ALT和AST,ELISA法检测TNF-α水平,实时定量PCR检测肝组织miRNA-155、TNF-α mRNA。各组间肝功指标差异采用方差分析,同时观察每组大鼠的24 h生存率,并用卡方检验比较各组生存率的差异。结果D-GalN/脂多糖诱导7 h后,与ALF组相比,BMSCs预防和BMSCs治疗组大鼠ALT、AST、TNF-α水平均有所降低(P< 0.01);同时两组肝组织TNF-α mRNA和miRNA-155表达水平均有下调(P< 0.01);但两组间相比较差异无统计学意义。ALF组大鼠肝组织miRNA-155上调和TNF-α mRNA诱导呈正相关(r= 0.734,P= 0.001)。BMSCs预防组和BMSCs治疗组miRNA-155和TNF-α mRNA的部分逆转亦呈正相关(r值分别为0.687和0.590,P值分别为0.004和0.006)。给药后24 h,健康对照组、ALF组、BMSCs治疗组和BMSCs预防组大鼠死亡率组间比较差异有统计学意义(c2= 19.078,P< 0.01)。结论在BMSCs干预大鼠ALF发病过程中,可以部分逆转上调的肝组织miRNA-155和TNF-α,且存在协同性,提示BMSCs治疗ALF可能通过对肝组织miRNA-155和TNF-α的调控发生作用。
骨髓间充质干细胞;微小核糖核酸;肝功能衰竭,急性;大鼠
急性肝功能衰竭(acute liver failure,ALF)是因肝细胞大量坏死而出现的严重肝功能障碍,可短期内进展至肝性脑病,具有病程进展快、病死率高、预后差的特点,其治疗仍是世界性难题[1]。原位肝移植是最有效的治疗方法,但由于存在供体器官短缺和移植免疫排斥等问题,其临床应用明显受限。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是骨髓内的一种非造血干细胞,既有自我复制和高度增殖的能力,又有多向分化的潜能,具有来源广泛、低免疫原性等特点[2]。近年来临床运用BMSCs移植治疗终末期肝病取得了良好疗效,为临床解决了肝脏移植、肝细胞移植、生物人工肝等肝源短缺问题[3]。本研究通过建立大鼠ALF模型,初步探讨BMSCs移植对ALF大鼠肝组织中miRNA-155和TNF-α表达的影响,以及与BMSCs疗效间的关系。
材料与方法
一、实验动物
健康雄性SD大鼠100只,SPF级,体重130 ~180 g,由昆明医科大学实验动物中心提供,标准鼠食喂养,所有实验动物操作程序经过昆明医科大学动物管理和使用委员会批准。
二、主要试剂
改良Eagle培养基(EMEM)-LG培养液、特级FBS、胰蛋白酶(美国HyClone公司),D-GalN、脂多糖(美国Sigma公司),Trizol试剂(美国Invitrogen公司),反转录试剂盒(北京百泰克生物技术有限公司),引物由美国Invitrogen公司合成,大鼠TNF-α的ELISA试剂盒(美国BD公司)。
三、实验方法
1.BMSCs的分离、培养和鉴定:按参考文献[4]的方法进行BMSCs的分离和培养。取第3代BMSCs行流式细胞术鉴定,第4代BMSCs经胰蛋白酶消化、PBS冲洗,0.9﹪氯化钠溶液制成细胞悬液,密度为1.0 × 107/ml,实验备用。
2.模型的建立:采用随机数字表法将96只SPF级SD大鼠均分为4组,每组24只。参照文献[5]的实验方法,ALF组予以900 mg/kgD-GalN + 10 μg/kg脂多糖腹腔注射建立模型;BMSCs治疗组在900 mg/kgD-GalN + 10 μg/kg脂多糖腹腔注射后2 h,予以尾静脉注射BMSCs 5.0 × 106;BMSCs预防组在900 mg/kgD-GalN+10 μg/kg脂多糖腹腔注射前予以尾静脉注射BMSCs 5.0 ×106;健康对照组予以0.9﹪氯化钠溶液1 ml腹腔注射。在给药7 h后每组处死大鼠12只,留取大鼠血清和肝脏组织标本,其中血清标本-20℃保存,肝脏组织在液氮中预冷后转移至-70℃低温保存。余下每组12只大鼠观察24 h生存率。
3.大鼠血清ALT和AST检测:由全自动生化分析仪完成检测。
4.ELISA法检测大鼠血清TNF-α水平:在预包被的反应板中分别加入标准品和待测血清各100 μl,37℃温浴120 min;洗涤后加入兔抗大鼠TNF-α抗体,37℃温浴60 min;加羊抗兔IgGHRP标记抗体,37℃温浴120 min;加入底物,置37℃避光反应5 ~ 10 min;加入终止液终止反应,酶标仪在492 nm处测吸光度(A)值,绘制标准曲线,在标准曲线上读取各待测标本含量。
5.实时定量PCR检测大鼠肝组织TNF-α mRNA和miRNA-155的表达:具体方法参照文献[6]。TNF-α mRNA检测以β-肌动蛋白(β-actin)为内参照,miRNA-155的表达以U6为内参照。结果用2-△△Ct表示。
四、统计学处理
采用SPSS 17.0统计软件,计量资料以表示,组间均数有Two-Way ANOVA方差分析,生存分析采用R×C c2检验,相关性分析采用Pearson和Spearman相关分析。P< 0.05为差异有统计学意义。
结 果
一、BMSCs的形态学观察和鉴定
原代培养3 d后,镜下可见细胞呈单个或少量贴壁生长,多呈短梭形;7 ~ 10 d后,细胞不断扩大并融合成单层,多呈长梭形或多角形;传至第3、4代,镜下可见细胞形态和胞质透光性均良好,类似成纤维细胞,呈漩涡状生长。流式细胞术鉴定示第3代细胞表面表达CD90+CD45-的细胞占总细胞的比例> 95﹪,表明第3代细胞为BMSCs。
二、各组大鼠24 h存活情况比较
给药后24 h,健康对照组、ALF组、BMSCs治疗组和BMSCs预防组各死亡0/12、10/12、6/12和3/12只,组间比较差异有统计学意义(c2= 19.078,P< 0.01)。
三、BMSCs对各组大鼠血清ALT、AST、TNF-α的影响
D-GalN/脂多糖诱导7 h后,健康对照组、ALF组、BMSCs治疗组和BMSCs预防组大鼠血清ALT、AST、TNF-α组间比较差异均有统计学意义(均P< 0.01);BMSCs预防组和BMSCs治疗组血清ALT、AST、TNF-α水平均较ALF组降低,差异均有统计学意义(均P< 0.01),(表1)。
四、BMSCs对各组大鼠肝组织TNF-α mRNA、miRNA-155表达的影响
D-GalN/脂多糖诱导7 h后,健康对照组、ALF组、BMSCs治疗组和BMSCs预防组大鼠肝组织TNF-α mRNA、miRNA-155表达组间比较差异均有统计学意义(均P< 0.01);与ALF组相比,BMSCs预防组和BMSCs治疗组肝组织TNF-α mRNA、miRNA-155表达水平均有下调,差异均有统计学意义(均P< 0.01),(表2)。
五、大鼠miRNA-155和TNF-α表达水平的相关性
D-GalN/脂多糖诱导7 h后,ALF组大鼠肝组织miRNA-155上调和TNF-α mRNA诱导呈正相关(r= 0.734,P= 0.001)。BMSCs预防组和BMSCs治疗组miRNA-155和TNF-α mRNA的部分逆转亦呈正相关(r值分别为0.687和0.590,P值分别为0.004和0.006)。

表1 BMSC对各组大鼠血清ALT、AST、TNF-α的影响
讨 论
ALF时由于对内毒素灭活功能下降,存在内毒素血症,其重要成分脂多糖可被宿主TLR4识别并结合,引起炎性级联放大反应,通过多个信号转导途径,引起巨噬细胞分泌致炎细胞因子,从而导致炎性反应的发生[7],而过度的免疫炎性反应同时导致了大量肝细胞凋亡和坏死,最终导致肝功能衰竭的发生。
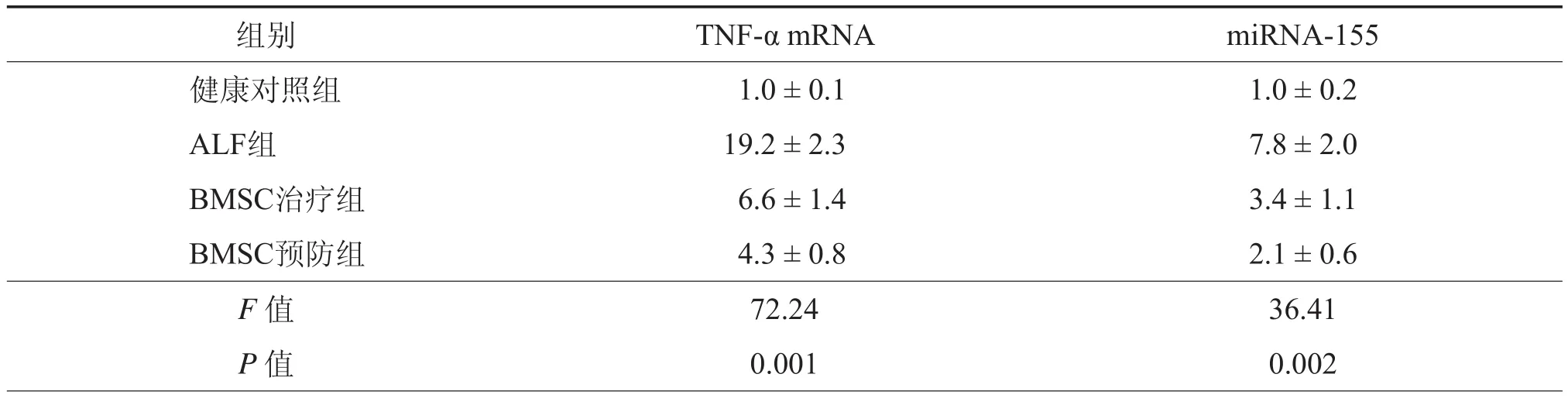
表2 BMSC对各组大鼠肝组织TNF-α mRNA、miRNA-155表达的影响
BMSCs是一种具有多向分化潜能的干细胞,研究证实,BMSCs不仅可分化成为成骨细胞、软骨细胞、脂肪细胞、心肌细胞等,且在肝脏微环境中BMSCs可分化为肝细胞和胆管细胞,参与肝细胞的修复和重构,从而达到改善肝功能的目的[8]。此外,BMSCs能体外抑制T淋巴细胞、B淋巴细胞、DC、NK细胞等活化和增殖,减少炎性细胞因子分泌[9]。Li等[10]用人骨髓来源MSC门静脉灌注D-GalN诱导的ALF小型猪,发现能显著延长生存时间,改善肝功能,肝组织免疫组织化学显示,移植后2 ~ 10周肝小叶和肝实质可见约30﹪人源MSC分化的肝细胞,且无明显免疫排斥反应,至15周人肝细胞显著减少,至20周仅散在分布,肝组织结构几乎恢复正常,与此同时血清人白蛋白出现相应的变化,移植后10周升至最高,后逐渐下降,提示BMSCs分化为肝细胞起重要作用,同时可能存在BMSCs的免疫抑制作用。
研究[11]证实,ALF小鼠肝组织miRNA表达谱出现明显变化,且随肝脏炎性反应的加重以及肝细胞损伤而加剧,尤其是与免疫炎性反应相关的miRNA-155和miRNA-146a表达上调明显。Baltimore等[12]发现miRNA具有组织特异性,miRNA-155主要表达于免疫细胞,与巨噬细胞、DC、NK细胞、T淋巴细胞和B淋巴细胞等细胞分化和功能相关。本研究选择检测D-GalN/脂多糖诱导7 h后大鼠肝组织miRNA-155和TNF-α mRNA,理由为:(1)D-GalN/脂多糖诱导的ALF病情进展快,前期的研究[13]提示,D-GalN/脂多糖诱导后5 h肝组织病理提示开始出现坏死,7 h比较典型,9 h后大片坏死,所以为了更准确检测,本研究标本选择时间在诱导7 h;(2)BMSCs静脉注入ALF大鼠,达到治疗效果需要一段时间,尤其是BMSCs治疗组,BMSCs是在D-GalN/脂多糖诱导后2 h静脉输入,为更好地观察疗效,标本选择时间最好在诱导2 h后更长时间。
本研究结果提示,BMSCs干预能部分逆转ALF大鼠肝组织miRNA-155。可能原因为:(1)miRNA-155为免疫细胞相关性miRNA,肝细胞内丰度极低,BMSCs可通过减少肝组织免疫细胞(库普弗细胞、CD8+T淋巴细胞和NK细胞等)浸润来下调肝组织miRNA-155;(2)BMSCs可直接通过抑制免疫细胞活化和下调免疫细胞miRNA-155来下调肝组织miRNA-155。进一步相关分析显示,ALF大鼠肝组织miRNA-155上调和TNF-α mRNA诱导呈正相关,且BMSCs干预后,miRNA-155和TNF-α mRNA的部分逆转也呈正相关。Tili等[14]研究显示,脂多糖体外刺激鼠264.7巨噬细胞TNF-α上调的同时,导致miRNA-155表达上调。单独予以TNF-α刺激巨噬细胞,可以依赖细胞核因子-ΚB的方式瞬时导致miRNA-155表达上调,机制可能与核因子-ΚB有关。Rodriguez等[15]和Thai等[16]用脂多糖刺激miRNA-155基因敲除小鼠B淋巴细胞,发现TNF-α表达下降,且这种影响主要发生在转录水平,说明miRNA-155能以增加TNF-α mRNA稳定性方式促进TNF-α表达。本研究结果显示,ALF大鼠肝组织miRNA-155和TNF-α相互促进,可能参与ALF发病机制,经过BMSCs的预处理或同时处理,可以降低ALF时升高的肝组织miRNA-155和TNF-α,可能是BMSCs治疗ALF有效的机制之一,但其确切的机制仍有待于进一步深入研究。
1 Kim TY,Kim DJ.Acute-on-chronic liver failure[J].Clin Mol Hepatol,2013,19(4):349-359.
2 Cook D,Genever P.Regulation of mesenchymal stem cell differentiation[J].Adv Exp Med Biol,2013,786(12):213-229.
3 Li M,Ikehara S.Bone-marrow-derived mesenchymal stem cells for organ repair [J].Stem Cells Int,2013,2013:132642.
4 Nemeth K,Leelahavanichkul A,Yuen PS,et al.Bone marrow stromal cells attenuate sepsis via prostaglandin E (2)-dependent reprogramming of host macrophages to increase their interleukin-10 production[J].Nat Med,2009,15(1):42-49.
5 Wang K,Zhang S,Marzolf B,et al.Cirulating microRNAs,potential biomarkers for drug-induced liver injury[J].Proc Natl Acad Sci USA,2009,106(11):4402-4407.
6 Beggs KM,Fullerton AM,Miyakawa K,et al.Molecular mechanisms of hepatocellular apoptosis induced by trovafloxacin-tumor necrosis factor-alpha interaction[J].Toxicol Sci,2014,137(1):91-101.
7 Shah N,Montes de Oca M,Jover-Cobos M,et al.Role of toll-like receptor 4 in mediating multiorgan dysfunction in mice with acetaminophen induced acute liver failure[J].Liver Transpl,2013,19(7):751-761.
8 郑盛,杨晋辉,尤丽英.间充质干细胞分化为功能性肝细胞的研究进展[J].中华肝胆外科杂志,2013,19(5):396-400.
9 Goldmacher GV,Nasser R,Lee DY,et al.Tracking transplanted bone marrow stem cells and their effects in the rat MCAO stroke model[J].PLoS One,2013,8(3):60049.
10 Li J,Zhang L,Xin J,et al.Immediate intraportal transplantation of human bone marrow mesenchymal stem cells prevents death from fulminant hepatic failure in pigs [J].Hepatology,2012,56(3):1044-1052.
11 Pok S,Wen V,Shackel N,et al.Cyclin E facilitates dysplastic hepatocytes to bypass G1/S checkpoint in hepatocarcinogenesis[J].J Gastroenterol Hepatol,2013,28(9):1545-1554.
12 Baltimore D,Boldin MP,O’Connell RM,et al.MicroRNAs: new regulators of immune cell development and function[J].Nat Immunol,2008,9(8):839-845.
13 Xu Y,Wang H,Bao S,et al.Amelioration of liver injury by continuously targeted intervention against TNF-ΑRp55 in rats with acute-on-chronic liver failure[J].PLoS One,2013,8(7):68757.
14 Tili E,Michaille JJ,Cimino A,et al.Modulation of miR-155 and miR-125b levels following lipopolysaccharide/TNF-Α-alpha stimulation and their possible roles in regulating the response to endotoxin shock[J].J Immunol,2007,179(8):5082-5089.
15 Rodriguez A,Vigorito E,Clare S,et al.Requirement of bic/ microRNA-155 for normal immune function[J].Science,2007,316(5824):608-611.
16 Thai TH,Calado DP,Casola S,et al.Regulation of the germinal center response by microRNA-155[J].Science,2007,316(5824):604-608.
Effects of bone marrow mesechymal stem cells on microRNA-155 and tumor necrosis factor alpha expression in liver tissue of rats with acute liver failure
Zheng Sheng,Xiao Qiongyi,Yin Fang,Guo Zhiping,Liu Hanqu,Wang Jiangang,Zhu Weimei,Wang Yubo.Department of Liver Diseases,Yunnan The third People’s Hospital,Kunming 650011,China
Zheng Sheng,Email: zheng_sheng523@163.com
ObjectiveTo explore the effects of bone mesenchymal stem cells (BMSCs) on the microRNA-155 (miRNA-155) and tumor necrosis factor alpha (TNF-α) expression in liver tissue of rats with acute liver failure (ALF),and to explore the relationship between miRNA-155/TNF-α and the efficacy of BMSCs.MethodsSD rats were randomly divided into four groups,including control group,ALF group,BMSC treatment group and BMSC pretreatment group.Rats in each group were sacrificed 7 h after intraperitonealD-GalN/ LPS administration.Liver function,serum TNF-α level,miRNA-155 and TNF-α mRNA ofliver tissue were detected subsequently.Survival rate at 24 h was observed in each group.Results Seven hours afterD-GalN/LPS induction,alanine aminotransferase and aspartate aminotransferase levels of BMSC treatment and BMSC pretreatment groups were significantly lower when compared with those of ALF group(allP< 0.01).Compared with ALF group,serum levels of TNF-α decreased in BMSC treatment and BMSC pretreatment groups and the difference was statistically significant (allP< 0.01).The difference of the TNF-α mRNA expression in liver tissue between groups was statistically significant (F= 72.24,P< 0.01).The TNF-α mRNA and miRNA-155 expression of BMSC treatment and BMSC pretreatment groups were down-regulated in comparison with ALF group,which showed statistical difference (allP< 0.01).The positive correlation between miRNA-155 and TNF-α mRNA in liver tissue was confirmed in ALF group (r= 0.734,P= 0.001),BMSC treatment (r= 0.590,P= 0.006) and BMSCs pretreatment (r= 0.687,P= 0.004).24 h afterD-GalN/LPS administration,the difference of mortalities between groups was statistically significant (χ2=19.078,P< 0.01).ConclusionWith BMSC intervention in ALF,up-regulated miRNA-155 and TNF-α expressions in liver tissue could be partially reversed by BMSCs,suggesting that BMSC alleciate ALF via regulating miRNA-155 and TNF-α.
Bone mesenchymal stem cells;MicroRNAs;Liver failure,acute;Rat
2014-03-04)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2014.02.001
云南省自然科学基金(2012FD095)
650011 昆明,云南省第三人民医院肝病中心
郑盛,Email:zheng_sheng523@163.com
郑盛,肖琼怡,殷芳,等.骨髓间充质干细胞移植对急性肝功能衰竭大鼠肝组织微小核糖核酸-155和肿瘤坏死因子-α表达的影响[J/CD].中华细胞与干细胞杂志:电子版,2014,4(2):79-83.

