间充质干细胞与肿瘤转移
李改兰,阎新龙,高娇,史高娜 ,范祖森
1.解放军第264医院 中医科,山西 太原 030012;2.中国科学院 生物物理研究所感染与免疫研究中心,北京100101;3.解放军第306医院 检验科,北京 100101;4.军事医学科学院 野战输血研究所干细胞与再生医学研究室,北京 100850
肿瘤组织中除了占主体地位的肿瘤上皮细胞外,还包括组成肿瘤微环境的多种基质细胞,如间充质干细胞(mesenchymal stem cells或multipotent mesenchymal stromal cells,MSC)、内皮细胞、成纤维细胞、肌成纤维细胞、炎症细胞、脂肪细胞和巨噬细胞等,及其分泌的活性因子如生长因子、炎症因子和胞外基质等[1]。其中,MSC是一类能够自我更新、具有多向分化潜能的成体干细胞,在特定诱导条件下能够分化为成骨细胞、软骨细胞和脂肪细胞等[2]。MSC具有造血支持、免疫调节及特异迁移到损伤组织、慢性炎症及肿瘤部位的能力,这些特性使得MSC在组织工程和再生医学方面有广泛的应用,作为载体在细胞治疗及基因治疗方面也有着广阔的前景。但同时MSC也有着不祥的黑暗一面(ominous dark side),有证据认为MSC是肿瘤相关成纤维细胞(can⁃cer associated fibroblasts,CAF)的祖先,MSC分化产生的上述终末分化细胞及分化过程中的前体细胞可构成肿瘤基质的重要组分,同时MSC还可分泌多种活性因子参与调控肿瘤细胞增殖、转移及耐药等[3]。但迄今对MSC在肿瘤转移中的作用仍知之甚少,到底MSC是促进还是抑制肿瘤,与MSC的来源及特性、肿瘤细胞特性,以及输注的MSC与肿瘤细胞的比例和肿瘤转移所采取的模型有关。在本综述中,我们将主要探讨MSC参与肿瘤转移的研究进展。
1 MSC促进肿瘤转移的研究
1.1 成体骨髓来源的MSC促进肿瘤转移的研究
Karnoub等于2007年首次证明骨髓来源的MSC能够促进乳腺癌细胞转移,MSC与乳腺癌细胞按一定比例混合后共移植入裸鼠皮下,发现MSC能显著促进乳腺癌细胞的体内转移能力;进一步的机制探讨发现,乳腺癌细胞能促进骨髓MSC从头(de novo)分泌趋化因子CCL5(也称作RANTES),进而CCL5通过旁分泌作用促进肿瘤细胞的运动性、侵袭能力及体内的转移能力,并且发现MSC微环境对肿瘤转移的促进作用是可逆的[4]。Albarenque等发现小鼠骨髓MSC与人源MSC具有相似特性,经静脉注射后小鼠MSC在组织内的分布与人源MSC几乎相同。并且发现尾静脉注射MSC后能增强小鼠脂肪垫荷瘤转移模型中的肿瘤转移能力,大约一半的MSC注射组的裸鼠具有转移结节,而对照组只有17%的比例[5]。Chaturvedi等发现低氧诱导因子(HIF)介导了乳腺癌细胞和MSC之间的旁分泌信号通路而促进转移。在小鼠脂肪垫原位肿瘤模型中,MSC能够被招募到肿瘤原发灶,进而以HIF依赖的方式促进肿瘤转移到淋巴结和肺部。MSC与乳腺癌细胞共培养时能够增强肿瘤细胞的HIF活性,另外,低氧还可以增强共培养体系中MSC分泌的CXCL10及乳腺癌中CXCR3的表达。有趣的是,当共培养体系中加入CXCL10的中和抗体时,乳腺癌细胞中的CXCR3的表达缺失;相反在共培养体系中,当敲低乳腺癌细胞中CXCR3或HIF的表达时,MSC不能表达CXCL10,因此HIF介导了复杂的双向的乳腺癌和MSC之间的旁分泌作用,进而调控乳腺癌细胞转移[6]。美国杜克大学王小凡教授领导的团队在动物模型中发现miR-126/miR-126*能抑制乳腺癌的转移,其下游机制可能主要是通过抑制招募肿瘤微环境中的MSC和单核细胞而实现的。miR-126/miR-126*能直接抑制SDF-1a的表达,进而间接抑制肿瘤细胞中CCL2的表达,上述研究展示了miRNA如何参与肿瘤微环境的改变从而使其能更有利于肿瘤的转移[7]。Lis等将MSC与GFP标记的卵巢癌细胞系按2∶1的比例共培养,24 h后用细胞流式仪将肿瘤细胞重新分选出来,未经共培养的肿瘤细胞作为对照。与MSC共培养后,经基因转录高通量分析和生物学功能比较,发现卵巢癌细胞转移能力增强,而与转移相关的基因表达上调[8]。Shinagawa等考察了MSC与结肠癌的相互作用,发现MSC静脉注射后,能迁移到结肠癌原位肿瘤灶和转移灶。把MSC与肿瘤细胞共移植入脾脏内,发现MSC能显著促进结肠癌的肝转移[9]。El-Haibi等[10]发现骨髓来源的MSC能诱导乳腺癌细胞分泌赖氨酸氧化酶(LOX),而LOX足够增强转移能力弱的肿瘤细胞的侵袭能力,使其能够转移到肺和骨部位。并且发现LOX是CD44-Twist信号轴上的重要组成部分,细胞外的透明质酸促使CD44迁移入核,与LOX的启动子部位结合,启动LOX的表达,随后促进Twist表达,引发肿瘤细胞上皮-间质转化(EMT)。Jung等发现人和小鼠来源的前列腺癌细胞能分泌CXCL16,而MSC表达CXCL16的受体CX⁃CR6,一旦肿瘤细胞分泌的CXCL16结合到MSC的受体CXCR6上,将促进MSC分化成为肿瘤细胞激活的成纤维细胞,进而分泌大量SDF-1a,从而诱导肿瘤细胞发生EMT,促进肿瘤细胞侵润其他器官[11]。
1.2 肝癌组织微环境中的MSC促进肝癌细胞体内转移
Yan等发现肝癌组织中存在被肿瘤细胞激活的MSC,能够促进肝癌细胞增殖和转移,进一步的机制研究表明肝癌相关MSC高表达S100A4,后者能促进肝癌侵袭和转移,下游机制可能是通过上调肿瘤细胞中miR-155和MMP9的表达而促进转移[12]。Jing等发现在炎症条件下MSC能够促进肝癌细胞转移,并且MSC促转移的效应能够被IFN-γ和TNF-α预处理的MSC条件培养基模拟,并且上述条件培养基处理肿瘤细胞后,能够促进肿瘤细胞发生EMT[13]。
2 MSC抑制肿瘤转移的研究进展
Ganta等利用大鼠脂肪上皮腺癌细胞系MatBⅢ异位移植到同品系的Fisher344大鼠乳腺脂肪垫下构建荷瘤模型,4 d后将大鼠脐带组织MSC经肿瘤内注射或静脉注射,14 d后发现脐带MSC移植组具有明显的肿瘤抑制效应,34~38 d时脐带MSC能完全抑制肿瘤生长,100 d后也无转移和复发倾向[14]。Sun等利用MDA-MB-231注射裸鼠乳腺脂肪垫构建肿瘤转移模型,22 d后将1×106脐带血MSC和脂肪组织来源的MSC经尾静脉注入小鼠体内,结果显示上述输注MSC后减少乳腺癌肺转移结节,并且通过诱导肿瘤细胞凋亡来抑制肿瘤增殖[15]。
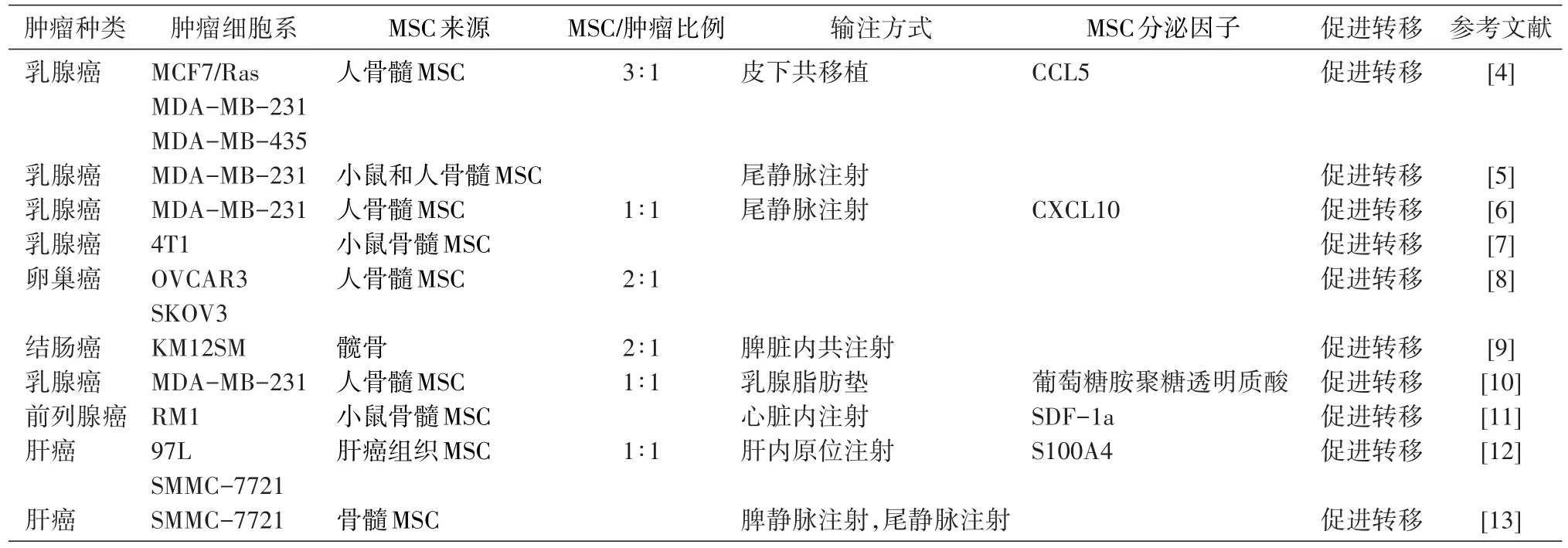
表1 间充质干细胞促进肿瘤转移

表2 间充质干细胞抑制肿瘤转移
Ren等将黑色素瘤B16F10细胞经尾静脉注射构建小鼠肺转移模型,10 d后分别按未处理组、小鼠骨髓MSC组和MSC转染IFN-α组经尾静脉注射入小鼠体内,发现单纯MSC组与未处理组对黑色素瘤细胞的转移能力差异不大,而MSC转染IFN-α组显著抑制肿瘤细胞转移能力[16]。Waterman等将用TLR4预处理的MSC称作MSC1,其能够分泌促炎症的介质,体内MSC1能抑制肿瘤生长和转移;将用TLR3预处理的MSC称作MSC2,能够分泌免疫抑制的活性因子,进而能够促进肿瘤转移[17-18]。
3 结语
深入理解MSC与肿瘤转移的关系,将为探讨肿瘤微环境与肿瘤的复杂关系提供简单可行的模型,在该模型中,MSC本身特性的改变(组织来源、供者年龄、MSC本身传代次数及状态、基因改变等)、肿瘤细胞的特性、肿瘤模型的构建(皮下注射、尾静脉注射、肿瘤异位移植等)、肿瘤细胞与MSC的比例都与最后的结果密切相关。因此,深入理解MSC与肿瘤关系的分子机制,将有可能利用MSC作为治疗肿瘤的药物载体,以及为阻断肿瘤微环境对肿瘤的促进作用提供新的靶点。
[1] Littlepage L E,Egeblad M,Werb Z.Coevolution of cancer and stromal cellular responses[J].Cancer Cell,2005,7(6):499-500.
[2] Pittenger M F,Mackay A M,Beck S C,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[3] Kidd S,Spaeth E,Klopp A,et al.The(in)auspicious role of mesenchymal stromal cells in cancer:be it friend or foe[J].Cytotherapy,2008,10(7):657-667.
[4] Karnoub A E,Dash A B,Vo A P,et al.Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J].Nature,2007,449(7162):557-563.
[5] Albarenque S M,Zwacka R M,Mohr A.Both human and mouse mesenchymal stem cells promote breast cancer metasta⁃sis[J].Stem Cell Res,2011,7(2):163-171.
[6] Chaturvedi P,Gilkes D M,Wong C C,et al.Hypoxia-induc⁃ible factor-dependent breast cancer-mesenchymal stem cell bi⁃directionalsignaling promotes metastasis[J].J Clin Invest,2013,123(1):189-205.
[7] Zhang Y,Yang P,Sun T,et al.miR-126 and miR-126*re⁃press recruitment of mesenchymal stem cells and inflammato⁃ry monocytes to inhibit breast cancer metastasis[J].Nat Cell Biol,2013,15(3):284-294.
[8] Lis R,Touboul C,Raynaud C M,et al.Mesenchymal cell in⁃teraction with ovarian cancer cells triggers pro-metastatic prop⁃erties[J].PLoS One,2012,7(5):e38340.
[9] Shinagawa K,Kitadai Y,Tanaka M,et al.Mesenchymal stem cells enhance growth and metastasis of colon cancer[J].Int J Cancer,2010,127(10):2323-2333.
[10]El-Haibi C P,Bell G W,Zhang J,et al.Critical role for ly⁃syl oxidase in mesenchymal stem cell-driven breast cancer malignancy[J].Proc Natl Acad Sci USA,2012,109(43):17460-17465.
[11]Jung Y,Kim J K,Shiozawa Y,et al.Recruitment of mesen⁃chymal stem cells into prostate tumours promotes metastasis[J].Nat Commun,2013,4:1795.
[12]Yan X L,Jia Y L,Chen L,et al.Hepatocellular carcinomaassociated mesenchymalstem cellspromote hepatocarcinoma progression:Role of the S100A4-miR155-SOCS1-MMP9 axis[J].Hepatology,2013,57(6):2274-2286.
[13]Jing Y,Han Z,Liu Y,et al.Mesenchymal stem cells in in⁃flammation microenvironment accelerates hepatocellular carcino⁃ma metastasis by inducing epithelial-mesenchymal transition[J].PLoS One,2012,7(8):e43272.
[14]Ganta C,Chiyo D,Ayuzawa R,et al.Rat umbilical cord stem cells completely abolish rat mammary carcinomas with no evidence of metastasis or recurrence 100 days post-tumor cell inoculation[J].Cancer Res 2009,69(5):1815-1820.
[15]Sun B,Roh K H,Park J R,et al.Therapeutic potential of mesenchymal stromal cells in a mouse breast cancer metasta⁃sis model[J].Cytotherapy 2009,11(3):289-298.
[16]Ren C,Kumar S,Chanda D,et al.Therapeutic potential of mesenchymalstem cells producing interferon-alpha in a mouse melanoma lung metastasis model[J].Stem Cells,2008,26(9):2332-2338.
[17]Waterman R S,Tomchuck S L,Henkle S L,et al.A new mesenchymal stem cell(MSC)paradigm:polarization into a pro-inflammatory MSC1 or an Immunosuppressive MSC2 phe⁃notype[J].PLoS One,2010,5(4):e10088.
[18]Waterman R S,Henkle S L,Betancourt A M.Mesenchymal stem cell1(MSC1)-based therapy attenuates tumorgrowth whereas MSC2-treatment promotes tumor growth and metastasis[J].PLoS One,2012,7(9):e45590.

