高灵敏的蛋白质免疫印迹新方法用于β-淀粉样蛋白检测
冯爱平,扎拉嘎胡,李威,刘英富
1.四川省德阳市第二人民医院 神经外科,四川 德阳 61800;2.武警后勤学院 细胞生物学与医学遗传学教研室,天津300162
蛋白质免疫印迹法(Western印迹)是根据抗原或抗体的固相化及抗原或抗体的酶标记对受检物质进行检测的一种有效方法[1],结合了凝胶分辨力高和固相免疫测定的特异敏感等多种优点。与免疫沉淀法比较,这种方法无须对靶蛋白进行同位素标记。该方法检测能力强,对检测样本的要求低,可避免溶解、聚集及靶蛋白与外来蛋白共沉淀等诸多问题[2]。
该方法的优点是:可以从混杂抗原中检测出特定抗原;可以从多克隆抗体中检测出单克隆抗体;可以对转移到固相膜上的蛋白质进行连续分析;蛋白质反应具有均一性;固相膜保存时间长;显色灵敏等。其不足之处:干扰因素较多;易造成结果失真;通过条带的有无和灰度深浅来对阳性结果做出判断有时会带来误差;实验操作过程中须消耗大量昂贵抗体等。这些因素大大限制了其应用[3]。
鉴于目前Western印迹存在的局限性,我们在抗体上引入了纳米金粒子(Au nanoparticles,AuNP)和氧化石墨烯(graphene oxide,GO)。这2种材料都具有制备过程简单、比表面积大、易与蛋白质结合、能保持抗体生物活性等优点,在生物学方法中得到了广泛应用。我们将抗体与AuNP和GO结合后,引入传统的Western印迹方法中,逐级放大检测信号,以降低Western印迹的检测限,扩大该方法的适用范围和领域[4-9]。
1 材料与方法
1.1 材料
含β-淀粉样蛋白(amyloid β-protein,Aβ)的血清来自北京肿瘤医院;Aβ一抗(Aβ-Ab1)、辣根过氧化物酶标记的二抗(Ab2-HRP)购自Abcam公司;牛血清白蛋白(BSA)、1-乙基-3-(3-二甲基氨)-碳二亚胺盐酸盐(EDC)、2-(N-吗啉)乙磺酸(MES)、N-羟基琥珀酰亚胺(NHS)购自Sigma-Aldrich公司;石墨烯购自Alfa Aesar公司;氯金酸(HAuCl4·4H2O)购自南京市威圣化工贸易有限公司;柠檬酸钠购自上海 创 顺 化 工 有 限 公 司 ;KH2PO4、Na2HPO4、KCl、Tween-20购自北京化学试剂公司;实验用水为双蒸水。
Milli-Q型纯水仪(≥18 MΩ,Millipore公司);Tecnai G2 20型透射电镜(FEI香港有限公司);85-2数显型恒温搅拌器(国瑞试验仪器厂);SORVSLL型LEGEND MICRO 17离心机(Therno公司)。
1.2 AuNP与AuNP-Aβ-Ab1的制备
首先将l mL 1%的氯金酸溶液加入100 mL双蒸水中,加热至沸腾,然后迅速加入2.5 mL 1%的柠檬酸钠溶液,充分搅拌,保持沸腾15 min。这期间溶液颜色依次由灰变蓝再变紫,最后为酒红色。移去热源,自然冷却至室温,即制得平均粒径为16 nm的AuNP颗粒,4℃下保存备用。
将0.3 mg Aβ-Ab1加入pH6.0的AuNP溶液中,室温下搅拌2 h,然后加入2 mL 1%的BSA,室温封闭30 min,13 300 r/min离心10 min,溶液分成上下2层,上层为未结合的抗体,下层为黑色、松软的结合物。除去上清,用含1%BSA的PBS缓冲液将产物(AuNP-Aβ-Ab1)洗涤并离心3次,最后溶于PBS中,置4℃备用,该产物能在1个月内保持活性[10]。
1.3 GO和GO-Ab2-HRP的制备
石墨烯(又称单层石墨或二维石墨)是单原子厚度的二维碳原子晶体,被认为是富勒烯、碳纳米管和石墨的基本结构单元。石墨烯因具有大的比表面积、突出的导热性能和力学性能,及非凡的电子传递性能等一系列优异性质,被业内人士广泛关注[11]。制备氧化石墨烯的方法很多,而将石墨氧化变成氧化石墨,再在超声条件下容易得到单层的氧化石墨烯溶液,已成为氧化石墨烯制备的有效途径。
将0.5 g石墨粉末和0.5 g硝酸钠加入23 mL预冷的浓硫酸中,搅拌反应10 min,然后缓慢加入4 g高锰酸钾,35℃反应1 h,再向反应体系中缓慢加入40 mL蒸馏水,95℃反应1 h,加入100 mL蒸馏水终止反应,然后加入2 mL 30%的H2O2,室温反应2 h,将产物离心,并用1 L的HCl(5%)洗涤,随后用4 L蒸馏水洗涤,离心并再次洗涤。将得到的产物于40℃真空干燥48 h,即为GO粉末,置4℃备用[12]。
将50 mg NaOH和ClCH2COONa加入1 mL 1 mg/mL的GO中,超声波裂解1.5 h,将产物GOCOOH用双蒸水洗涤3次,除去过量的碱,然后将400 mmol/L EDC和200 mmol/L NHS一起加入1 mL pH6.0的MES缓冲液中,反应30 min,将混合物于13 300 r/min离心5 min,除去上清,此过程重复3次。将得到的GO-Ab2-HRP溶于含1%BSA的1.0 mL pH7.4 的PBS中,置4℃备用[13-14]。
2 结果与讨论
2.1 纳米载体与抗体结合体的制备
图1A为AuNP的透射电镜图,可以看出AuNP为黑色球状物,粒径为16 nm。图1B为AuNP-Aβ-Ab1的透射电镜图,中间黑色球状物为纳米金,而包裹着纳米金的絮状物为Aβ-Ab1。为了得到分散均匀、大小匀称的纳米金颗粒,首先应将所用器皿依次用王水(浓HCl∶浓HNO3=3∶1)和双蒸水冲洗,烘干待用。此步骤需要绝对清洁的器皿,任何杂质都会让形成的纳米金颗粒团聚。
图2A为GO的透射电镜图,图2B为GO-Ab2-HRP的透射电镜图,上面的黑色斑点为结合在GO片上的抗体。为保证氧化石墨烯与二抗的结合率,又不破坏抗体的活性,在由石墨制备得到氧化石墨烯后,要用去离子水透析GO-COOH悬浮液48 h以上,以除去所有离子,因为杂质粒子的存在对氧化石墨烯与抗体的结合会产生非常不利的影响。另外,加入的EDC要过量,因为EDC遇水迅速发生水解,量太少则不能发挥缩合的作用。
2.2 改进后的Western印迹方法评价

图1 AuNP(A)和AuNP-Aβ-Ab1(B)的透射电镜图

图2 GO(A)和GO-Ab2-HRP(B)的透射电镜图
将抗体功能化的纳米金和氧化石墨烯进行Western印迹,本研究所用样品为Aβ。Aβ是阿尔茨海默病(AD)中病理改变的主要成分,其毒性作用亦可诱导神经细胞凋亡。该蛋白在脑损伤后的表达,与伤情、伤后认知功能障碍、AD及中枢神经病理生理变化密切相关,研究其在脑外伤后脑组织中的表达情况可以判断伤情、评估预后,对脑外伤的治疗有重要意义[15]。现在普遍认为Aβ的聚集在AD发生、发展过程中起核心作用,Aβ导致神经细胞功能紊乱和死亡,最终引起痴呆[16]。
改进后Western印迹检测Aβ的具体步骤如下。
2.2.1 样品准备及电泳 将血清按照一定比例稀释,同时制备2块电泳凝胶,进行SDS-PAGE。
2.2.2 转膜 ①电泳结束后将胶条切至合适大小,用转膜缓冲液平衡5 min,共3次;②膜处理:预先裁好与胶条同样大小的滤纸和PVDF膜,浸入转膜缓冲液中10 min;③转膜:转膜装置从下至上依次按阳极、滤纸、PVDF膜、凝胶、滤纸、阴极的顺序放好,滤纸、凝胶、PVDF膜精确对齐,每一步都要做去除气泡处理,接通电源,转移1.5 h,结束后断开电源将膜取出。
2.2.3 免疫反应 ①用0.01 mol/L PBS洗膜5 min,共3次;②加入包被液,室温下平稳摇动2 h;③弃包被液,用0.01 mol/L PBS洗膜5 min,共3次;④其中一块膜加入常规一抗,另一块加入功能化修饰过的一抗,用BSA封闭,37℃放置2 h以上;⑤弃一抗和1%BSA,用0.01 mol/L PBS洗膜3 min,共3次;⑥在步骤④中加入常规一抗的膜在本步骤中加入Ab2-HRP,加入纳米金功能化修饰的一抗的膜在本步骤中加入GO-Ab2-HRP,37℃平稳摇动1 h;⑦弃二抗,用0.01 mol/L PBS洗膜5 min,共4次;⑧加入显色液,避光显色至出现条带时放入双蒸水中终止反应(图3)。
传统Western印迹方法中,每一个抗原蛋白只能结合一个对应一抗,而每个一抗也只能结合一个二抗;而在改进后的方法中,通过纳米金载体与多个一抗结合,每个抗原蛋白能够结合多个一抗;通过氧化石墨烯与二抗结合,每个一抗能连接多个酶标记二抗,通过2次串联放大作用,能将较低的检测信号逐级放大,提高了检测的灵敏度。
为了考察改进后方法的性能,用与纳米金颗粒结合的一抗和与氧化石墨烯结合的二抗对Aβ进行检测,结果见图4。改进方法比传统方法多出3条带,可检测到浓度为16 pg/mL的样品,检测限降低为传统方法的1/27。重复实验结果表明,改进后的方法性能稳定,重复性好,可用于对样本中低浓度蛋白质进行灵敏检测。
2.3 结论
将纳米金和氧化石墨烯引入Western印迹中,提高了一抗与抗原、二抗与一抗的结合比例,可对检测信号逐级放大,提高了方法的灵敏度,拓展了该检测方法的应用领域。且改进后的方法重复性好,操作简便,将会在蛋白质检测和诊断学研究中发挥其应有的作用。
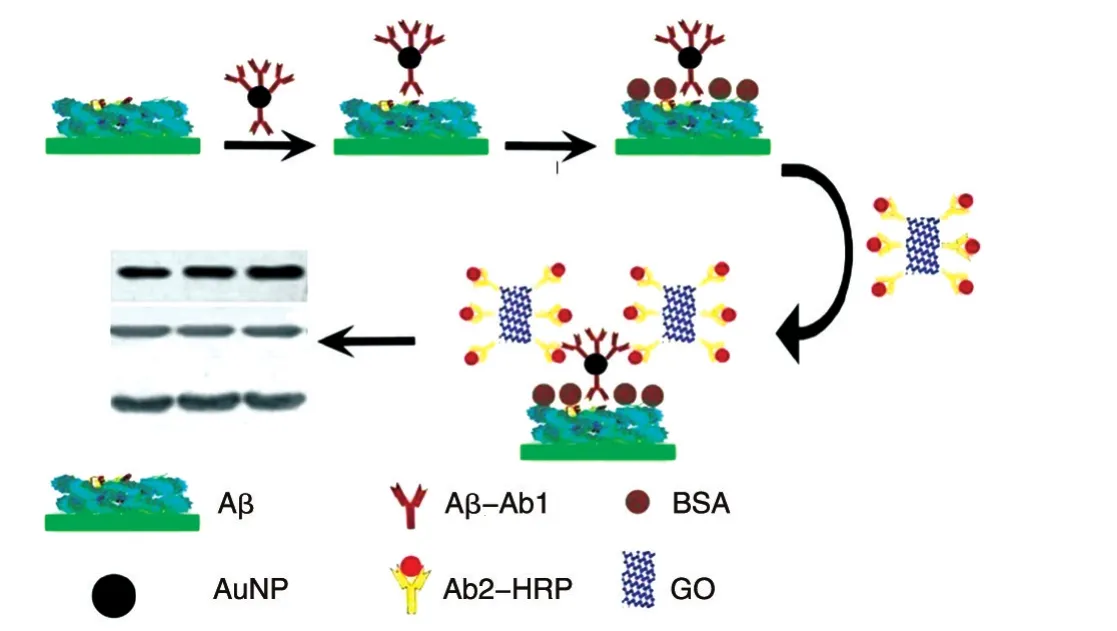
图3 改进的Western印迹操作流程示意图

图4 改进前(A)、后(B)的Western印迹方法对Aβ的检测结果1~7:样品浓度依次为11 664、3888、1296、432、144、48和16 pg/mL
[1] Nachamkin I,Hart A M.Western blot analysis of the human antibody response to Campylobacterjejunicellularantigens during gastrointestinal infection[J].J Clin Microbiol,1985,21,33-38.
[2] McPhee D J.Methodological considerations for improving Western blot analysis[J].J Pharmacol Toxicol Methods,2010,61:171-177.
[3] Boonrod K,Roth B,Ngar S L,et al.Analysis of the effective⁃ness of reused primary and secondary antibodies in Western blotting analysis[J].Anal Biochem,2010,397:124-125.
[4] Cui R J,Liu C,Shen J M,et al.Gold nanoparticle-colloidal carbon nanosphere hybrid materialpreparation,characteriza⁃tion,and application for an amplified electrochemical immuno⁃assay[J].Adv Funct Mater,2008,18:2197-2204.
[5] Sai B,Yan Y M,Yang X Y,et al.Gold nanolabels for new enhanced chemiluminescenceimmunoassayofalpha-fetopro⁃tein based on magnetic beads[J].Chem Eur J,2009,15:4704-4709.
[6] Liu M Y,Jia C P,Huang Y Y,et al.Highly sensitive pro⁃tein detection using enzyme-labeled gold nanoparticle probes[J].Analyst,2010,135:327-331.
[7] Liu Z F,Jiang L H,Galli F,et al.A graphene oxide strepta⁃vidin complex for biorecognition-towards affinity purification[J].Adv Funct Mater,2010,20:2857-2865.
[8] Zhu Y W,Murali S,Cai W W,et al.Graphene and gra⁃phene oxide synthesis,properties,and applications[J].Adv Ma⁃ter,2010,22:3906-3924.
[9] Su B L,Tang J,Huang J X,et al.Graphene and nanogoldfunctionalized immunosensing interface with enhanced sensitivi⁃ty for one-step electrochemical immunoassay of alpha-fetopro⁃tein in human serum[J].Electroanalysis,2010,22:2720-2728.
[10]Zhu Y,Chandra P,Shim Y B.Ultrasensitive and selective electrochemical diagnosis of breast cancer based on a hydra⁃zine-Au nanoparticle-aptamerbioconjugate[J].AnalChem,2013,85:1058-1064.
[11]Shen J F,Hu Y Z,Shi M,et al.One step synthesis of gra⁃phene oxide-magnetic nanoparticle composite[J].J Phys Chem C,2010,114:1498-1503.
[12]ZHANG L M,XIA J G,ZHAO Q,et al.Functional graphene oxide as a nanocarrier for controlled loading and targeted de⁃livery of mixed anticancer drugs[J].Small,2010,6:537-544.
[13]Shen J F,Shi M,Yan B,et al.Covalent attaching protein to graphene oxide via diimide-activated amidation[J].Colloids Surfaces B Biointerfaces,2010,81:434-438.
[14]Xu H F,Dai H,Chen G N.Direct electrochemistry and elec⁃trocatalysis of hemoglobin protein entrapped in graphene and chitosan composite film[J].Talanta,2010,81:334-338.
[15]邬树凯,陈峻严,高宏志.β淀粉样前体蛋白、β淀粉样蛋白与颅脑损伤研究进展[J].国际外科学杂志,2011,38:59-62.
[16]袁力勇,戴体俊.β淀粉样蛋白的毒性机制研究进展[J].徐州医学院学报,2007,27:61-67.

