底泥啤酒酵母分离纯化与发酵性能测定
张 晶 岳媛媛
(1.三门峡职业技术学院 食品园林学院,河南 三门峡 472000;2.河南工业大学,郑州 450001)
引言
啤酒酵母泥是啤酒后发酵过程中逐渐沉淀出来的老化或凋亡了的啤酒酵母体,是啤酒工业的主要副产物之一[1]。三门峡职业技术学院食品园林学院现有生产型啤酒实训车间一个,配备有一套啤酒生产线,月啤酒生产量为1200L,由此所产生的啤酒酵母泥在40-80L左右,其中包含着大量啤酒酵母,可用于高活性啤酒酵母的选育。
啤酒酵母是啤酒生产中的重要原料菌,决定着啤酒的风味与质量[2],目前我院原浆啤酒生产所用啤酒酵母购自相关企业,生产成本高,且菌种特性不易掌控,因此,从底泥中选育活力强、发酵速度快、发酵力高的菌株有利于啤酒品质控制及新产品的开发,并可降低生产成本。
因此,本研究选取啤酒后发酵过程中逐渐沉淀出来的啤酒酵母为材料,结合三门峡职业技术学院食品园林学院啤酒投料生产时间,于2012年8月到11月间,对啤酒生产过程中所产生的啤酒底泥进行收集,并进行活性酵母的分离与选育,以获得优良酵母菌株,并对所分离酵母菌进行啤酒发酵小试,测定发酵性能,确定是否适合发酵生产投加。
1 材料与方法
1.1 取样
选用5L三角瓶,清洗后于121℃灭菌30分钟,置于无菌环境中备用。
采用无菌取样技术,从啤酒发酵罐底部收集发酵过程所产生的废弃啤酒酵母底泥。置于4℃备用。
1.2 分离培养基配制
分离啤酒酵母所用培养基为PDA(马铃薯葡萄糖琼脂)培养基。
a.成分
马铃薯 300g 葡萄糖 20g
琼脂 20g 蒸馏水 1L
b.制法
将马铃薯去皮切块,加1L蒸馏水,煮沸10-20分钟,用纱布过滤,补加蒸馏水至1L,加入葡萄糖和琼脂,加热融化,分装,115℃高压灭菌20分钟。
c.制备分离平板
采用无菌操作技术,将灭菌培养基趁热倒入无菌培养皿中,静置凝固后备用。
d.平板分离
将酵母底泥经过滤除杂、碱洗水洗除去表面吸附和夹杂的啤酒花,蛋白和颗粒杂质,剩余酵母经稀释后制备成梯度稀释液,选用10-6稀释度菌液进行平板涂布,置于28℃条件下培养3-5天。
1.3 酵母菌发酵性能测定
按照啤酒发酵工艺流程将所分离的啤酒酵母用于啤酒发酵小试[3],通过发酵产物的理化指标(糖度、菌体生长,发酵力、菌株凝集性、死灭温度)检测其发酵性能,判定菌种是否适合发酵生产投加。
具体酵母扩培及发酵操作流程:
a.原菌试管,液体试管活化
普通斜面试管可在无菌操作条件下,用接种环取1-2环菌苔接入10mL液体麦汁试管中活化一次。每四小时将试管在手掌心中敲击80-100次。
b.平板分离
提前制备10-12°P的固体麦汁培养基,灭菌后无菌操作倾注平板,冷却后从活化的液体麦汁试管无菌取样,进行平板画线分离。接种时选择生长快,比较大,乳白色,边缘整齐的正常菌落。
c.平板单菌落转接
在分离平板中选择4-6个单菌落,无菌操作,接入10mL液体麦汁试管中,摇动至菌苔扩散,培养24-36h,每4h将试管在手掌心敲击80-100次。
从城区规模的阶段性变化来看,南、西南、西以及西北向的城区规模自1999年~2014年,属于稳健发展,城区规模在逐步扩展;对比东北、东以及东南向会发现:这3个方向在2011年以前的城区规模属于有限的,但2011年以后的4期城市扩展规模来看,属于快速发展,尤其是东北向极为显著。
d.逐级扩培
由液体试管转入250mL三角瓶、1L三角瓶、5L三角瓶逐级扩培。扩培容器装量一般在55%-65%之间,麦汁浓度为12°P,提前灭菌备用。接种量保持在 1∶(8-10),1∶(6-8),1∶(4-6), 培养温度依次下降 1-2℃,培养时间在18-24h之间,每4h摇动一次,每次1-2min,以充分吸氧,并将CO2释出。
种酵母接入发酵罐后,与麦汁的比例不可大于1∶10,最好在 1∶3-5 左右。 保温通氧发酵,直至主发酵结束后。
啤酒发酵工艺流程见图1。
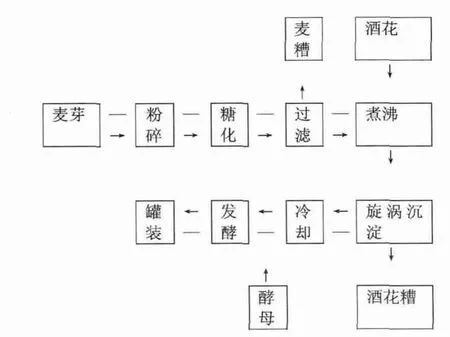
图1 啤酒酿造工艺流程
2 结果与讨论
2.1 酵母菌形态特征
根据平板菌落形态从中分离出高活性啤酒酵母一株。显微镜下菌体呈典型椭圆状,出芽生殖明显。平板及试管菌落形态见图2,菌落大而饱满,向上凸起,中间略有凹陷,直径1-1.5cm,表面光滑潮湿,有光泽,乳白色,菌落正反面颜色一致,边缘整齐。
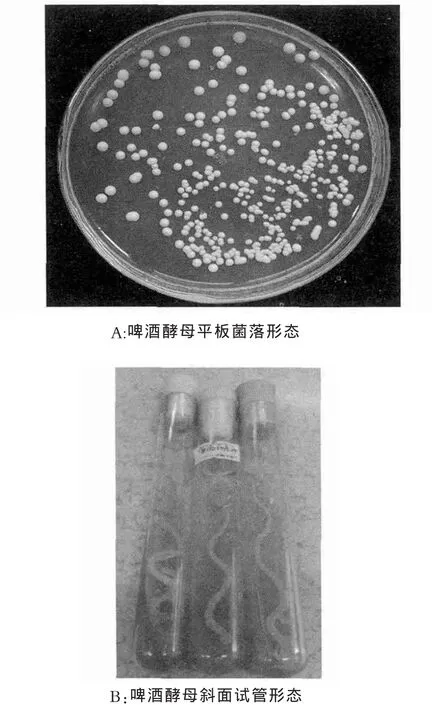
图2 底泥啤酒酵母菌落形态
将分散度良好、具有典型形态的菌落经平板画线分纯后,挑取单菌落接种于PDA斜面培养基,28℃培养3-5天,菌体形成后置于4℃备用。
2.2 酵母菌发酵性能测定
对分离到的酵母菌进行逐级扩培,由试管斜面→10ml试管→250ml三角瓶→1L三角瓶→5L三角瓶→300L发酵罐进行麦芽汁发酵,并对发酵过程进行跟踪检测,根据菌种的发酵、产酸及啤酒的口感和风味,综合评价其发酵性能。
随着发酵的进行,酵母菌将利用自身代谢,将麦芽汁中的糖转化为酒精,糖度逐步下降。对发酵前160小时发酵液中糖度变化进行连续监测,降糖效果良好,具体糖度变化见表1和图3。
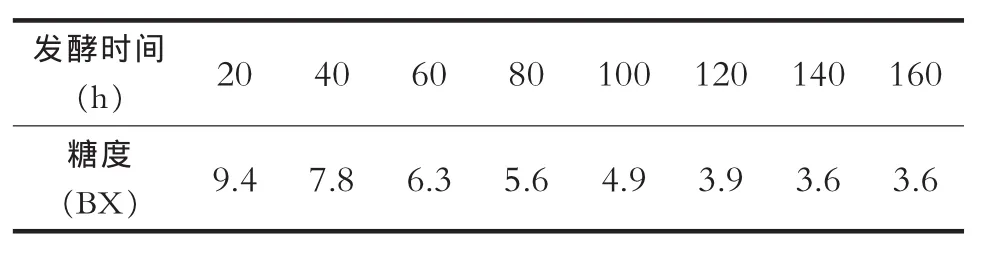
表1 酵母菌发酵过程糖度变化
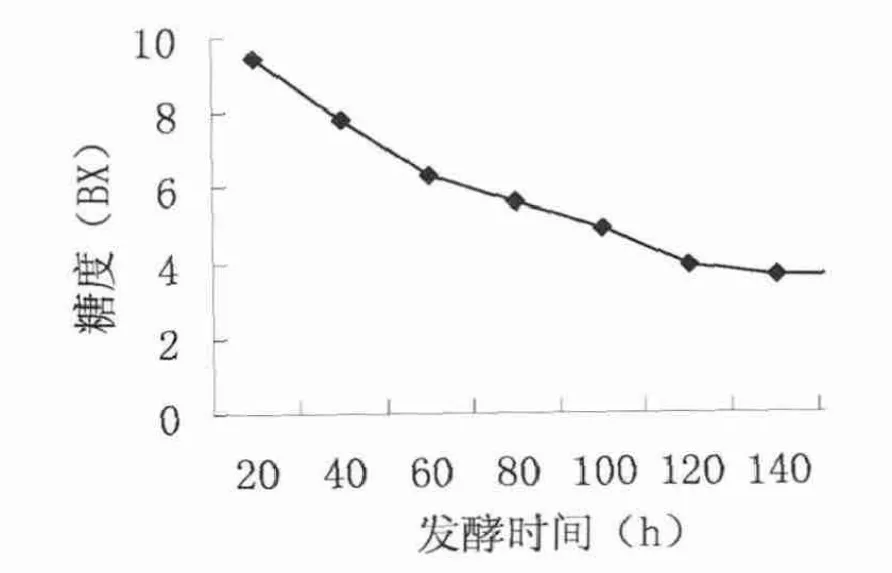
图3 发酵过程糖度变化曲线
从发酵过程糖度变化曲线可以看到,所分离酵母菌在发酵过程有较好的降糖效果,发酵初期,降糖量较高,20小时单位降糖量在1.3-1.6BX,表明菌体生长代旺盛,能快速利用糖分;后期趋于平稳,20小时单位降糖量在0.3-1BX,经连续7天培养后,稳定在3.6BX,表明菌体进入产物积累阶段,总体降糖曲线显示该酵母菌发酵能力强,代谢旺盛,发酵速度快。该研究结果与刘潇[3]、易庆平[4]等研究结果一致,所分离菌株均表现出较强的降糖能力。
2.2.2 菌体生长状况
对发酵过程中酵母菌体生长状况进行实时观测,结果表明:
a.酵母菌在发酵前中期均呈典型的椭圆形,菌体形态均一,出芽生殖明显,为典型的单端出芽,代谢活跃,发酵后期随着衰亡期到来,发酵主过程结束,部分菌体形态发生变化,出现异常形态,但椭圆形仍为绝大部分酵母菌体存在的主流形态。
b.对不同发酵阶段的发酵液进行取样、染色,鉴定酵母菌的死活性,结果经美兰染色后菌体均呈现无色,说明发酵液中活性酵母菌占绝对优势,菌体生长状况良好,且纯度高,无杂菌感染。
c.利用乳糖胆盐发酵管对发酵液中是否存在大肠菌群进行测定,乳糖胆盐发酵管未出现变色、产气现象,说明发酵过程无大肠杆菌污染,发酵产物符合卫生学标准要求。
2.2.3 发酵力测定
参照肖亚新[5]测定方法对所分离酵母菌进行发酵力测定,所分离酵母菌CO2失重量见表2。

表2 酵母菌发酵过程CO2失重
从表2可以看出所分离菌株发酵70h时CO2失重达到9.3,是发酵速度较高的酵母。
2.2.4 菌株死灭温度测定
参照刘潇等[3]的测定方法对所分离菌株进行死灭温度测定。
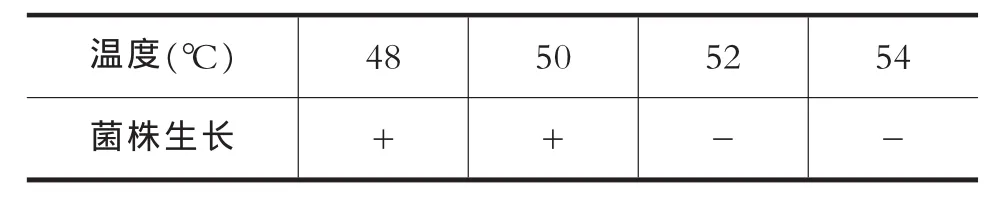
表3 菌株死灭温度测定
+:菌体生长;-:菌体不生长。
如表3所示:所分离酵母菌在52℃培养后不再繁殖,因此该酵母菌死灭温度为52℃,耐热性能良好。
2.2.5 菌株凝集性测定
采用本斯试验方法[6]测定菌株凝聚性,所分离酵母菌在三角瓶底部出现明显的沉淀现象,离心后得到酵母沉淀0.8ml,凝集性较高。
2.2.6 小试发酵啤酒品质检验
利用所分离底泥啤酒酵母进行啤酒小试发酵,发酵结束后,酒液淡黄色,酒质柔和,10℃下测得成品酒酒精度为3.4,泡沫丰富,挂壁良好,浓香醇厚,有明显的麦芽香,苦味爽口,杀口力强,保持了本实训室传统发酵啤酒的风味,同时,与尹花等研究结果相吻合[7]。发酵成品见图4。

图4 啤酒小试成品酒
3 结论
通过对啤酒底泥中活性酵母菌进行分离纯化,得到一株高纯度啤酒酵母菌,扩大培养后用于啤酒发酵小试,通过对发酵过程的菌体生长状况、凝集性、死灭温度、发酵力、降糖能力及成品酒感官检验结果的跟踪监测,结果表明:所分离酵母菌菌种活性高,发酵力强,凝集性较高,死灭温度达到52℃,降糖效果明显,成品酒泡沫丰富,挂壁良好,浓香醇厚,出酒风味优良,保持了本实训室传统发酵啤酒的风味,为啤酒发酵的优良菌株,可直接用于生产。
[1]衣龙海,郭玲玲,张巍,等.啤酒酵母泥的综合利用[J].酿酒,2009(6):86-87.
[2]杜丹,赵春燕.啤酒酵母泥综合利用的研究动态[J].技术研究,2006(8):31-32.
[3]刘潇,田瑞华,葳力斯.啤酒酵母分离纯化及性能测定[J].酿酒,2009(2):82-83.
[4]易庆平,李居宁.青岛啤酒酵母与高浓酵母筛选高浓酿造酵母融合亲株100L发酵分析[J].食品工业科技,2013(4):168-170.
[5]肖亚新.啤酒厂酵母菌株筛选技术[J].食品工业科技,1999(4):21-22.
[6]梁爱芬.浅谈如何稳定啤酒成品的发酵度[J].广州食品工业科技,1994(3):58-59.
[7]尹花,田玉红,郝俊光,等.18种老化指示物质在啤酒发酵过程中的变化研究[J].食品工业科技,2013(1):63-66.

