营养条件对微藻碳、氮稳定同位素组成的影响
王海霞,刘 瑀,关春江,路 琳,鲍惠铭,4,刘保占
(1.大连海事大学航海学院,辽宁 大连 116026;2.大连海事大学环境科学与工程学院,辽宁 大连 116026;3.国家海洋环境监测中心,辽宁 大连 116023;4.路易斯安那州立大学,地质与地球物理学院,巴吞鲁日 70803)
营养条件对微藻碳、氮稳定同位素组成的影响
王海霞1*,刘 瑀2,关春江3,路 琳2,鲍惠铭2,4,刘保占2
(1.大连海事大学航海学院,辽宁 大连 116026;2.大连海事大学环境科学与工程学院,辽宁 大连 116026;3.国家海洋环境监测中心,辽宁 大连 116023;4.路易斯安那州立大学,地质与地球物理学院,巴吞鲁日 70803)
以5种微藻(甲藻3种,硅藻、绿藻各1种)为试验材料,探讨了不同营养条件对微藻不同生长阶段碳氮稳定同位素组成的影响.结果表明,不同纲微藻的δ13C值和δ15Ν值在稳定生长期高于指数生长期,且与生长速率没有相关性(P>0.05).硅藻的δ13C值低于甲藻和绿藻,绿藻和甲藻的δ13C值比较相近;甲藻的δ15N值低于硅藻和绿藻,绿藻和硅藻的δ15N值比较相近,且同属甲藻纲的海洋原甲藻、塔玛亚历山大藻和强壮前沟藻的δ15N值有较大的差异. 5种微藻在不同营养条件(营养盐充足、缺氮、缺磷)下培养,氮限制和磷限制导致微藻具有更正的δ13C和δ15N,磷限制的影响不明显,且弱于氮抑制.
微藻;稳定同位素;营养盐;指数生长期;稳定生长期
微藻是海洋生态系统中最主要的初级生产力,是海洋食物链的基础,也是引发赤潮的主要生物.氮、磷等营养盐是浮游植物生命活动必需的主要营养元素,也是海水富营养化的主要组分,可通过其浓度和比率的变化来影响赤潮的发生与发展.海水中营养盐的含量不仅会影响浮游植物的生长速率,还会影响微藻细胞的生化组成,引起微藻稳定同位素组成的变化[1],由于营养级串联效应进一步影响营养级判定、分馏等变化,从而影响到其在整个食物链和生态系统中的传递.
食物网[2-3]和生态过程的重建或者生态行为的追踪[4-5],能揭示有机物质的循环路径及研究消费者之间的营养级关系[6-7],但目前多集中在大型植物、沉积物、游泳类动物等较容易分离的样品,Usui等[8]研究了西北太平洋Tokachi陆架、陆坡表层沉积物中有机碳的来源与分布;Zhang等[9]研究了长江口颗粒有机碳及表层沉积物有机质的分布特征等.对浮游植物的研究,因其难以和与其相似的浮游动物及碎屑分离,研究相对较少[10-11].稳定同位素方法以其安全、准确及不干扰自然等优越性在海洋学方面的应用已逐渐引起大家的重视.该方法可以示踪海水中物质和能量的主要来源及其转化机制等生物地球化学循环,对于研究水生生态系统富营养化具有重要意义.目前利用稳定同位素技术在微藻中的应用,国内研究比较少.本试验在人工培养条件下,利用稳定同位素技术研究微藻的生长期(指数生长期和稳定生长期)、生长速率及营养盐变化对五种微藻的影响,探讨微藻稳定同位素比值与各因子的响应机制,以期建立赤潮预警预报新技术,对保护海洋生态环境有重要的理论和现实意义.
1 材料与方法
1.1 试验藻种及培养
试验用5种微藻,其中甲藻3种,分别为海洋原甲藻(Prorocentrum micans)、强壮前沟藻(Amphidinium carterae Hulburt)、塔玛亚历山大藻(Aleχandrium tamarense),硅藻类为新月菱形藻(Nitzschia closterium),绿藻类为青岛大扁藻(Platymonas helgolandica),由国家海洋环境监测中心提供.海水(盐度为 30‰)取自大连黑石礁海域,过滤、陈化、高温灭菌后,加入营养盐和维生素配成Conway营养盐(表1),接入藻种,使藻细胞初始浓度为 104cell/mL,于温度(20±1)℃,照度3000Lx,光周期 12L∶12D的恒温培养箱中培养,每组设置3个平行.每天计数,计算出生长速率µ,计算公式如下∶
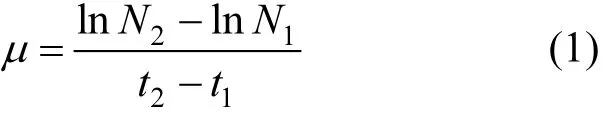
式中∶µ为微藻的生长速率,N2、N1为在t2、t1时间下的细胞数.当生长速率趋于平稳,并且在指数生长期的后期连续2d内生长速率为0时,则认为达到稳定生长期.
1.2 稳定同位素组成测定
在指数生长期和稳定生长期取出一定量的藻液,用Whatman GF/F玻璃纤维滤膜(预先在马弗炉中以450℃灼烧4h以去除有机物)过滤,60℃烘干至恒重,研磨,过筛.将处理好的样品用锡杯包样后在Flash EA 1112-ConFlo IV-IRMS(Delta V Advantage)联用仪上测定碳、氮稳定同位素(δ13C、δ15N).每测定10个样品插入1个标准样品,以保持实验结果的准确性和仪器的稳定性, δ13C的分析精度为±0.1‰,δ15N的分析精度为± 0.2‰.

表1 营养盐(NO3--N和PO43--P)浓度及氮磷比Table 1 Available dissolved nutrients (NO3--N and PO43--P) concentration and N:P
1.3 数据分析
实验数据用Microsoft Excel 2007分析平均值及标准偏差,用SPSS 17.0进行统计分析,采用单因素方差分析(One-way ANOVA),P<0.05即表示具有显著性差异.图用Origin 8.0绘制.所有统计值均以平均值±标准误(Mean±SE)表示[12].
2 结果与讨论
2.1 不同藻类稳定同位素的组成
营养盐充足条件下(N∶P=12∶1),微藻的碳稳定同位素值变化较大,且有重叠现象,硅藻的δ13C值低于甲藻和绿藻,绿藻和甲藻的δ13C值相近,而同属甲藻纲的塔玛亚历山大藻、海洋原甲藻和强壮前沟藻的δ13C 值有较大差异,见图1.Leboulanger等[13]和Andreas等[1]研究了甲藻、硅藻、绿藻、定鞭藻、针胞藻、隐藻、鞭毛藻和蓝藻的碳稳定同位素组成,认为其δ13C值的变化与其分类阶元没有相关性.由此可见,微藻的δ13C值与其分类阶元没有关系,不同纲物种的δ13C值不同,即使同纲的不同物种间的δ13C值也不同.
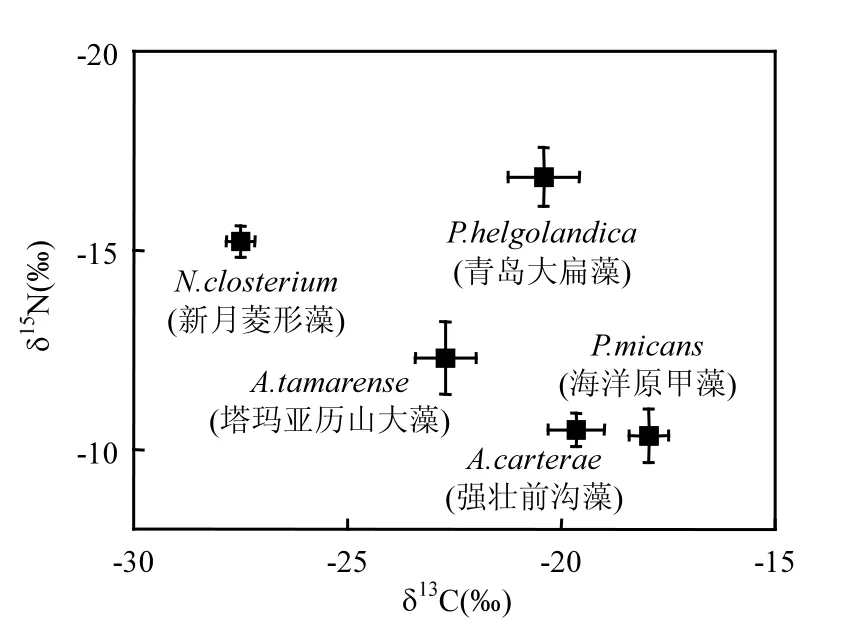
图1 正常培养条件下微藻的稳定同位素组成Fig.1 Stable isotope ratios of microalgae in nutrient sufficient
由图 1可见,微藻的氮稳定同位素值变动较大,且有交叉现象,甲藻的δ15N值低于硅藻和绿藻,绿藻和硅藻的δ15N值比较相近,且同属甲藻纲的海洋原甲藻、塔玛亚历山大藻和强壮前沟藻的δ15N值差异较大.甲藻的细胞氮磷营养储存能力,以及利用胞内储存氮磷营养进行生长繁殖的潜力明显高于硅藻[15],在相同培养条件下,甲藻细胞富集的14N相对较多,故甲藻的δ15N低于硅藻.
研究结果表明,不同纲微藻的δ13C和δ15N不同,同纲的不同物种的碳氮稳定同位素值也不相同,说明微藻所属阶元群的碳氮稳定同位素没有共性关系,而与微藻本身有关,且具有特异性.
2.2 生长期对微藻稳定同位素值变化影响
在本试验中,微藻δ13C 的变化范围为(−28.20±0.36)‰~(−16.40±0.90)‰,同种微藻的δ13C值在指数生长期和稳定生长期有重叠,且稳定生长期高于指数生长期,见表2.Vuorio等[15]发现微藻的δ13C 值为−34.4‰~−5.9‰,变幅达28.5‰;且不同微藻的δ13C值交叉重叠,稳定生长期的δ13C高于指数生长期,甲藻在指数生长期δ13C 值范围为-22‰~−10‰,蓝藻的范围为−22‰~−12‰,不同物种间没有可比性[1].浮游植物δ13C值的变化取决于无机碳的来源[16].微藻在指数生长期和稳定生长期利用无机碳的主要途径不同[17],在指数生长期,微藻细胞密度低,营养盐丰富,同位素分馏大.而在微藻的稳定生长期,细胞密度高,pH值也在增大,导致水体中CO2的交换速率持续小于微藻的吸收速率,大量的微藻浮在海面上,进一步阻止了海气界面的交换,pH值也有显著升高,从而引起C平衡向HCO3偏移,成为水体 DIC的主要组成部分,由于 HCO3的 δ13C值平均比自由态的CO2高8‰[18],最终导致δ13C值更正.在自然环境中,海洋浮游植物的δ13C值为−58.8‰[19]~−3.6‰[20],平均约−21‰[21],差异较大.
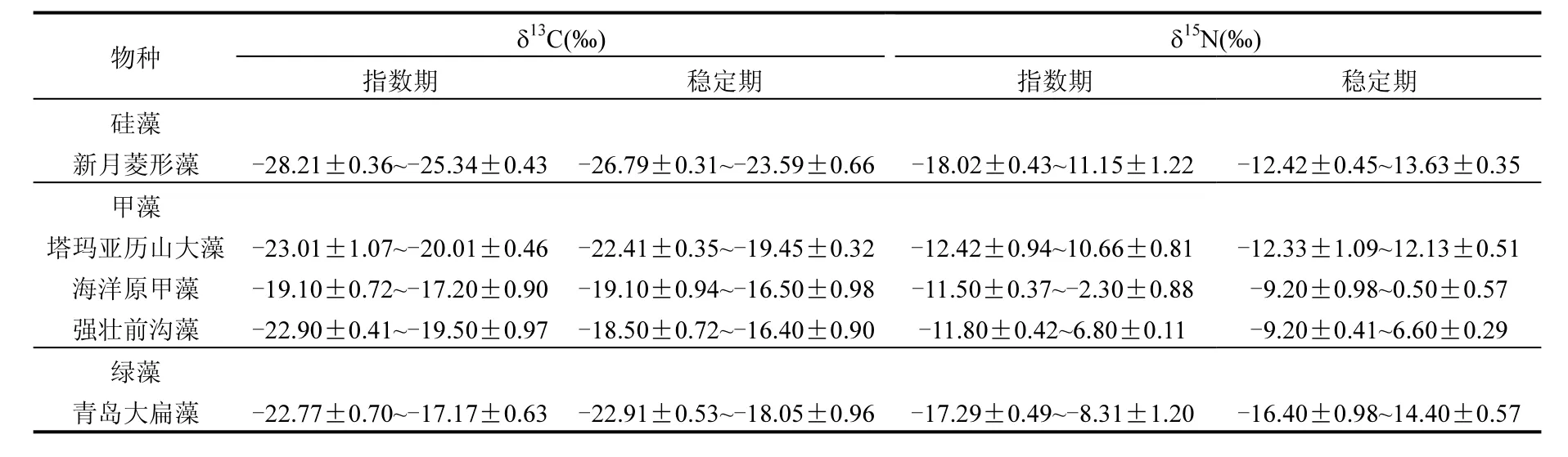
表2 不同生长期微藻类的δ13C值和δ15N值Table 2 δ13C and δ15N of microalgae in vegetative period
由表2可见,δ15N 值为(−18.02±0.34)‰~(14.40±0.57)‰,稳定生长期的δ15N高于指数生长期,且有重叠现象.同位素的分馏作用主要是由于不同原子质量反应速率的差别,通常原子质量轻的反应速率高于原子质量重的(即14k>15k)[22].在指数生长期,氮源相对充足,微藻优先吸收14N,随着水体氮源中14N的减少、15N比例的增加,生物群落结构、细胞大小及形态变化也能影响有机质氮同位素[23].
微藻优先吸收轻同位素(12C、14N),使表层水体“营养池”富集重同位素(13C、15N),随着营养物的进一步摄入,微藻的同位素也越来越重[24].对一般藻类来说,同一物种稳定生长期的δ13C、 δ15N值高于指数生长期;不同物种没有可比性.
2.3 营养条件对微藻稳定同位素的影响
浮游植物对营养盐的获得、吸收和同化速率对其生长起着重要作用.氮磷比是赤潮发生过程中营养状况的一个特征性比值,也是水体中植物受氮或磷限制的重要指标.一般情况下,高的 N/P(>30)表示磷限制,而低的N/P(<5)则表示氮限制[25].
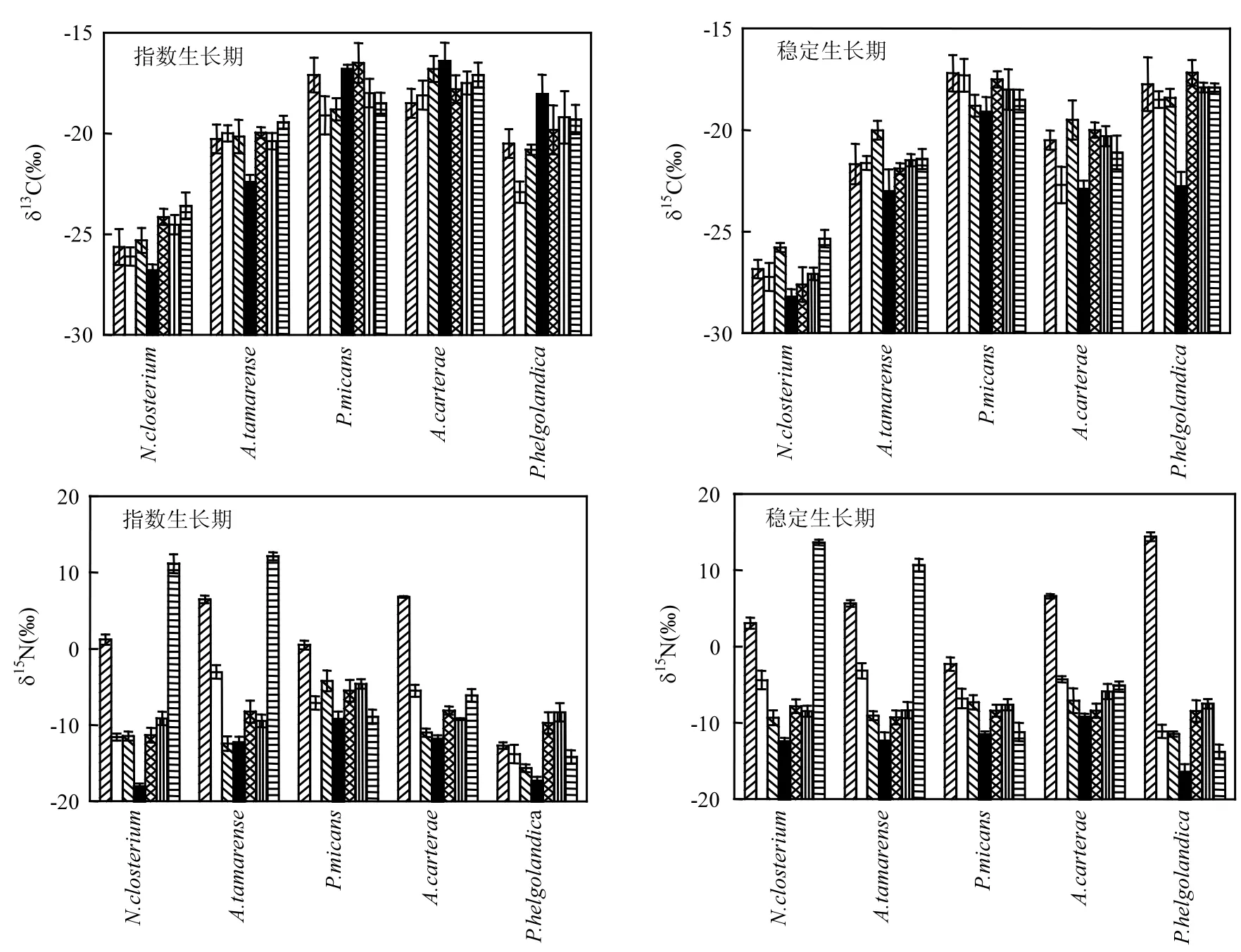
图2 不同营养条件下5种藻的同位素值变化Fig.2 δ13C and δ15N of five species when grown in nutrient suff i cient

无论在指数生长期还是稳定生长期,缺氮和缺磷都可引起藻细胞具有更正的δ15N值(图2).一般而言,微藻的δ15N值随着NO3--N浓度的增大先减小后增大,最小值均出现在正常组(N∶P=12∶1)(图2).在缺氮组(N∶P=1,N∶P=4),由于浮游植物对氮源的选择吸收,δ15N随着NO3--N浓度的增大而减小;在高氮组(N∶P=35∶1)微藻的δ15N值增大,是因为磷限制了藻体对氮源的吸收,过高的 N源浓度会抑制微藻的生长.不同微藻对营养盐的利用程度不同,导致其稳定同位素值不同,δ15N越大,对硝酸盐的利用程度越高[26].在低PO43--P浓度时,δ15N值随着浓度的增加没有明显变化,说明磷对氮吸收有较强的抑制作用;在高PO43--P浓度时(N∶P=116∶1),新月菱形藻和塔玛亚历山大藻的δ15N值急剧增大,而海洋原甲藻、强壮前沟藻及青岛大扁藻δ15N值更正,但变化幅度较小.不同藻种对磷的需求不同,磷对微藻δ15N值的影响要弱于氮.
氮、磷营养盐的浓度直接影响到浮游植物的生长繁殖,而N/P可引起一种或几种营养盐对浮游植物生长的限制,起同位素值的变化.Hodgkiss等[27]认为大部分甲藻赤潮生物生长的最适氮磷比率为6~15,在N、P限制条件下,甲藻细胞受影响较小,甲藻具有较高的N、P储藏能力[28],与藻体本身对氮源和磷源的需求和吸收方式等有关,具有特异性.
Scott等[29]认为藻类细胞的大小会随着细胞氮含量的下降而减小,欧林坚[30]认为磷限制使藻细胞的体积增大.本试验中,微藻的体积没有显著变化,在培养条件相同的情况下,微藻体积变化不是引起同位素变化的因素.微藻的稳定同位素值反映了微藻对相应营养物质的利用程度,同位素值越大,利用程度越高.研究结果表明∶在不同营养条件下,5种微藻受所处水体环境中营养盐水平的影响,氮限制导致微藻具有更正的δ13C、δ15N值;磷抑制对微藻δ13C、δ15N值的影响不明显,且弱于氮抑制.
微藻的碳氮稳定同位素值的变化受水体中营养盐影响,体现了δ13C、δ15N值响应与水环境的变化,反映了生物同化吸收营养盐过程中的同位素分馏作用.当环境改变时,如赤潮的爆发,都能引起微藻同位素值的变化.微藻的稳定同位素值的变化对赤潮的发生有一定的预示作用.
2.4 生长速率对稳定同位素的影响
本次试验的五种藻中,新月菱形藻的最大比生长率为0.90d−1,海洋原甲藻的最大比生长率为0.60d−1,塔玛亚历山大藻的最大比生长率为0.65d−1,强壮前沟藻的最大比生长率为0.50d−1,青岛大扁藻的最大比生长率为 0.45d−1.结果表明∶生长速率与微藻的 δ13C值没有相关性(P=0.20> 0.05,r=0.15),与微藻的 δ15N值亦没有相关性(P= 0.33>0.05,r=−0.12).
已有研究表明生物体积和生长速率是浮游植物稳定同位素值的影响因素[13,31].生长速率高的小细胞可以快速的利用 CO2,引起同位素的分馏,导致细胞富集13C;而生长速率低的大细胞则不可能引起同样的变化,所以小细胞具有更负的δ13C值.所有研究(包括前人的研究)表明∶生长速率与微藻的 δ13C值显示出显著负相关(P=0.003 <0.05,r= 0.25),如图3.较高的生长速率能导致更正的δ13C值.在大量数据统计的基础上,生长速率和δ13C有弱相关性[1],可以为浮游植物总体趋势的研究提供参考.但在食物网的研究中,应进一步考虑环境条件,因为微藻细胞的尺寸及形态[13]、光照[32]、生长速率[33]、温度[34]、盐度[13]、营养盐的固定方式[13]和 pH 值[35]都能影响同位素的分馏.微藻的最佳生长条件不同,且具有特异性,本研究中的生长条件也许不是对所有的藻种都最佳,可能影响其δ15N值与生长速率没有相关性.
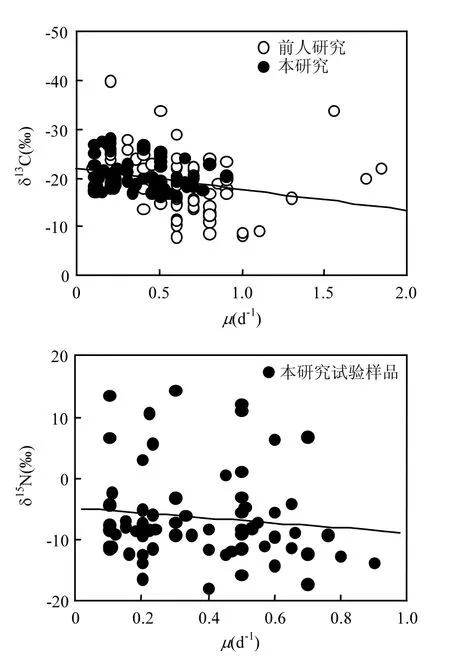
图3 稳定同位素值(δ13C、δ15N)和生长率的关系(µ)Fig.3 Stable isotope signatures (δ13C, δ15N) as a function of the growth rate (µ)
3 结论
3.1 微藻的碳、氮稳定同位素值与其分类阶元没有共性关系,同一纲不同种的稳定同位素组成不同,不同物种的稳定同位素组成不同;一般而言,同一物种的稳定同位素组成稳定生长期要高于指数生长期.
3.2 微藻碳、氮稳定同位素组成与营养盐有很大关系.氮限制导致微藻具有更正的δ13C、δ15N值;磷抑制对微藻δ13C、δ15N值的影响不明显,且弱于氮抑制..微藻的稳定同位素值的变化对赤潮的发生有一定的预示作用
3.3 微藻的生长速率µ与δ13C 没有相关性(P=0.20>0.05,r=0.15),与δ15N 亦没有相关性(P=0.33>0.05,r=−0.12).但在大量数据统计的基础上,微藻的生长速率和δ13C 有负相关性(P=0.003<0.05,r=0.25),可以为浮游植物总体趋势的研究提供参考.
[1] Andreas B, Elin L, Edna G, et al. Carbon isotope signature variability among cultured microalgae: Influence of species, nutrients and growth [J]. Journal of Experimental Marine Biology and Ecology, 2009,372:98—105.
[2] Craig A L, Marcio S A, Ross B, et al. Applying stable isotopes to examine food-web structure: an overview of analytical tools [J]. Biological Reviews, 2012,87(3):545-562.
[3] Mao Z G, Gu X H, Zeng Q, et al. Food web structure of a shallow ertrophic lake (Lake Taihu, China) assessed by stable isotope analysis [J]. Hydrobiologia, 2012,683(1):173-183.
[4] Kirk O W, David J H, Allison A P, et al. Stable isotope analysis reveals food web structure and watershed impacts along the fluvial gradient of a Mesoamerican coastal river [J]. River Research and Applications, 2011,27(7):791-803.
[5] 李 斌,徐丹丹,王志坚,等.三峡库区蓄水175m对汉丰湖不同生物类群δ13C、δ15N值的影响[J].中国环境科学,2013,33(8):1426-1432.
[6] Linda M C, Robert T, David B, et al. Re-engineering the eastern Lake Erie littoral food web: The trophic function of nonindigenous Ponto-Caspian species [J]. Journal of Great Lakes Research, 2009,35(2):224-231.
[7] Li Z Q, Zhang M, Cao T, et al. Variation in stable isotope signatures of the submersed macrophyte Vallisneria natans collected from several shallow lakes in China [J]. Journal of Freshwater Ecology, 2011,26(3):429-433.
[8] Usui T, Nagao S,Yamamoto M,et al. Distribution and sources of organic matter in surficial sediments on the shelf and slope off Tokachi, western North Pacific, inferred from C and N isotopes and C/N ratios [J]. Marine Chemistry, 2006,98(2-4):241-259.
[9] Zhang J, Wu Y, Jennerjahn T C, et al. Distribution of organic matter in the Changjiang(Yangtze River) Estuary and their stable carbon and nitrogen isotopic ratios: Implications for source discrimination and sedimentary dynamics [J]. Marine Chemistry, 2007,106(1-2):111-126.
[10] Sun J, Liu S Y, Cai X Y, et al. The chlorophyll a concentration and estimating of primary productivity in the Bohai Sea in 1998-1999 [J]. Acta Ecologica Sinica, 2003,23(3):517-526.
[11] 赖廷和,邱绍芳.北海近岸水域浮游植物群落结构及数量周年变化特征 [J]. 海洋通报, 2005,24(5):28-32.
[12] 王海霞,刘 瑀,鲍惠铭,等.黑石礁海域生物碳氮稳定同位素组成的研究 [J]. 海洋湖沼通报, 2012,3:113-120.
[13] Leboulanger C, Descolas-Gros C, Fontugne M R, et al. Interspecific variability and environmental influence on particulate organic carbon δ13C in cultured marine phytoplankton [J]. Journal of Plankton Research, 1995,17(11):2079-2091.
[14] 吕颂辉,李 英.我国东海4种赤潮藻的细胞氮磷营养储存能力对比 [J]. 过程工程学报, 2006,6(3):439-444.
[15] Vuorio K, Meili M, Sarvala J. Taxon-specific variation in the stable isotopic signatures (δ13C and δ15N) of lake phytoplankton [J]. Freshwater Biology, 2006,51(5):807-822.
[16] Finlay J C. Patterns and controls of lotic algal stable carbon isotope ratios [J]. Limnology and Oceanography, 2004,49(3):850-861.
[17] Nimer N A, Merret M J, Brownlee C. Inorganic carbon transport in relation to culture age and inorganic carbon concentration in a high-calcifying strain of Emiliania huχleyi (Prymnesiophyceae) [J]. J. Phycol., 1996,32:813-818.
[18] Mook W G, Bommerson J C, Stavermen W H. Carbon isotope fractionation between dissolved bicarbonate and gaseous carbon dioxide [J]. Earth and Planetary Science Letters, 1974,23:169-176.
[19] Popp B N, Laws E A, Bidigare R R, et al. Effect of phytoplankton cell geometry on carbon isotopic fractionation [J]. Geochimica et Cosmochimica Acta, 1998,62(1):69-77.
[20] Sachs J P, Repeta D J, Goericke R. Nitrogen and carbon isotopic ratios of chlorophyll from marine phytoplankton [J]. Geochimica et Cosmochimica Acta, 1999,63(9):1431-1441.
[21] Boschker H T S, Middelburg J J. Stable isotopes and biomarkers in microbial ecology [J]. FEMS Microbiology Ecology, 2002, 40(2):85-95.
[22] 俞志明.不同氮源对海洋微藻氮同位素分馏作用的影响 [J].海洋与湖沼, 2004,35(6):524-529.
[23] Karsh K L, Trull T W, Lourey M J, et al. Relationship of nitrogen isotope fractionation to phytoplankton size and iron availability during the Southern Ocean Iron Release Experiment (SOIREE) [J]. Limnology and Oceanography, 2003,48(3):1058-1068.
[24] Crosta X, Koc N. Diatoms: From micropaleontology to isotope geochemistry [C]//Hilaire-Marcel C, de Vernal A.Proxies in LateCenozoic Paleoceanography, Developments in Marine Geology Series, Volume 1. Amsterdam: Elsevier, 2007:327-369.
[25] Darley Marshall W. Algal biology: A physiological approach [M]. Oxford London: Blaek-well Scientific Publications, 1982.
[26] 李铁刚,熊志方.海洋硅藻稳定同位素研究进展 [J]. 海洋与湖沼, 2010,41(4):645-656.
[27] Hodgkiss I J, Ho K C. Are changes in N:P ratios in coastal waters the key to increased red tide blooms? [J]. Hydrobiologia, 1997, 352(1-3):141-147.
[28] 王昭玉,王江涛.7种海洋微藻叶绿素荧光对 N、P 限制的响应[J]. 海洋环境科学, 2013,32(2):165-170.
[29] Scott G L, Susan S K, Daniel A K, et al. Effect of Nutrient Availability on the Biochemical and Elemental Stoichiometry in the Freshwater Diatom Stephanodiscus minutulus (Bacillariophyceae) [J]. Journal of Phycology, 2000,36(3):510-522.
[30] 欧林坚.典型赤潮藻对磷的生理生态响应 [D]. 厦门:厦门大学, 2006:8.
[31] Korb R E, Raven J A, Johnston A M, et al. Effects of cell size and specif i c growth rate on stable carbon isotope discrimination by two species of marine diatom [J]. Marine Ecology Progress Series, 1996,143(14):283-288.
[32] Thompson P A, Calvert S E. Carbon-isotope fractionation by a marine diatom: the inf l uence of irradiance, daylength, pH, and nitrogen source [J]. Limnology and oceanography, 1994,39:1835-1844.
[33] Burkhardt S, Riebesell U, Zondervan I. Stable carbon isotope fractionation by marine phytoplankton in response to daylength, growth rate, and CO2availability [J]. Marine Ecology Progress Series, 1999a,184:31-41.
[34] Sackett W M, Eckelmann W R, Bender M L, et al. Temperature dependence of carbon isotope composition in marine plankton and sediments [J]. Science, 1965,148(3667):235-237.
[35] Hinga K R,Arthur M A,Pilson M E Q, et al. Carbon isotope fractionation by marine phytoplankton in culture: the effects of CO2concentration, pH, temperature, and species [J]. Global Biogeochemical cycles, 1994,8(1):91-102.
天然草原鲜草逾10.5亿t
农业部发布的《2013年全国草原监测报告》显示,2013年我国草原保护建设力度进一步加大,草原畜牧业生产方式加快转变,全国天然草原鲜草产量再创新高,草原生态呈现加快恢复的良好态势.2013年,全国天然草原鲜草总产量达到105581.2万t,较上年增加0.59%,为近10年来最高.
2013年,国家用于草原生态保护补奖政策实施、退牧还草工程等方面的中央投资总额达207.75亿元,是“十一五”时期中央投资总额的 1.2倍.在草原生态补奖政策和重大生态工程的带动下,各地草原保护建设力度明显加大.2013年,全国草原综合植被盖度达54.2%,较上年增加0.4个百分点.草原牧区以放牧为主的传统畜牧业生产方式加快转变,畜牧业对天然草原的依赖程度不断下降,草原科学合理利用水平进一步提高.2013年,全国禁牧草原面积达0.96亿hm2,草畜平衡面积达1.73亿hm2;全国重点天然草原的平均牲畜超载率为16.8%,较上年下降6.2个百分点,自新世纪以来首次下降到20%以下.
摘自中国环境网
2014-03-04
Effects of nutritional conditions on the stable carbon and nitrogen isotope of microalgae.
WANG Hai-xia1*, LIU Yu2, GUAN Chun-jiang3, LU Lin2, BAO Hui-ming2,4, LIU Bao-zhan2
(1.Navigation College, Dalian Maritime University, Dalian 116026, China;2.College of Environmental Science and Engineering, Dalian Maritime University, Dalian 116026, China;3.National Marine Environmental Monitoring Center, Dalian 116023, China;4.Department of Geology and Geophysics, Louisiana State University, Baton Rouge 70803, U.S.A.). China Environmental Science, 2014,34(3):727~733
With five microalgae (dinoflagellates, diatoms, green algae species) as test materials, the effect of different nutrient conditions had been explored on the stable carbon and nitrogen isotopic throughout the growth phases. The result showed that among different classes of microalgae the δ13C and δ15N at the exponential phase were lower than those at the stable phase, indicating no correlation with growth velosity (P>0.05). Bacillariophyceae presented a higher δ13C than dinophyceae and chlorophyceae, while the δ13C of dinophyceae was nearly identical to that of chlorophyceae. In terms of δ15N, the dinophyceae falls behind both bacillariophyceae and chlorophyceae, with bacillariophyceae approximating to chlorophyceae. In addition, significant δ15N differences have been discovered among Prorocentrum micans, Aleχandrium tamarense and Amphidinium carterae Hulburt. In this study, all five classes were grown under three distinctive cultures—nutrient sufficiency, nitrogen deficiency and phosphorus deficiency; either nitrogen or phosphorus limitation contributed to a more positive δ13C and δ15N, yet less obvious effect was observed in phosphorus-deficiency culture than in nitrogen-deficiency condition.
microalgae;stable isotope;nutrients;exponential phase;stationary phase
X142
:A
:1000-6923(2014)03-0727-07
王海霞(1982-),女,山东梁山人,博士,主要从事海洋环境化学方面研究.发表文章6篇.
2013-05-21
* 责任作者, 博士, whxdmu@163.com

