奥利司他片的制备及体外溶出度考察
崔 健,陈小伟,郝贵周
(鲁南制药集团股份有限公司,山东 临沂 276006)
奥利司他(orlistat)为一种胃肠道脂酶抑制剂,能竞争性抑制约1/3摄入脂肪的吸收,显著降低肥胖且毒副作用较轻[1,2]。奥利司他水溶性差,制剂的体外溶出较难达到要求。本文采用湿法制粒工艺进行奥利司他片的制备,以溶出度为考察指标,采用正交设计进行处方优化,确定最佳处方,并与原研制剂(Xenical)进行体外溶出曲线对比研究。
1 仪器与试药
1.1 仪器 Agilent 1260液相色谱仪;SOTAX AT7 smart溶出试验仪(瑞士);HLSH2-6型湿法混合制粒机(北京航空制造工程研究所);WBF-2G多功能流化床(重庆英格造粒包衣技术有限公司);GDH多向运动混合机(宁波市江东华中机械厂);DP30A单冲压片机(北京国药龙立科技有限公司)。
1.2 试药 奥利司他原料(山东新时代药业有限公司,含量99.8%);奥利司他胶囊(罗氏制药,商品名Xenical,规格 0.12g);奥利司他对照品(USP Rockville,含量99.7%,批号F0G243);微晶纤维素(FMC,型号PH101);甘露醇(罗盖特);低取代羟丙基纤维素(日本信越,型号LH-21);十二烷基硫酸钠(SDS,湖南尔康制药股份有限公司);硬脂酸镁(安徽山河药用辅料股份有限公司)。
2 方法
2.1 奥利司他片的制备 称取奥利司他细粉120g、甘露醇175 g、微晶纤维素180g、低取代羟丙基纤维素LH-2130g、十二烷基硫酸钠15 g,加入湿法混合制粒机混合15min,加入纯化水制粒,过20目筛;流化床30℃干燥60min,过20目筛整粒;加入多向运动混合机中,加入硬脂酸镁10g,混合5min;Φ17mm×7mm胶囊型浅弧冲压片。
2.2 溶出度测定
2.2.1 色谱条件 色谱柱:Ultimate XB C18(150mm ×4.6mm,5μm);流动相:水 - 乙腈(14:86);流速:1mL·min-1;检测波长:195 nm,进样量:20μL。
2.2.2 标准曲线的绘制 精密称取奥利司他对照品约130mg,置100mL量瓶中,加乙腈溶解并稀释至刻度,摇匀,作为对照品储备液。精密量取储备液0.5、2、3.5、5、6mL 分别置50mL 量瓶中,用溶出介质稀释至刻度,摇匀,按“2.2.1”项下色谱条件测定,以峰面积A对浓度C进行回归的标准曲线方程:A=17733C+24.886,r=0.9999。结果表明奥利司他在13~156 μg·mL-1范围内峰面积 A与浓度C具有良好的线性关系。
2.2.3 回收率测定 精密称取奥利司他对照品适量,按处方比例加入相应量辅料,在线性范围内配制高、中、低3 个浓度,104、130、156 μg·mL-1,每个浓度各3个样品,按”2.2.1”项下色谱条件测定,计算回收率。结果平均回收率为 98.7%,RSD为0.77%。
2.2.4 体外溶出度的测定 照溶出度测定法[《中国药典》2010年版(二部)附录ⅩC第二法][5]测定,以pH 6.0缓冲液(含3.0%SDS、0.5%氯化钠,用磷酸调节pH值至6.0)900mL为溶出介质,转速为75 rpm,依法操作,于45min取溶出液5mL,滤过,取续滤液作为供试品溶液;分别精密量取供试品溶液及对照品溶液按“2.2.1”项下色谱条件测定,记录色谱图,按外标法计算溶出度。
3 结果
3.1 处方优化 经过初步的处方筛选,确定片重为530mg,所用辅料为甘露醇、微晶纤维素(A)、低取代羟丙基纤维素LH-21(B)、十二烷基硫酸钠(C)、硬脂酸镁(D)。在预实验的基础上,按表1的因素水平进行L9(34)正交设计,用甘露醇将片重调整至理论值。按“2.2.4”项下的方法进行溶出度测定,以溶出度为考察指标,结果见表2。
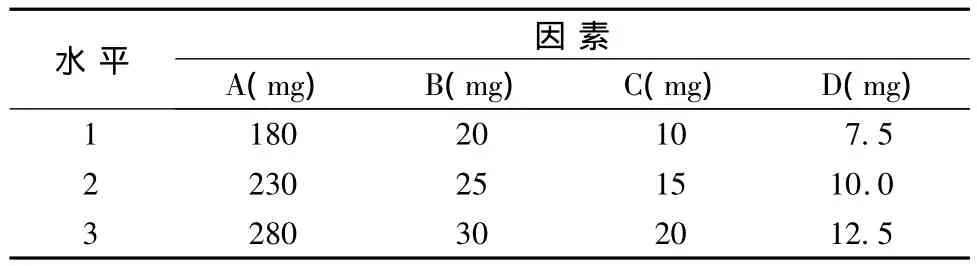
表1 L9(34)正交试验因素水平表
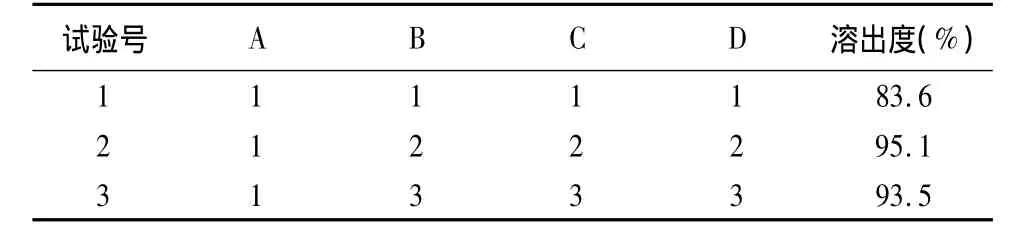
表2 L9(34)正交试验与结果
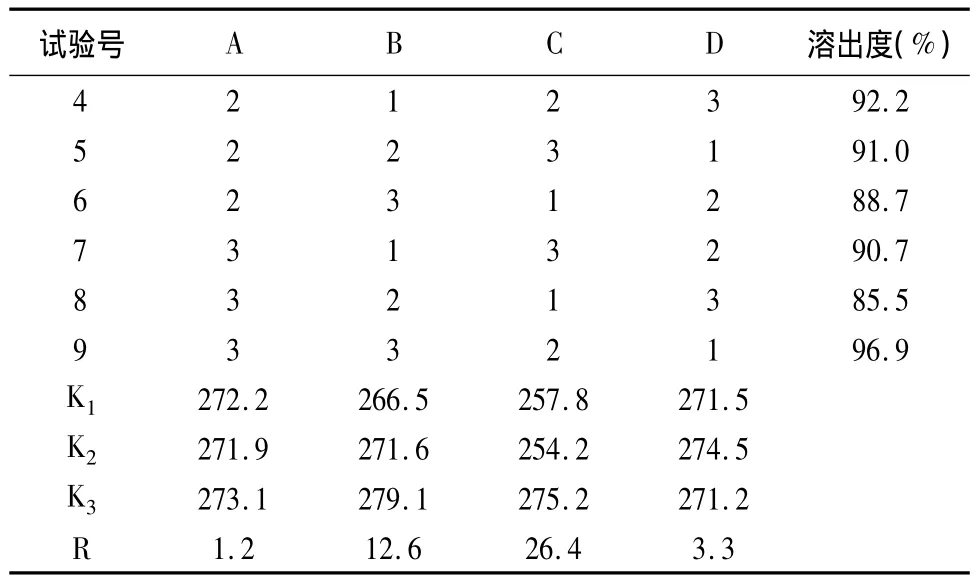
续表2:
3.3 由表1、表2结果可知,各因素对溶出度影响的顺序为C>B>D>A,表面活性剂十二烷基硫酸钠的用量对溶出度的影响最为明显,崩解剂低取代羟丙基纤维素的影响次之,微晶纤维素及硬脂酸镁对溶出度的影响不明显。最佳处方为A1B3C2D2,即奥利司他120mg、甘露醇175mg、微晶纤维素180mg、低取代羟丙基纤维素LH-2130mg、十二烷基硫酸钠15mg,硬脂酸镁10mg。
3.4 体外溶出曲线 根据初步处方筛选及正交设计优化,确定最终的处方工艺,按优化的处方工艺制备3批片剂,按”2.2.4”项下的方法分别于5、10、15、20、30、45、60、90、120min 取样进行体外溶出曲线测定,并与原研胶囊(Xenical)进行对比,结果如图1所示。
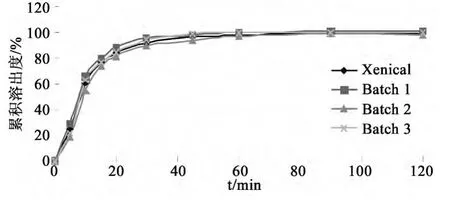
图1 奥利司他片及原研胶囊(Xenical)体外溶出曲线
采用f2相似因子法[3,4]评价自制片剂与原研胶囊的相似性,根据文献[4],选取合适时间点分别计算3批样品与原研胶囊间的f2值,经计算,f2值分别为71、66、79。结果表明优化处方工艺可行,且重现性好,制备的奥利司他片及原研胶囊(Xenical)体外溶出曲线相似。
4 讨论
奥利司他熔点较低,压片过程中易出现粘冲现象,除了增加辅料用量、控制环境温湿度、控制原辅料水分外,本实验中硬脂酸镁的用量远大于常规用量(1%以内),很好地解决了粘冲问题。体外溶出度试验对固体制剂的有着极其重要的意义,溶出曲线的测试已成为评价固体制剂内在品质的一种科学手段与方法。本实验制备的奥利司他片及原研胶囊体外溶出曲线相似,进一步表明了产品的内在质量与原研制剂具有一定的相似性,对后续的临床研究具有指导意义。
[1]齐绍康,袁捷.新型抗肥胖药奥利司他[J].中国新药杂志,2001,10(6):423 -425.
[2]陈应兰,王国村.新型抗肥胖药奥利司他的药理及临床应用[J].中国药房,2001,12(3):184 -186.
[3]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308 -311.
[4]张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(12):946 -955.
[5]国家药典委员会.中华人民共和国药典2010年版(二部)[S].北京:中国医药科技出版社,2010.

