坎地沙坦酯氨氯地平片含量测定
毛柯,陈宁,卢定强
南京工业大学 1药学院;2江苏省药物研究所,南京 211800
坎地沙坦酯氨氯地平片含量测定
毛柯1,2,陈宁2*,卢定强1,2
南京工业大学1药学院;2江苏省药物研究所,南京 211800
建立HPLC法同时测定坎地沙坦酯氨氯地平片两组分含量。色谱条件:采用C18色谱柱,流动相为甲醇-乙腈-20 mmol·L-1癸烷磺酸钠溶液[含0.04 mol·L-1KH2PO4(磷酸调pH 3.5)]=600∶100∶300,检测波长238 nm。坎地沙坦酯和氨氯地平分别在64.61~96.91 μg·mL-1、40.13~60.19 μg·mL-1浓度范围内杂质与原药较好分离。
高效液相色谱法;坎地沙坦酯;氨氯地平;含量测定
坎地沙坦酯氨氯地平片是由日本武田公司开发的治疗高血压的复方制剂,其主要组分为坎地沙坦酯和苯磺酸氨氯地平,于2010年4月在日本批准上市,商品名为“UNISIA”。本品为血管紧张肽Ⅱ受体阻断药和钙离子拮抗药的组合,能够大大提高降压达标率,长期接受治疗的安全性和耐受性显著提高[1]。有文献报道[2]同时测定坎地沙坦酯、氨氯地平含量,但是分析时间过长(约90 min);本实验在17 min内即可完成测定,且具有较高的专属性。
1 仪器与试药
LC-20A型高效液相色谱仪,LC-Solution型色谱工作站(日本岛津)。
坎地沙坦酯对照品(纯度:100.0%,批号:100685-200401)、苯磺酸氨氯地平对照品(纯度:99.67%,批号:100374-200903)均由中国药品生物制品检定所提供;坎地沙坦酯氨氯地平片(自制,批号:110301、110302、110303,规格:每片含坎地沙坦酯8 mg,氨氯地平5 mg);坎地沙坦酯杂质A、B、C、D、E、F由Toronto Research Chemicals Inc提供;氨氯地平杂质A由USP Rockville提供。甲醇、乙腈为色谱纯;其它试剂均为分析纯。
2 方法与结果
2.1 溶液配制
对照品溶液:精密称取坎地沙坦酯和苯磺酸氨氯地平对照品20.19 mg和17.39 mg,置100 mL量瓶中,加60%乙腈适量,超声使溶解,放至室温,加60%乙腈稀释至刻度,摇匀,得两者浓度分别为201.9 μg·mL-1和173.9 μg·mL-1的对照品储备液。精密量取对照品储备液4 mL,置100 mL量瓶中,加60%乙腈定容,摇匀,制成浓度分别为80.76 μg·mL-1和50.16 μg·mL-1的对照品溶液。
供试品溶液:取本品20片,研细,精密称取细粉适量(约1片量),置100 mL量瓶中,加60%乙腈适量,超声处理15 min,放至室温,加60%乙腈稀释至刻度,摇匀,过滤,取续滤液作为供试品溶液。
空白溶液:精密称取处方量的空白辅料适量,按供试品溶液制备方法操作,制成空白溶液。
2.2 色谱条件及系统适用性
色谱柱Inertsil ODS-SP C18(150 mm×4.6 mm,5 μm);流动相:甲醇-乙腈-20 mmol·L-1癸烷磺酸钠溶液[含0.04 mol·L-1磷酸二氢钾(磷酸调pH 3.5)]= 600∶100∶300;柱温:35℃;检测波长:238 nm;流速1.0 mL·min-1;进样量:20 μL。
取空白溶液、对照品溶液和供试品溶液,在上述条件下进样,坎地沙坦酯和氨氯地平分离完全,空白辅料不干扰测定,理论板数按两者峰计均大于8000。见图1。

图1 对照品溶液(A)和供试品溶液(B)HPLC图谱
2.3 专属性试验
取坎地沙坦酯、苯磺酸氨氯地平,坎地沙坦酯杂质A、B、C、D、E、F,氨氯地平杂质A适量,用60%乙腈配制成混合溶液,各杂质的浓度为对应主药浓度的20%。结果表明,各杂质均不干扰主峰测定。见图2。
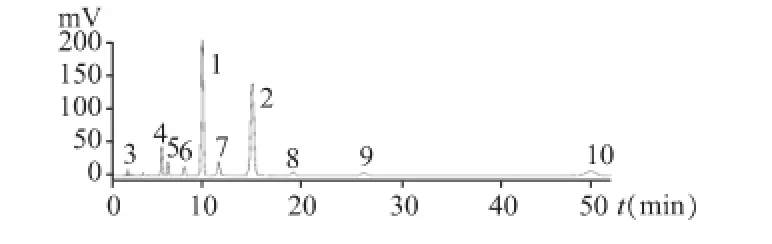
图2 专属性HPLC图谱
2.4 线性关系考察
分别精密量取坎地沙坦酯、氨氯地平对照品储备液3.2、3.6、4.0、4.4、4.8 mL,各置10 mL量瓶中,加60%乙腈稀释至刻度,摇匀。制成坎地沙坦酯浓度为64.61、72.68、80.76、88.84、96.91 μg·mL-1,氨氯地平浓度为40.13、45.14、50.16、55.18、60.19 μg·mL-1的溶液,分别进样测定。以浓度C为横坐标,以各组分峰面积A为纵坐标,进行线性回归,得回归方程为坎地沙坦酯:A=3.76×104C+7.20×104,r=0.9993;氨氯地平:A=5.32×104C+5.41×104,r=0.9993。结果表明,坎地沙坦酯、氨氯地平分别在64.61~96.91 μg·mL-1、40.13~60.19 μg·mL-1浓度范围内线性关系良好。
2.5 进样精密度、重复性和稳定性试验
取对照品溶液,连续进样5次,计算得坎地沙坦酯、氨氯地平峰面积的RSD为0.045%和0.038%。
精密称取同批号(110301)样品,共6份,按供试品溶液制备方法操作,分别进样测定,计算得坎地沙坦酯、氨氯地平含量的RSD为0.58%和0.72%。
取供试品溶液,室温放置,分别于0、2、4、6、8 h进样,计算得坎地沙坦酯、氨氯地平峰面积的RSD为0.61%和0.57%,结果表明本品溶液在8h内稳定。
2.6 回收率试验
按照处方量的20倍,精密称取处方量的空白辅料适量,分别精密加入坎地沙坦酯、氨氯地平对照品适量,按处方比例,制成相当于标示量80%、100%和120%的样品粉末,各3份,按供试品溶液制备方法操作,进样测定,计算得两者的平均回收率为99.94%和100.1%,RSD为1.06%和1.37%。
2.7 样品含量测定
取对照品溶液及3批供试品溶液,分别进样测定,按外标法计算样品含量,3批样品中坎地沙坦酯、氨氯地平的标示含量(%)分别为99.85、100.1、100.3和99.21、99.74、99.83。
3 讨论
3.1 流动相的选择。由于坎地沙坦酯、氨氯地平极性差别较大,为使两者保留时间不要相差过大,在本流动相中添加了离子对试剂,使氨氯地平在有机相比例较高的条件下增加保留。
3.2 专属性考察。在JP16版中坎地沙坦酯片有关物质中以RRT方式提到了5个坎地沙坦酯杂质,经定性,分别为坎地沙坦酯杂质B、C、D、E、F;USP35版中苯磺酸氨氯地平片有关物质中提到了氨氯地平有关物质A,这些特异性杂质在本含量测定条件下均不干扰坎地沙坦酯和氨氯地平的测定。在本品的初步稳定性考察中,观察到这几个特异性杂质是其主要降解产物。
[1] 李勇.2007欧洲高血压指南——联合抗高血压药物治疗应成为普遍适用临床策略[J].心血管病学进展,2007,28(6):847.
[2] 赵晓妍,李丽.坎地沙坦酯氨氯地平片中两种组分的含量测定[J].医药导报,2012,31(9):1203-5.
Content Determination of Candesartan Cilexetil and Amlodipine Tablets by HPLC
MAO Ke1,2,CHEN Ning2*,LU Ding-qiang1,2
1School of Pharmaceutical Sciences;2Jiangsu Province Institute of Materia Medica,Nanjing University of Technology,Nanjing 211800,China
An HPLC method was established for the content determination of candesartan cilexetil and amlodipine tablets.A C18column was used with the mobile phase of methanol-acetonitrile-20mmol·L-1sodium decane-1-sulfonate with 0.04mol·L-1potassium dihydrogen phoshate(pH adjusted to 3.5 with phosphoric acid)-(600∶100∶300)at the detection wavelength of 238nm.This method showed to be specific with better separation of the original drugs from impurities and main degradation products.The calibration curves of candesartan cilexetil and amlodipine were linear in the ranges of 64.61~96.91 μg·mL-1and 40.13~60.19 μg·mL-1,respectively.
RP-HPLC;Candesartan cilexetil;Amlodipine;Determination
R927.2
A
1673-7806(2014)03-226-02
毛柯,女,研究实习员 E-mail:maoke0216@126.com
*通讯作者 陈宁,女,副研究员 E-mail:chening9317@163.com
2014-02-27
2014-03-19