珠江流域部分水源地多环芳烃污染物的生态风险评价研究
刘 珩 李建民 刘昕宇
(珠江流域水资源保护局,广东 广州 510611)
多环芳烃(PAHs)是由矿物燃料(如:煤、石油、天然气等)、木材、纸以及其它含碳氢化合物的不完全燃烧或在还原气氛下热解形成的,通过环境介质(大气、水、生物体等)能够长距离迁移并长期存在于环境中,进而对人类健康和环境带来严重危害,因此,PAHs引起了人们极大的重视[1]。有研究表明,作为优先控制污染物的16种PAHs,在我国环境介质中广泛存在,其中自然水体中更是普遍遭受PAHs的威胁,其中部分水体污染严重[2]。
此项研究以珠江流域部分水源地水体为研究对象,采用自动固相萃取-气相色谱/质谱技术测定其 PAHs的含量水平及组成特征,并且利用物种敏感性分布(Species Sensitivity Distributions,SSD)与效应外推技术这些生态评价方法[3]探讨了水体中 PAHs对水生生物的潜在生态毒性危害,以期为珠江流域水环境中持久性有机污染物的危害评估与监督管理提供新的思路与办法。
1 材料与方法
1.1 样品采集
水源地主要包含在海南、广东和广西3个省区内的9个区域。采集水样时将采样器瓶口浸入距水面 0.1m左右,自然盛满后,立即加入 NaN3(0.5 g·L-1)以抑制微生物作用,再用磨口塞塞紧,用锡箔纸封口。运回实验室在 4℃保存,24h内用0.7μm玻璃纤维滤膜过滤。
1.2 样品预处理
取已过滤水样 1 L,加入一定浓度回收率指示物萘-d8、二氢苊-d10、菲-d10、屈-d12、苝-d12,用 6mol·L-1的盐酸调节pH小于2,加入1%的甲醇溶液混匀,经C18小柱富集。设定ASPE-799固相萃取仪对水样的全自动处理流程如下:依次用5mL二氯甲烷、5mL丙酮、10mL甲醇和10mL超纯水活化C18固相萃取小柱。以10mL·min-1的流速,富集完成后用氮气干燥(同时抽真空)固相萃取柱时间45min,之后用3mL丙酮和3mL二氯甲烷洗脱固相萃取柱中的目标物于浓缩管中,最后用氮气浓缩洗脱液至约0.5mL,加入100μL内标六甲基苯并用乙酸乙酯定容至1mL,摇匀转移至GC-MSD分析。
GC-MSD分析条件:Agilent 7890-5975C,DB-5MS色谱柱(325℃,30m×250μm×0.25μm);采用无分流进样,进样量1μL;载气为高纯氮气;进样口温度 280℃;检测器温度 290℃;采用程序升温,初始温度 50℃,保持 4min,以 8℃·min-1升至300℃,保持5min。全扫描(定性)和选择离子(定量)模式同时采集,全扫描质量范围为 45.0~550.0,其中选择离子扫描的特征离子详见表1[4,5]。
1.3 加标回收实验
采用水样加标回收试验,验证方法灵敏度和精密度。在超纯水中添加多环芳烃混合标准品,添加水平为0.1μg·L-1,6次平行测定后回收率水平在81.6%~100.3%,相对标准偏差为 0.71%~13.3%,检出限为 0.04~9.37 ng·L-1,具有较好的准确度和精密度。
1.4 生态风险评价
1.4.1 SSD法
目前,广泛用于前瞻性生态毒理学风险评估和环境质量标准(EQS)的制定方法的是物种敏感度分布SSD法(Species Sensitivity Distributions),它被被列于欧盟风险评价技术导则(TGD,Technical Guidance Document on risk assessment)的标准方法内,并被美国环境保护署(EPA)推荐用于水生生物物种保护[6]。
利用SSDs方法评价污染物生态风险的步骤是:1)毒理数据的获取与处理;2) 运用模型进行 SSD曲线拟合;3)5%危害浓度 HC5(Hazardous Concentration for 5% of species)与预测无效应浓度(PNEC,predicted no-effect concentration)的推算;4)计算多种污染物累积潜在生态风险影响并评估污染物的联合生态风险[7]。
毒理数据进行对数变换后,进行参数拟合即可得到SSD曲线。SSD参数拟合形式包括Log-normal、Log-logistic和BurrⅢ等类型。由于BurrⅢ型拟合曲线的分布函数形式较灵活,对物种敏感性数据拟合特性相对其他几种拟合曲线较好[9],因此,本研究使用BurrⅢ型分布构建SSD曲线。
BurrⅢ型参数拟合方程为:

式中,x 为环境浓度(μg·L-1),b、c、k为函数的3个参数(下同)。
当k 趋于无穷大时,BurrIII分布模型可变化为ReWeibull分布方程:
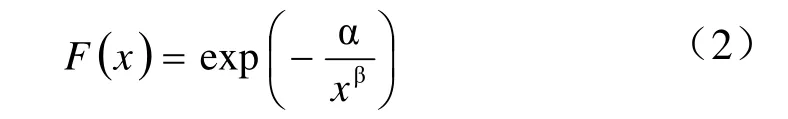
当c趋于无穷大时,则变化为RePareto分布方程:
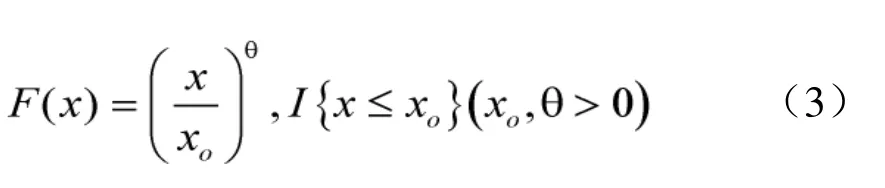
在实际应用中,当 k值大于 100时,则应用ReWeibull分布函数进行拟合;当c值大于80时使用 RePareto分布。澳大利亚联邦科学和工业研究组织 CSIRO(Australia’s Commonwealth Scientific and Industrial Research Organization)提供了该方法的说明以及相关的计算软件 BurrliOZ(CSIRO,2008)。
SSD曲线被用于确定一个可以保护生态系统中绝大部分生物物种的污染物浓度水平,一般使用5%累积概率的污染物浓度(HC5);在 SSD拟合曲线上5%累积概率对应的污染物浓度即为HC5[11]。
BurrIII分布模型计算HC(q)的方程为:
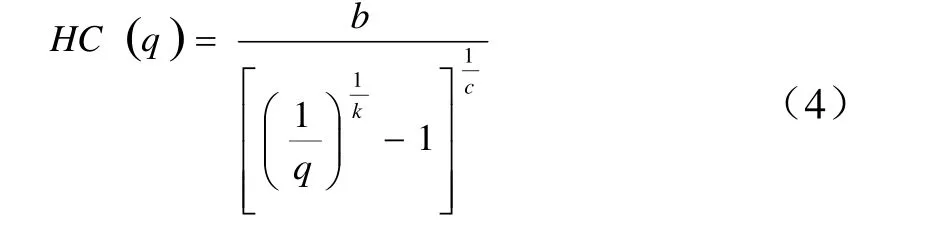
环境预测无效应浓度(PNEC,predicted no-effect concentration)的计算采用SSD曲线5%概率所对应的浓度(HC5)除以评价因子(assessment factor,AF)推导,如式(5)所示。

其中,AF值取5[12]。
1.4.2 效应外推
由于16种美国EPA优控PAHs中尚有部分污染物由于没有足够可用的水生生物暴露-反应数据,比如苯并[a]蒽、苊烯、屈、苯并[b]荧蒽、苯并[k]荧蒽、茚并[1,2,3-cd]芘、荧蒽、二苯并[a,h]蒽、苯并[ghi]苝,它们的预期毒性效应水平是用评价因子(AF)法来推导PNEC,它是用一个实验终点数值与评价因子相除得到的,这些因子的采用源于欧盟风险评价技术指南(EC,2003)。

表2 用于推导设定环境暴露水平评价因子的取值
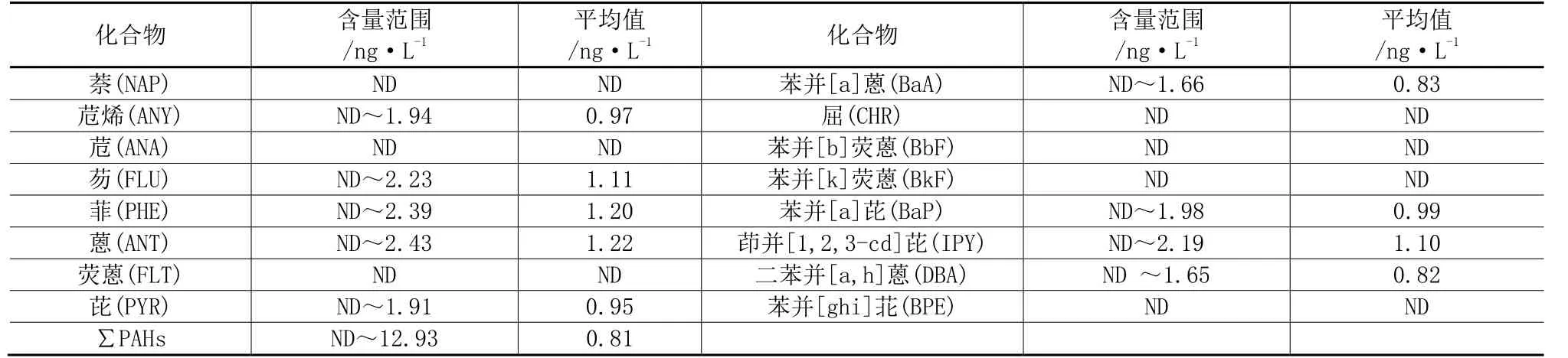
表3 珠江部分水源地水体中PAHs的含量特征
1.4.3 多种污染物累积潜在生态风险计算
根据污染物对生物毒性作用机制相同或不同,可分别采用浓度加和或效应加和模型。然后将得到风险商(risk quotient,RQ)与1进行比较,若RQ<1则表示污染物风险较低,若RQ≥1则表示污染物对水环境生物存在高风险,且RQ值越大风险越高。
对于水体中同时存在的污染物,将具有相同作用机制的符合浓度加和模型的混合物以危害指数(hazard index,HI)表征其风险[10],如式(6):

式中,Eli为组分i的暴露水平;Ali为组分i的环境可接受水平,混合风险商即为各单污染物组分风险商之和。
2 结果与讨论
2.1 PAHs的含量与分布
此项研究检测水体中共 16种美国 EPA优控PAHs(表 2),其含量(∑PAHs)在 ND~12.93 ng·L-1之间(算术平均值为 0.81ng·L-1)。从珠江部分水源地地表水PAHs组成来看(图1),主要以低环化合物为主,其中3环PAHs丰度最高,为70.8%;其次 为4 环,为11.8 %,5环和6环PAHs丰度相差不大,分别为 8.51%和 8.86%。最高浓度出现在邕江水源地,该点距中心城区较近,人类活动频繁。因此,大量生活污水与工业废水的输入是该点PAHs浓度陡增的主要原因。
2.2 生态风险分析
2.2.1 SSDs法拟合结果
通过BurrliOZ软件得到SSDs拟合参数的计算结果见表4。在实际计算中,通过BurrliOZ软件对参数所处不同范围选择不同的分布曲线拟合。
8种PAHs对不同类别生物的HC5值见表5。

图1 珠江部分水源地不同采样点地表水PAHs浓度分布
在分析不同类型污染物对同一种淡水生物以及同一种污染物对不同淡水生物的毒性效应时;如HC5值越小,则毒性效应越大。通过对各污染物HC5的对比,可以得到8种PAHs的毒性效应顺序为:对全部物种,苯并[a]芘>蒽>荧蒽>菲>芘>苊>萘>芴;对脊椎动物(鱼和两栖动物),苯并[a]芘>蒽>荧蒽>菲>芘>萘>苊;对无脊椎动物(包括甲壳类、昆虫蜘蛛类、软体动物、蠕虫以及其他无脊椎动物),苯并[a]芘>荧蒽>蒽>芘>菲>苊>萘>芴。其中脊椎动物的HC5值明显高于无脊椎动物,表明 8种PAHs对无脊椎动物的毒性效应明显高于脊椎动物,这也与随自然界食物链营养级增高,富集作用更加明显,耐受能力更强的理论相符合。而 8种 PAHs中,显然苯并[a]芘的毒性是最强的,它对淡水生物的HC5值比毒性较弱的萘和芴低2个数量级。
其次,我们通过对比急性与慢性数据的分析结果[7,8]可以发现采用急性数据得到的结果明显高于慢性数据,这表明急性数据虽然相对容易得到,但它容易低估PAHs的潜在生态风险。

表4 利用BurrliOZ对SSD拟合参数的计算结果
2.2.2 效应外推
评价因子选取后,得到的8种PAHs对淡水生物的预测无效应预测无效应浓度值见表6。
2.2.3 珠江部分水源地水体中PAHs的生态风险评估
由于研究表明PAHs的致毒机理为PAHs进入机体经代谢活化后生成有毒的中间产物,这些中间产物都将不可逆地损伤细胞的大分子物质(如DNA,蛋白质、脂质),符合浓度加和模型,故采用式(6)计算珠江部分水源地水体中各 PAHs累积潜在生态风险,其中暴露水平以MEC表示,取值为表3中各PAHs平均值,具体结果见表7。
由表7可以看出,在珠江部分水源地水域全部物种中各PAHs危害指数:茚并(1,2,3-cd)芘>二苯并(a,h)蒽>苯并[a]蒽>苯并[a]芘>苊烯>蒽>菲>芘>芴,表明该水域茚并(1,2,3-cd)芘是HI贡献最高的污染物,应为此水域优先控制污染物。就整体来看,珠江部分水源地流域污染物风险较低(RQ=0.944)。
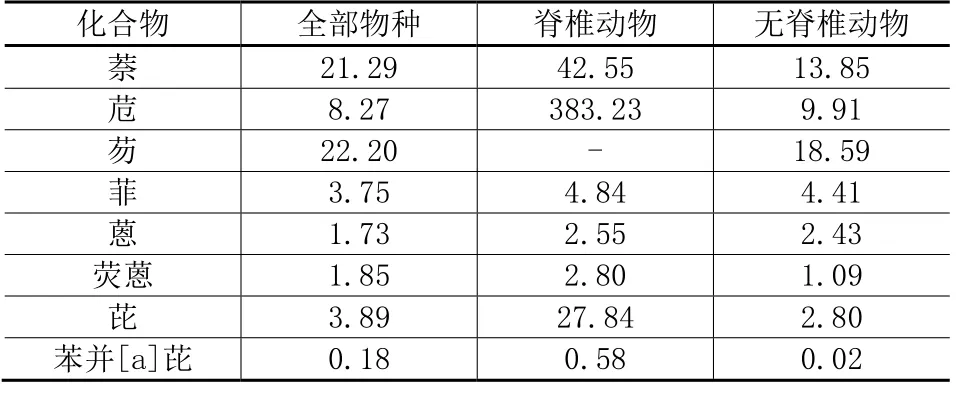
表5 8种PAHs对淡水生物的HC5值(μg·L-1)
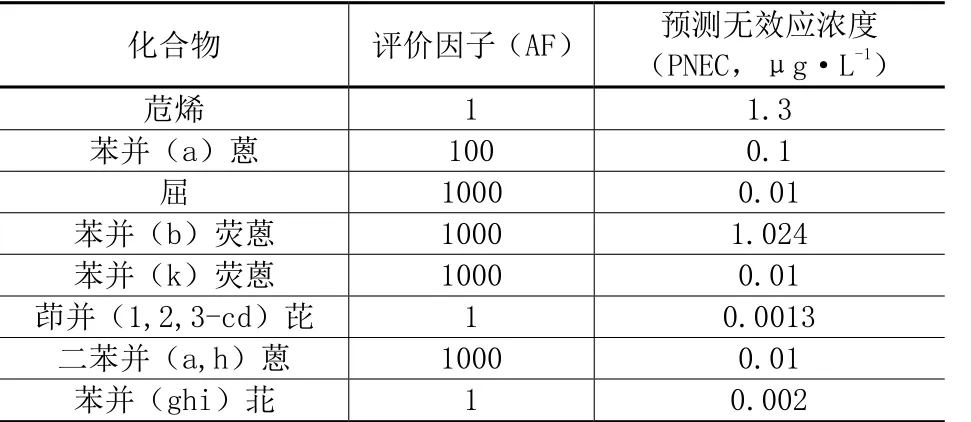
表6 8种PAHs对淡水生物的预测无效应预测无效应浓度值(μg·L-1)
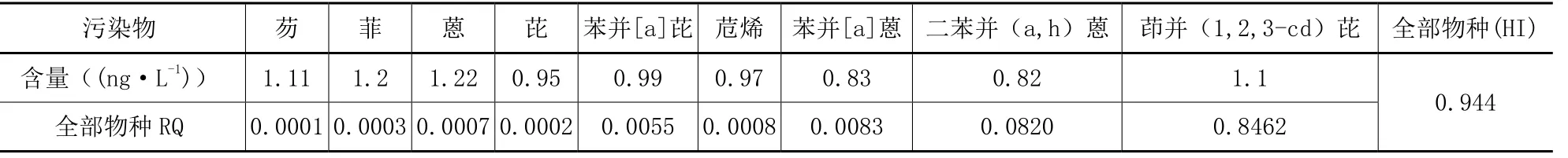
表7 珠江部分水源地水体PAHs含量及其对淡水生物的影响
2.2.4 不同水体多环芳烃的生态风险影响比较
珠江部分水源地与国内的滦河、高屏溪、通惠河等[13~15]不同水体相比,部分水源地与滦河同属于污染较轻的低风险水体;而高屏溪、通惠河的RQ值≥1,PAHs类污染物对水环境生物存在较高风险。高屏溪和通惠河的∑PAHs分别为 430 ng·L-1和 762.343 ng·L-1,通惠河的PAHs总量高于高屏溪,但RQ(通惠河)<RQ(高屏溪),主要为高危害指数的苯并[a]芘类化合物浓度较高。总体来说,珠江部分水源地水域水体存在一定生态风险,但与其他水域相比,珠江部分水源地还是属于污染较轻的低风险水体。
3 结 论
(1)水源地水体中∑PAHs含量在 N.D.~12.93ng·L-1之间,算术平均值为0.81ng·L-1;且主要以低环化合物为主,其中 3~4环 PAHs占∑PAHs的90.4%。与国内外其他水体相比,属于轻度污染。
(2)通过SSD曲线拟合及效应外推得到的HC5值,可以分析不同污染物对同一类别淡水生物以及同一污染物对不同类别淡水生物的生态毒性效应;且HC5值越小,则生态毒性效应越大。通过对8种PAHs的HC5值对比,表明PAHs对无脊椎动物的毒性明显高于脊椎动物。
(3)对珠江部分水源地水体实测数据进行风险评估结果显示,就整体来看珠江部分水源地流域污染物风险较低,但对水环境中无脊椎动物而言,仍存在风险,且主要贡献来自于茚并(1,2,3-cd)芘。
(4)SSD物种敏感性分布曲线与生态效应外推技术在已被广泛应用于生态风险评价与水环境质量标准的制定,今后在我国它也将会有比较广阔的应用前景。
[1] Wang Y L,Xia Z H,Liu D,et al.Multimedia fate and source apportionment of polycyclic aromatic hydrocarbons in a coking industry city in Northern China[J]. Environmental Pollution, 2013,181: 115-121.
[2] 程家丽,黄启飞,魏世强,等.我国环境介质中多环芳烃的分布及其生态风险[J].环境工程学报,2007,1(4):138-143.
[3] Guo G H,Wu F C,He H P,et al.Distribution characteristics and ecological risk assessment of PAHs in surface waters of China[J].Science China-Earch Sciences, 2012, 55(6):914-925.
[4] 中华人民共和国卫生部.GB/T5750-8-2006.生活饮用水标准检验方法—有机物指标[S].北京:中国标准出版社,2006.
[5] Jesenska S,Nemethova S,Blaha L.Validation of the species sensitivity distribution in retrospective risk assessment of herbicides at the river basin scale—the Scheldt river basin case study[J]. Environmental Science Pollution Research, 2013,20:6070-6084.
[6] 刘 良,颜小品,王 印,等.应用物种敏感性分布评估多环芳烃对淡水生物的生态风险[J].生态毒理学报,2009,4(5):647-654.
[7]maltby L,Brock T Cm, Van den Brink P J. Fungicide risk assessment for aquatic ecosystems: Importance of interspecific variation, toxicmode of action, and exposure regime[J].Environmental Science & Technology, 2009, 43(19): 7556-7563.
[8] 蒋丹烈,胡霞林,尹大强.应用物种敏感性分布法对太湖沉积物中多环芳烃的生态风险分析[J].生态毒理学报,2011,6(1):60-66.
[9] 徐瑞祥,陈亚华.应用物种敏感性分布评估有机磷农药对淡水生物的急性生态风险[J].湖泊科学,2012,24(6):811-821.
[10] 应光国,彭平安,赵建亮,等.流域化学品生态风险评价[M].北京:科学出版社,2012: 20-22.
[11] Li G C, Xia X H, Yang Z F. Distribution and sources of polycyclic aromatic hydrocarbons in themiddle and lower reaches of the Yellow River, China[J]. Environmental Pollution,2006, 144: 985-993.
[12] Feng C L, Xia X H, Shen Z Y, et al. Distribution and sources of polycyclic aromatic hydrocarbons in Wuhan section of the Yangtze River, China[J]. Environmonit Assess, 2007, 133:447-458.
[13] 曹治国,刘静玲,栾 芸,等.滦河流域多环芳烃的污染特征、风险评价与来源辨析[J].环境科学学报,2010,30(2):246-253.
[14] Zhang S Y, Zhang Q, Shameka D, et al. Simultaneous quantification of polycyclic aromatic hydrocarbons (PAHs),polychlorinated biphenyls(PCBs), and pharmaceuticals and personal care products (PPCPs) inmississippi river water, in New Orleans, Louisiana, USA [J]. Chemosphere, 2007,66:1057-1069.
[15] Fernandesm B, Sicrem A, Boireau A, et al. Polycyclic aromatic hydrocarbon (PAHs) distributions in the Seine River and its estuary[J].marine Pollution Bulletin,1997, 34: 857-867.

