注射用盐酸头孢吡肟与3种输液配伍的高分子杂质研究
高 红,黄小琴,吕白桦,王莉萍
(重庆科瑞制药<集团>有限公司,重庆 400060)
注射用盐酸头孢吡肟为广谱第4代头孢菌素,对革兰阳性菌和革兰阴性菌均有较强的抗菌活性,适用于各种敏感细菌所致下呼吸道、皮肤和骨组织、泌尿系统、妇科和腹部感染以及菌血症等。控制产品中高分子杂质是减少β-内酰胺类抗生素过敏反应的重要途径之一[1]。参考文献[2-3],对注射用盐酸头孢吡肟在3种输液中高分子杂质的稳定性进行了考察,以期为临床合理用药提供依据。
1 仪器与试药
Agilent 1200型高效液相色谱仪(安捷伦科技有限公司)。头孢噻肟对照品(中国食品药品检定研究院,批号为130483-200904);注射用盐酸头孢吡肟(重庆科瑞制药<集团>有限公司,批号为20100702);磷酸氢二钠(分析纯);磷酸二氢钠(分析纯);10%葡萄糖注射液(10%GS,批号为20110325)、5%葡萄糖氯化钠注射液(5%GNS,批号为 20120312)、0.9% 氯化钠注射液(0.9%NS,批号为20120322),均为太极集团西南药业股份有限公司产品。
2 方法与结果
2.1 高分子杂质测定
2.1.1 色谱条件与系统适用性试验
色谱柱:G-10凝胶色谱柱(依利特,300 mm×15 mm);流动相:A 为以 pH =7.0 的 0.1 mol/L 磷酸盐缓冲液,磷酸氢二钠21.85 g 和磷酸二氢钠 6.08 g,加水 1 000 mL,调 pH 为 7.0,流动相 B 为水;流速:0.5 mL /min;检测波长:254 nm。精密量取 0.2 g/L蓝色葡聚糖2 000溶液100 μL注入液相色谱仪,分别以流动相A和B进行测定,记录色谱图。按蓝色葡聚糖2 000峰计算理论板数均不低于500,拖尾因子均应小于2.0。在2种流动相系统中,蓝色葡聚糖2 000峰的保留时间比值为0.93~1.07。以流动相B为流动相,精密量取对照品溶液100 μL,连续进样5次,峰面积的相对标准偏差(RSD)应不大于5.0%。
2.1.2 测定方法
取头孢噻肟对照品适量,精密称定,加水溶解并定量稀释制成每1 mL中约含400 μg的溶液,摇匀,作为对照品溶液。取供试品适量,精密称定,加配伍溶液制成每1 mL中约含头孢吡肟40 mg的溶液,作为供试品溶液。进样量100 μL,以流动相A进行测定,记录色谱图;另取对照品溶液注入液相色谱仪,以流动相B为流动相,记录色谱图。按外标法以峰面积计算(头孢噻肟 ∶头孢吡肟 = 1.0 ∶0.94)。
2.1.3 方法学考察
定量限及检测限确定:取头孢噻肟对照品适量,精密称定,用水稀释成一系列浓度的溶液,以流动相B进行测定,记录色谱图。检测限为 0.019 g/L(S/N =3),定量限为 0.071 g/L(S /N =10)。
线性关系考察:制备系列的对照品溶液,质量浓度范围为规定质量浓度的50%,100%,200%,各3份样品,分别用3种配伍溶液溶解后,以测得的高聚物峰面积对溶液质量浓度进行线性回归,相关系数 r应大于0.99。考察结果见表1。
精密度试验:取头孢噻肟对照品溶液,依法重复进样6次。结果的 RSD为0.1%(n=6),表明仪器精密度良好。
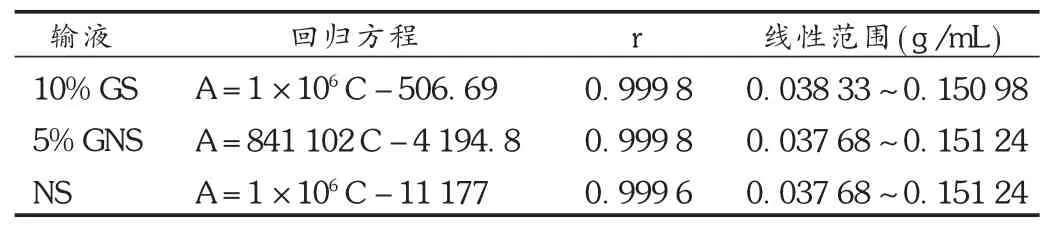
表1 供试品溶液在3种输液中的高分子杂质测定线性关系考察结果
重复性试验:分别精密称取同一批次样品6份,采用配伍溶液依法制备供试品溶液并测定。结果10%GS,5%GNS,NS配伍液中高分子杂质量的 RSD 分别为 2.3% ,3.2% ,2.6% (n=6),表明该方法重复性良好。
2.2 配伍稳定性试验
取供试品适量,依法配制,各溶液均于室温30℃下放置,分别在 0,15,30,45,60,120,240,360,480 min 时测定高分子杂质的量。结果见表2。
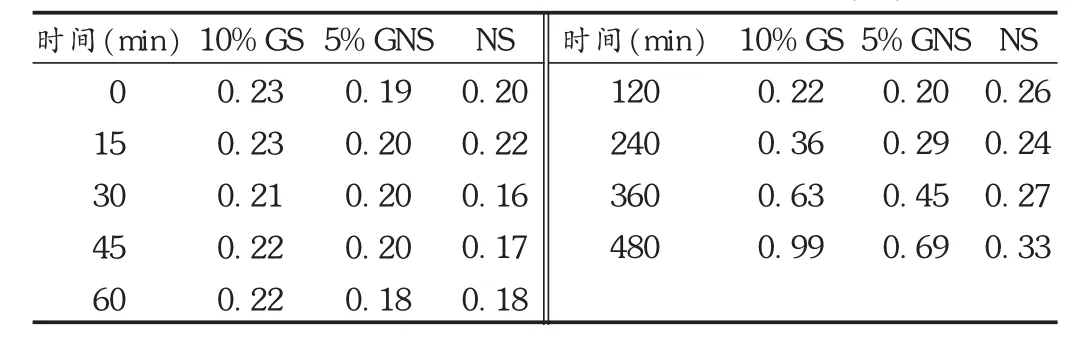
表2 样品配伍液中高分子杂质含量测定结果(%)
3 讨论
注射用盐酸头孢吡肟在临床的应用日趋广泛,但关于其在不同输液中高分子杂质的稳定性尚未见报道。因此,在参考文献的基础上,采用高效液相色谱法成功考察了注射用盐酸头孢吡肟与3种输液的配伍液中高分子杂质的稳定性。试验结果显示,在室温30℃条件下,注射用盐酸头孢吡肟分别与10%GS,5%GNS,NS配伍,2 h内高分子杂质基本稳定,且与 NS配伍6 h内高分子杂质基本稳定。注射用盐酸头孢吡肟最好与NS配伍使用。
参考文献:
[1]李哲媛,李玉凤,范 兵.阿莫西林中高分子杂质的测定与质量分析[J].中国现代应用药学杂志,2006,23(4):326-327.
[2]陈 颖,廖惠惠,杨 帆.凝胶色谱法测定注射用盐酸头孢吡肟中的高分子 杂质[J].广东药学院学报,2007,23(6):663 -664.
[3]刘诗琼,王文渊,李世胜.注射用盐酸头孢吡肟与4种常用输液配伍的稳定性研究[J].中国医药导报,2009,6(4):15 -17.

